基于叶绿体基因序列黄精和多花黄精遗传多样性分析
2021-07-24关佳莉拱健婷王大仟张金霞赵艺萌
丛 悦 ,李 莉,关佳莉 ,拱健婷 ,王大仟 ,张金霞 ,赵艺萌
(北京市临床药学研究所,北京 100035)
中药黄精为百合科植物黄精PolygonatumsibiricumRed.、多花黄精Polygonatum cyrtonemaHua或滇黄精Polygonatum kingianumColl. 的干燥根茎。味甘,性平,具有补气养阴、健脾等功效[1-2]。我国黄精品种分布广泛,三种基原植物有一定地域性。作为药食两用品种,近年来黄精市场需求激增,野生资源采伐过度。由于野生资源枯竭导致的种质遗失以及人工育苗成本较高等原因,使得黄精种质退化、混乱现象较为严重,因此开展黄精种质资源研究, 评估不同地理居群遗传多样性和遗传结构,对促进黄精的资源保护和可支持发展十分必要。
叶绿体DNA是单倍型、母系遗传,具有无等位基因重组、通过种子流交流、非编码序列多态性位点丰富的特点,是研究种间较低分类阶元和种内谱系地理学较为理想的分子标记。一些研究者已利用ISSR[3]、SCoT[4]、核糖体ITS序列[5]等分子标记技术对黄精遗传多样性、系统发育、分子鉴定等方面进行了研究,但基于叶绿体DNA序列的黄精遗传分析研究较少。本研究利用具有较快进化速率的3个叶绿体基因序列psbA-trnH、rpl20-rps12和trnL-trnF[6],对较多分布于东北及华北地区内的16个野生和栽培黄精居群,以及我国东南部4个野生多花黄精居群进行研究,旨在了解取样范围内黄精和多花黄精的遗传多样性及其群体遗传结构,为黄精的资源保护和遗传育种等研究提供一定的分子依据。
1 材料与方法
1.1 材料
于 2019年 4 月至 10月对分布于辽宁、河北、山西、陕西、浙江、广西6省区黄精和多花黄精居群取样,每个居群选取3~10棵植株,植株之间相距30~50 m,每棵植株采集新鲜叶片并立即用硅胶干燥,-80 ℃长期保存。黄精采集12个野生居群68个植株和4个栽培居群26个植株,多花黄精采集4个野生居群26个植株,样品信息见表1。样品由北京市中药研究所李莉研究员鉴定,保存于北京中药研究所黄精种质资源圃。
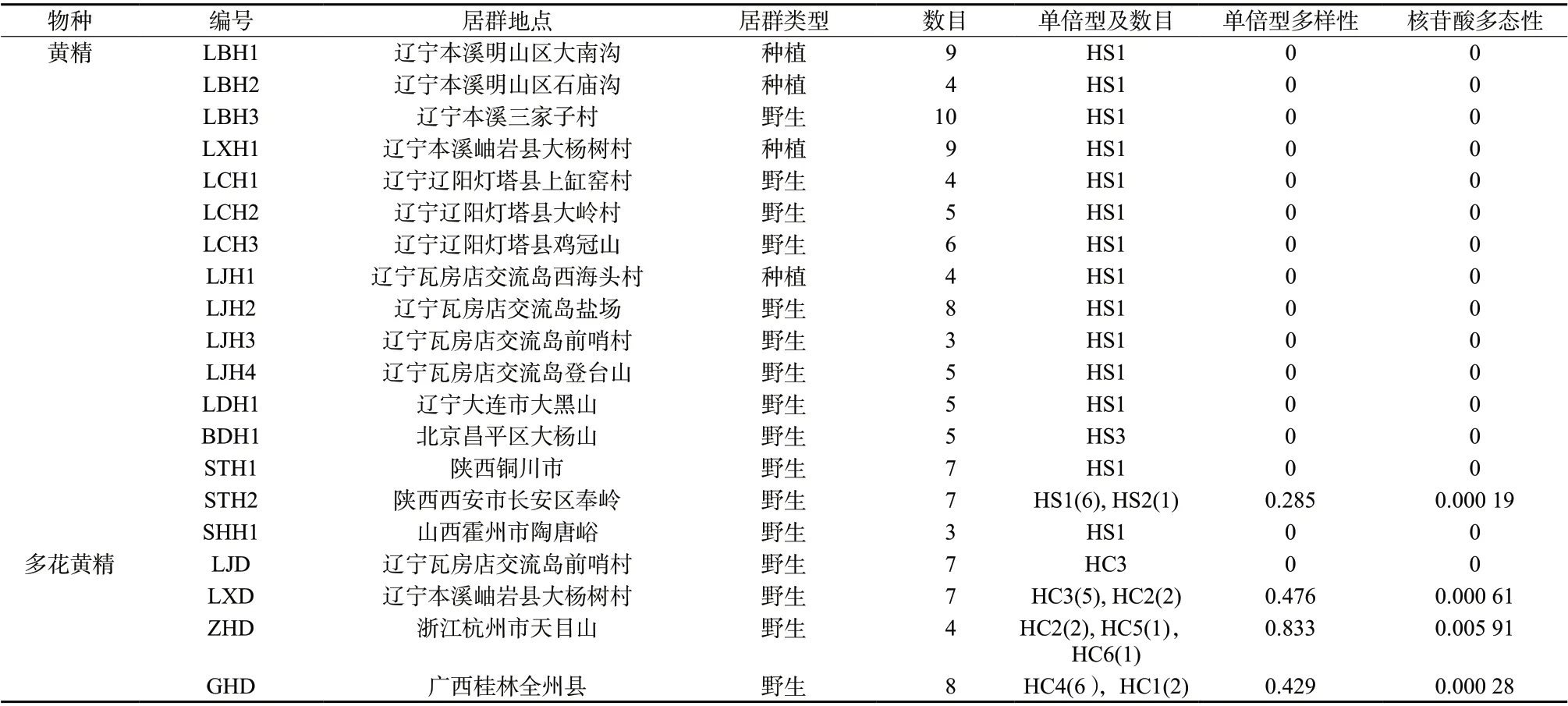
表1 试验样品信息和居群单倍型遗传多样性组成Tab. 1 The samples information and haplotype diversity of two species populations of Polygonatum
1.2 方法
1.2.1基因组总 DNA提取 、PCR扩增及测序取叶片材料0.5 g放入预冷的研钵中,加液氮充分研磨成细粉。快速植物基因组DNA提取试剂盒(天根生化科技公司)进行总DNA提取,1% 琼脂糖凝胶电泳检测DNA提取结果,分光光度计测 DNA的浓度和纯度。从文献中描述的常用于居群遗传分析的叶绿体 DNA 片段中选取10个片段进行筛选,最终得到3个易于扩增、变异位点较多的叶绿体 DNA片段:psbA-trnH、rpl20-rps12和trnL-trnF序列,引物由上海生工生物工程技术有限公司合成,所用引物序列及扩增条件见表2。PCR 扩增反应在25 μL 体系中完成,反应体系:灭菌 ddH2O 10.2 μL,2 × Ultra HiFi Mix 15 μL,引物各2.5 μmol /L,DNA模板20 ng。扩增程序为: 94 ℃预变性5 min; 95 ℃变性10 s,54~56 ℃退火30 s,72 ℃延伸1 min,共 35个循环,最后于72 ℃延伸15 min。PCR 扩增产物经检测合格后送上海生工生物工程有限公司双向测序。

表2 PCR反应引物扩增信息Tab.2 Amplification information of PCR reaction
1.2.2数据处理 测序峰图使用Conting Express软件进行正反比对并手工进行校正,经ClustalX ver.1.81比对排列,去除前后两端低质量区,将序列中所有插入或缺失片段以单碱基突变处理。DnaSP ver.5.10 软件统计变异位点和叶绿体序列单倍型,计算居群的单倍型数量、单倍型多样性和核苷酸多态性。Permut 软件计算居群内平均遗传多样性HS 、总的遗传多样性HT和居群间遗传分化系数 GST 和 NST值。Arlequinv 3.5软件对居群进标准分子变异分析,1 000次排列检测不同分组变异的差异显著性,统计计算群体内及群体间的变异方差分布及群体遗传分化系数(Fst)。MEGA ver.5 软件以Kimura 2-parameter (K2-P)模型计算群体间的遗传距离,1 000次重复自展程序进行标准误检测,采用邻接 N-J(Neighbor-Joining)法构建基于K2-P距离的群体聚类图。
2 结果与分析
2.1 叶绿体基因序列差异及单倍型分布
叶 绿 体psbA-trnH、rpl20-rps12和trnL-trnF片段成功测序16个居群94个黄精个体,将3个序列联合分析,比对后发现总序列长度变化范围为1 475~1 480 bp,其中包含1 个碱基突变位点,1 个插入缺失位点,2个变异位点得到3个单倍型,单个居群的单倍型多样性为 0~0.285,核苷酸多态性为0~0.000 19。15个黄精居群共享HS1单倍型,BDH1居群(北京大杨山)独享HS3单倍型,STH2居群(陕西西安)中2株样品为HS2单倍型,其余样品为HS1单倍型。 多花黄精居群3个片段总序列长度变化范围为1 539~1 564 bp,其中包含12个碱基突变位点,4个插入缺失位点,得到6个单倍型,单个居群的单倍型多样性为 0~0.833,核苷酸多态性为0~0.005 91。ZHD居群(浙江杭州)单倍型多样性最高(Hd =0.833),共有HC2、HC5、HC6 3种单倍型;其次是GHD(广西桂林)和LXD(辽宁岫岩)居群,各有2种单倍型(Hd = 0.476 / 0.429)。HLD(辽宁瓦房店)和LXD居群共享HC3单倍型,LXD和ZHD居群共享HC2单倍型,见表1和表3。

表3 3个叶绿体DNA片段的单倍型多态性位点Tab. 3 Variable sites of three chloroplast DNA sequences haplotypes
2.2 居群遗传结构分析
对黄精3种单倍型进行Permut计算结果表明,黄精居群总的遗传多样性为0.142,居群内平均遗传多样性为0.108,说明黄精具有较低的遗传多样性;居群间遗传分化系数 GST为0.874, 略小于NST =0.875,表明在整个分布区不存在明显的分子谱系地理学结构。分子变异分析显示黄精的种群变异主要源于居群间,居群间的遗传变异为69.83%,显著高于居群内的遗传变异30.17%,具有较高的遗传分化系数Fst = 0.698 3。多花黄精居群总的遗传多样性为0.857,居群内平均遗传多样性为0.435,说明多花黄精具有中低度水平的遗传多样性; 居群间遗传分化系数 GST为0.493,大于NST =0.450,表明在多花黄精分布区不存在分子谱系地理学结构。分子变异分析显示多花黄精的种群变异主要源于居群间,居群间的遗传变异为59.33%,而居群内的遗传变异为40.67%,遗传分化系数Fst = 0.593 3,见表4和表5。
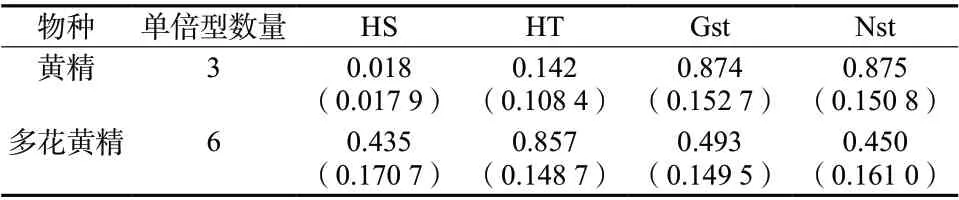
表4 居群遗传结构参数Tab. 4 Genetic structural parameters of two species populations of Polygonatum
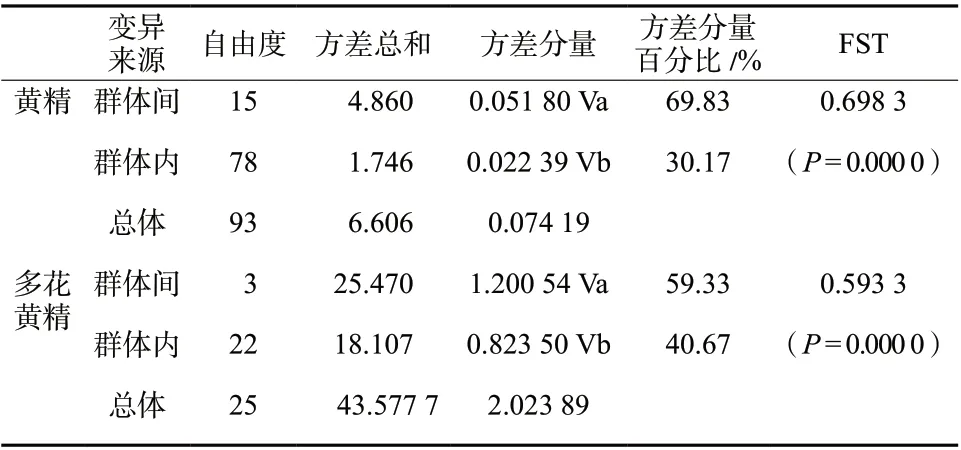
表5 居群叶绿体基因单倍型分子方差分析Tab. 5 Analysis of molecular variance for cpDNA haplotypes
2.3 居群聚类分析
依据遗传距离采用邻接法对16个黄精居群和4个多花黄精居群进行聚类分析。16个黄精居群和广西桂林多花黄精居群 (GHD)聚为一支,其它3个多花黄精居群聚成另一支,见图1。辽宁岫岩(LXD)和辽宁瓦房店(LHD)聚为一支后再与浙江杭州(ZHD)汇成一支。
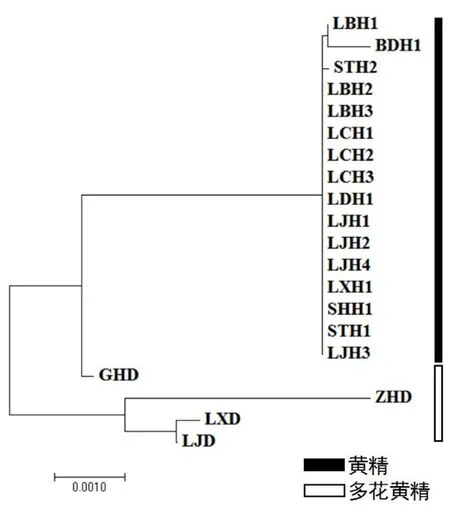
图1 基于群体间遗传距离构建的16个黄精居群和4个多花黄精居群NJ 系统树Fig.1 NJ phylogenetic tree of 16 populations of P. sibiricum Red and 4 populations of P. cyrtonema Hua based on genetic distance of populations
3 讨论
遗传多样性是决定了物种适应外界生长环境能力的高低。遗传多样性越高,进化速率越快,说明该居群对环境的适应能力就越强[7]。本研究测定96个黄精植株和26株野生多花黄精分析发现多花黄精总的遗传多样性和居群内平均遗传多样性均高于黄精居群,表现出较高的遗传多样性。
物种的遗传多样性水平主要受植物的地理分布、繁育系统和有效群体大小的影响,并且普遍认为栽培居群的遗传多样性要低于野生居群[8]。本研究中,黄精野生居群和栽培居群的遗传多样性水平均处于较低水平,二者遗传多样性几乎没有差异。东北地区黄精生境破坏严重,导致有效群体严重减小,遗传漂变概率增加,因此遗传多样性降低。同时,栽培黄精长期无性繁育也导致了引种居群遗传均质化。张恒庆等[9]利用ISSR比较分析大连地区黄精与多花黄精遗传多样性,发现黄精种群遗传多样性明显低于多花黄精与本研究结果较为一致。从植物进化历史角度来看,黄精属植物处在较活跃的分化阶段,多花黄精所属的互叶系相对黄精所属的轮叶系是相对进化的类群[10],因此多花黄精表现出较高的遗传多样性。
群体的遗传结构能够反映群体在进化过程中所经历的突变、重组、遗传漂变及选择效应等因素。研究中发现黄精和多花黄精居群都存在较高的遗传分化(Fst = 0.698 3 / 0.593 3),居群间分化大于居群内(69.83% > 30.17% , 59.33% > 40.67%)。造成遗传分化较高的原因与其生长环境有关。黄精和多花黄精一般生长在生林、灌丛和山坡阴处,生境阻隔限制了基因交流,群体不易扩散。此外,在自然状态下种子成熟所需的时间较长,繁殖能力低,向外扩散的能力有限,因此也造成群体间的基因交流受阻。
基于遗传距离的居群聚类分析显示,相对于其它多花黄精居群,GHD居群遗传距离与黄精更为接近,与黄精聚为一支。黄精作为多基原药用植物,由于各类群间性状交叉,地理分布区重叠,互生叶系与轮生叶系植物一直存在差异减小的现象[11],因此处于比较活跃分化期的黄精属植物存在种间杂交现象。辽宁多花黄精LJD和LXD两个居群聚为一支,表现出一定的地理相关性,但由于居群数目较少,有待于扩大样本进一步分析。
4 结论
本研究结果显示,在所收集区域内黄精居群序列变异小,具有较低的遗传多样性,多花黄精居群序列变异较为丰富,表现出更高的遗传多样性。遗传结构分析显示,两个种群均有较高的遗传分化系数,种群变异主要来源于居群间。通过比较群体间遗传分化系数发现,黄精和多花黄精在整个分布区不存在明显的分子谱系地理学结构。本研究采用叶绿体DNA分子标记方法对黄精和多花黄精进行了遗传多样性的分析,为阐明其系统分类、资源鉴定和资源保护措施制定等方面提供了依据。
