南方红豆杉总多糖增强紫杉醇对S180荷瘤小鼠肿瘤抑制作用机制研究
2021-07-24余陈欢罗益远
蔡 伟,余陈欢,罗益远 ,刘 姝
(1.浙江医药高等专科学校 中药学院,浙江 宁波 315500; 2.杭州医学院 实验动物中心,浙江 杭州 310053)
南方红豆杉Taxus chinensis(Pilg.)Rehd. var.mairei(Lemee et Levl.)Cheng et L. K.Fu是目前我国常用中药材,味辛、甘,性大温,归胃、肝经,具有解毒、散结、止痛等功效,临床上用于治疗肺癌、乳腺癌、宫颈癌等,现代研究表明其有效成分主要为紫杉醇等紫杉烷类成分以及黄酮、多糖类等成分[1]。紫杉醇抗肿瘤作用时常常产生严重的毒副作用,且易产生耐药性,限制了其在临床上的使用[2]。随着抗肿瘤中药的深入研究,部分中药及其活性成分的实验结果表明其具有良好的增效减毒作用[3-5]。
本课程组前期研究了南方红豆杉中总黄酮、总多糖及其与紫杉醇配伍对4T1、A549、MCF-7细胞增殖抑制率的影响以及对荷瘤小鼠移植瘤生长的抑制情况,发现总多糖能够增强紫杉醇体外对4T1、A549、MCF-7细胞以及体内对S180荷瘤小鼠移植瘤的抑制作用,体内总多糖减轻紫杉醇抗肿瘤时的骨髓抑制毒副作用[6]。结果表明紫杉醇可以通过配伍南方红豆杉总多糖达到增效减毒作用,但该作用的具体机制尚不明确。
因此,本研究通过建立S180小鼠荷瘤模型,采用HE染色、TUNEL染色、免疫组化、Western blot等方法对南方红豆杉总多糖与紫杉醇联用抗肿瘤作用机制进行初步研究,为进一步高效、综合利用南方红豆杉资源提供研究思路,并且为减少紫杉醇临床用量、耐药性等提供实验数据。
1 材料与方法
1.1 材料
1.1.1仪器 RM2235型石蜡切片机(德国莱卡公司);TM 3型石蜡包埋机(英国Shandon Histocentre公司);BX20型荧光显微镜摄像机(日本奥林巴斯公司);TGL-16G型低温高速离心机(上海飞鸽公司);165-1801型电泳槽(美国伯乐公司);WSE-4040型半干转膜仪(ATTO CORPORATION);YT-613型拷片机(湖北省孝感亚光运用电子技术研究所);DSHZ-300型多用途水浴恒温震荡器(江苏太仓实验仪器厂);LD-UPWF型纯水仪(美国密理博公司);GNP-9080型隔水式恒温培养箱(中国上海精宏医疗设备有限公司)。
1.1.2材料与试剂 紫杉醇(临用前生理盐水稀释,HPLC ≥ 98%,上海金穗生物科技有限公司,批号:124977-28-5);过硫酸铵、丙烯酰胺、中性树胶(西格玛公司);考马斯亮蓝G250和R250(上海研域试剂有限公司,批号:140306);蛋白酶K(上海江莱生物科技有限公司,批号:140306);石蜡(浙江东腾蜡业有限公司);二甲苯(分析纯)(嘉兴市中昊化工有限公司);丽春红(上海恒远生物科技有限);PVDF膜(上海丽臣生物科技有限公司);Trizol(美国英杰生命技术公司)。
山羊抗小鼠二抗(HRP标记)购自苏州拜吉氏生物科技有限公司;免疫组化检测EnVisionTM试剂盒购自丹麦DAKO公司;β-catenin抗体(BA0426)、CDK4抗 体(BA0310) 、Survivin抗 体(BA1420)购自武汉博士德生物技术有限公;Cyclin-Dl抗体(sc-8396)、Bcl-2抗体(sc-492)、Bax抗体(sc-526)购自美国Santacruz公司。
1.1.3药材 南方红豆杉采自浙江省宁海县双峰乡种植基地,经浙江中医药大学俞冰副教授鉴定为正品南方红豆杉Taxus chinensis(Pilg.)Rehd. var.mairei(Lemee et Levl.)Cheng et L. K.Fu,总多糖由浙江医药高等专科学校实验室提取分离,纯度 > 50%[6]。
1.1.4动物、瘤株 鼠肉瘤S180肿瘤细胞由浙江省医学科学院分子医学中心提供;ICR小鼠,40只,雌雄各半,体质量为(20 ± 3)g,购于浙江省医学科学院动物中心,生产许可证:SCXK(浙)2014-0033,使用许可证:SYXK(浙)2014-0113。
1.2 方法
1.2.1分组、造模与给药 将冻存的鼠肉瘤S180肿瘤细胞悬液接种到ICR小鼠腹腔内传代,无菌条件下抽取腹水,冰浴条件下灭菌生理盐水稀释,混匀制成1×106个/mL肿瘤细胞混悬液(镜下计数)。取ICR小鼠40只,雌雄各半,按混交均匀表随机分为4组,每组10只。将S180肿瘤细胞混悬液按每只0.2 mL接种于小鼠右侧腋窝皮下。3组给药组分别按紫杉醇0.025 mg/g、红豆杉多糖1.332 mg/g、紫杉醇0.025 mg/g +红豆杉多糖1.332 mg/g进行分组灌胃给药,另1组给予生理盐水,作为模型对照组,接瘤后连续给药7 d,停药后第2天,将肿瘤块完整剥下[6],称量离体瘤块重量,计算各组抑瘤率:抑瘤率(%) =[(模型组平均瘤重-实验组平均瘤重)/模型组平均瘤重] × 100%。
1.2.2HE染色肿瘤组织病理检测 上述肿瘤组织常规石蜡包埋切片(厚度:4 μm),HE染色,光镜下观察肿瘤组织病理特征。
1.2.3TUNEL染色检测肿瘤组织细胞凋亡 上述肿瘤组织,常规石蜡包埋切片(厚度:4 μm),TUNEL染色,光学显微镜下观察并记录实验结果。结果判断:阳性细胞核呈棕色或黄色颗粒状;阴性细胞核呈蓝色,无棕色颗粒。每张切片在显微镜200倍视野下,计数200个以上细胞中染色阳性的细胞数,换算成凋亡标记指数。凋亡指数(%) =(视野内的阳性细胞数/视野内总的细胞数)×100%,然后进行统计分析。
1.2.4免疫组化染色法检测肿瘤组织中β-catenin、Cyclin-Dl、CDK4、Bcl-2、Bax以 及Survivin蛋白的表达 上述肿瘤组织在中性缓冲福尔马林(pH = 7.4)固定12 h后取材脱水、石蜡包埋、切片,具体操作步骤按试剂盒说明书进行。镜下观察结果:在细胞浆和/或核内出现黄、棕色颗粒为阳性细胞。
β-catenin、Bcl-2、Bax和Survivin染色结果阳性反应产物主要位于移植瘤的肿瘤细胞浆内,少量在移植瘤的血管内皮细胞。Cyclin-Dl阳性表达在移植瘤的肿瘤细胞核内表达,CDK4阳性表达主要于移植瘤的肿瘤细胞核和细胞浆表达。
阳性计数如下:每张切片在200倍视野下计数,计数200个细胞中染色阳性的细胞数,换算成阳性率:阳性率(%)=(视野内的阳性细胞数/视野内总的细胞数)×100%,然后进行统计分析。
1.2.5Western blot检测分析Bcl-2、Bax和Survivin蛋白水平 在采用免疫组化染色初步定性Bcl-2、Bax、Survivin蛋白表达后,进一步采用Western blot对Bcl-2、Bax、Survivin蛋白进行定性和定量检测分析。取出冷冻保存的肿瘤组织,按Western blot检测步骤进行实验,对X光片上的蛋白带进行扫描和半定量分析。
1.2.6统计学方法 用SPSS17.0软件进行数据分析,计量资料用均数 ± 标准差(±s)表示,多组间比较采用单因素方差分析。以P< 0.05为差异具有统计学意义。
2 结果与分析
2.1 瘤重及抑瘤率结果
联合用药组对比模型组、紫杉醇组及多糖组,瘤重减少,肿瘤抑制率增加(P< 0.05),结果见表1。
表1 各组瘤重及抑瘤率(±s, n = 10)Tab. 1 Tumor weight and tumor inhibition rate in each group (±s, n = 10)
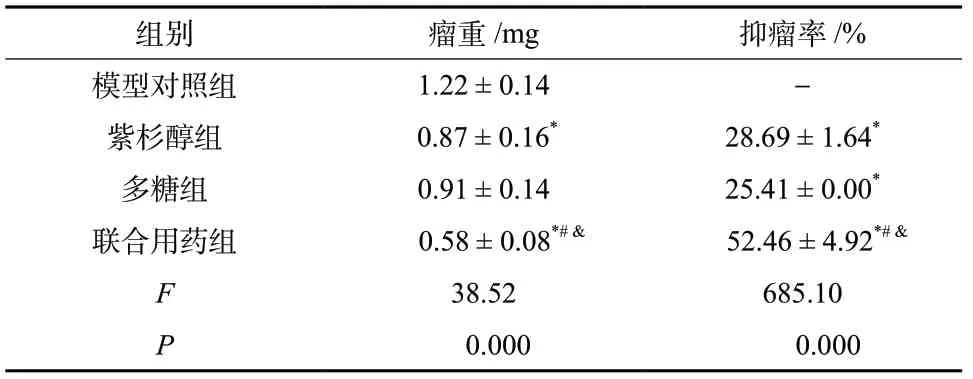
表1 各组瘤重及抑瘤率(±s, n = 10)Tab. 1 Tumor weight and tumor inhibition rate in each group (±s, n = 10)
注:与模型组比较,*P < 0.05;与紫杉醇组比较,#P < 0.05;与多糖组比较,&P < 0.05
组别 瘤重/mg 抑瘤率/%模型对照组 1.22 ± 0.14 -紫杉醇组 0.87 ± 0.16* 28.69 ± 1.64*多糖组 0.91 ± 0.14 25.41 ± 0.00*联合用药组 0.58 ± 0.08*#& 52.46 ± 4.92*#&F 38.52 685.10 P 0.000 0.000
2.2 肿瘤组织病理HE染色结果
肿瘤组织的HE染色结果显示(见图1),模型组肿瘤组织表现出典型的肿瘤病理特征,即肿瘤细胞丰富、密集,细胞核大、不规则,细胞浆少等。与模型组相比,用药后肿瘤细胞数减少,核皱缩,其中多糖组、紫杉醇组视野范围内肿瘤细胞数减少较多,并出现较大的间隙;联合用药组相比紫杉醇组、多糖组,肿瘤细胞数目更少,形成的间隙更大。
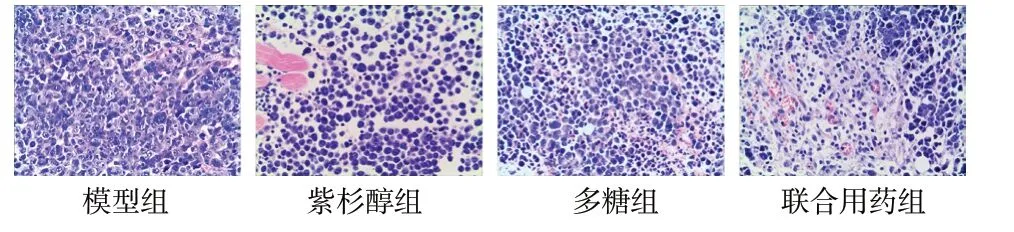
图1 S180小鼠肿瘤组织HE染色照(±s, n = 3, × 200)Fig.1 HE staining photograph of tumor tissue in S180 mice(±s, n = 3, × 200)
2.3 肿瘤组织细胞凋亡结果
肿瘤组织TUNEL染色结果(见图2),模型组几乎全是细胞核被苏木素染为蓝色的活细胞,仅见少数几个棕色凋亡细胞,紫杉醇组、多糖组、联合用药组棕色凋亡细胞数量多于模型组,差异具有统计学意义(P< 0.05)。
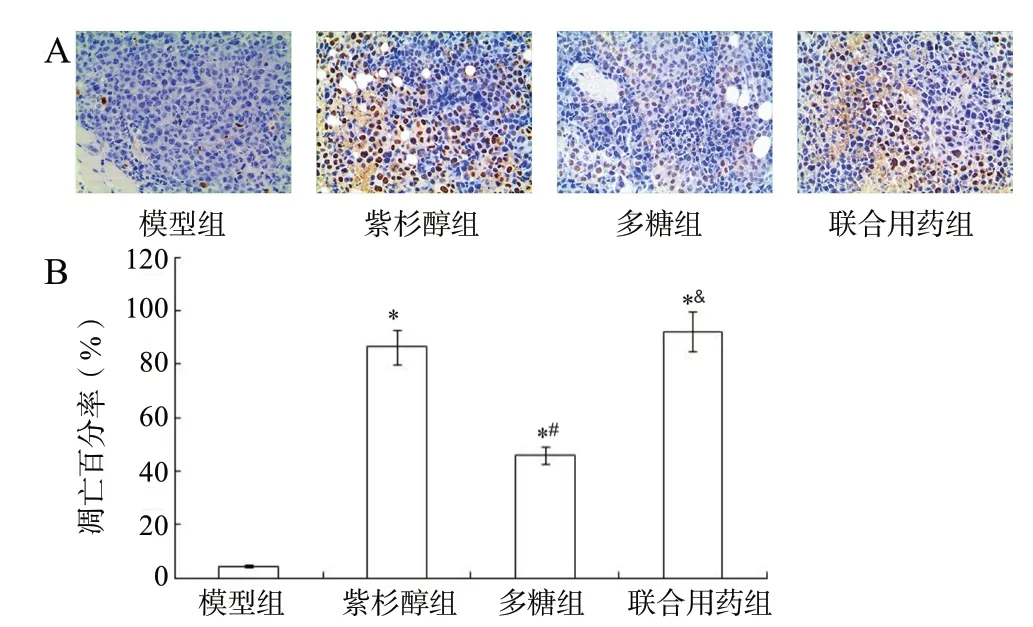
图2 各组对S180小鼠肿瘤组织细胞凋亡的影响(±s, n = 3, × 200)Fig.2 Effect of each group on apoptosis of tumor tissue in S180 mice(±s, n = 3, × 200)
2.4 免疫组化染色检测肿瘤组织内β-catenin、Cyclin-Dl、CDK4、Bcl-2、Bax以 及Survivin蛋 白表达水平
给药后,联合用药组相比模型组、紫杉醇组、多糖组肿瘤组织内β-catenin、Cyclin-Dl、Survivin蛋白表达减少(P< 0.05);CDK4、Bcl-2蛋白给药后,联合用药组相比模型组、多糖组减少,差异具有统计学意义(P< 0.05)。同时肿瘤组织内Bax蛋白,联合用药组相比模型组、多糖组增大,差异具有统计学意义(P< 0.05),结果见表2、图3。
表2 各组S180小鼠肿瘤组织中β-catenin、Cyclin-D1、CDK4、Bcl-2、Bax、Survivin蛋白的表达(±s, n = 3)Tab. 2 The expression of β-catenin, Cyclin-D1, CDK4, Bcl-2 , Bax and Survivin protein in S180 mice tumor tissue(±s, n = 3)

表2 各组S180小鼠肿瘤组织中β-catenin、Cyclin-D1、CDK4、Bcl-2、Bax、Survivin蛋白的表达(±s, n = 3)Tab. 2 The expression of β-catenin, Cyclin-D1, CDK4, Bcl-2 , Bax and Survivin protein in S180 mice tumor tissue(±s, n = 3)
注:与模型组比较,*P < 0.05;与紫杉醇组比较,#P < 0.05;与多糖组比较,&P < 0.05
组别 β-catenin Cyclin-D1 CDK4 Bcl-2 Bax Survivin模型组 94.4 ± 11.3 84.5 ± 8.1 81.1 ± 9.3 87.5 ± 9.9 57.3 ± 5.4 90.4 ± 8.2紫杉醇组 15.2 ± 1.2* 42.5 ± 4.1* 63.2 ± 5.8* 22.6 ± 3.3* 79.0 ± 8.5* 81.8 ± 6.5多糖组 33.5 ± 2.2*# 75.2 ± 6.2# 72.9 ± 8.2 91.1 ± 8.4# 51.7 ± 6.2# 72.4 ± 3.2*联合用药组 9.7 ± 0.8*#& 28.8 ± 3.6*#& 54.4 ± 6.3*& 19.3 ± 2.2*& 77.2 ± 8.1*& 56.3 ± 5.3*#&F 447.90 208.30 27.30 338.80 37.27 57.70 P 0.000 0.000 0.000 0.000 0.000 0.000
2.5 Western blot检测Bcl-2、Bax、Survivin蛋白表达水平
由表3、图4可知,联合用药组相比模型组、紫杉醇组、多糖组肿瘤组织内Bcl-2、Survivin蛋白表达水平减少,同时Bax、Bax/Bcl-2比值增大,与免疫组化观察结果基本一致,差异具有统计学意义(P< 0.05)。

图4 各组S180小鼠肿瘤组织Bax、Bcl-2、Survivin电泳条带 (±s, n = 3)Fig.4 Electrophoresis of Bax, Bcl-2 and Survivin in tumor tissue of S180 mice in each group(±s, n = 3)
表3 S180肿瘤组织中Bax、Bcl-2、Survivin蛋白表达相对水平 (±s, n = 3)Tab. 3 The relative expression of Bax, Bcl-2, Survivin protein in S180 mice tumor tissue(±s, n = 3)
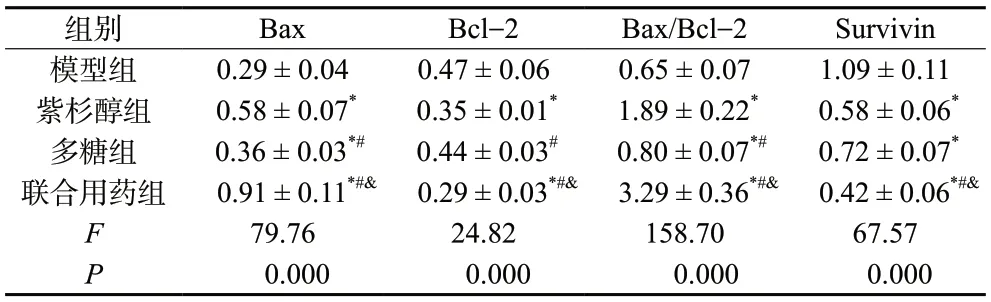
表3 S180肿瘤组织中Bax、Bcl-2、Survivin蛋白表达相对水平 (±s, n = 3)Tab. 3 The relative expression of Bax, Bcl-2, Survivin protein in S180 mice tumor tissue(±s, n = 3)
注:与模型组比较,*P < 0.05;与紫杉醇组比较,#P < 0.05;与多糖组比较,&P < 0.05
组别 Bax Bcl-2 Bax/Bcl-2 Survivin模型组 0.29 ± 0.04 0.47 ± 0.06 0.65 ± 0.07 1.09 ± 0.11紫杉醇组 0.58 ± 0.07* 0.35 ± 0.01* 1.89 ± 0.22* 0.58 ± 0.06*多糖组 0.36 ± 0.03*# 0.44 ± 0.03# 0.80 ± 0.07*# 0.72 ± 0.07*联合用药组 0.91 ± 0.11*#& 0.29 ± 0.03*#& 3.29 ± 0.36*#& 0.42 ± 0.06*#&F 79.76 24.82 158.70 67.57 P 0.000 0.000 0.000 0.000
3 讨论
目前大多数抗癌药机制是诱导肿瘤细胞凋亡进而抑制肿瘤增殖,细胞凋亡信号通路调控异常是造成肿瘤耐药现象的主要原因之一。凋亡信号通路主要有死亡受体介导途径和线粒体凋亡途径[7],线粒体凋亡途径一个重要步骤是线粒体膜电位下降引起线粒体膜一系列生化改变。Bcl-2家族蛋白主要作用位点在线粒体膜上,分为Bax、Bak等促凋亡蛋白以及Bcl-2等抗凋亡蛋白,在细胞凋亡发生中,Bax/Bcl-2比值是比单纯抗凋亡蛋白、促凋亡蛋白改变更为关键的指标之一,比值升高促进肿瘤细胞凋亡[8]。本研究结果观察到红豆杉总多糖与紫杉醇及其配伍给药后,抗凋亡蛋白Bcl-2的数量明显下降,而促凋亡蛋白Bax数量明显上升,Bax/Bcl-2比值明显升高(P<0.05)。提示南方红豆杉总多糖增强紫杉醇促S180荷瘤小鼠肿瘤组织细胞凋亡作用与凋亡调控蛋白Bcl-2家族相关,可能是通过线粒体途径产生作用。
Cyclin-D1是调控细胞周期的关键蛋白,比其它Cyclin蛋白更敏感的一个指标,被公认为原癌基因[9-10],Cyclin通过结合并激活CDK4,经一系列反应促进细胞增殖[11]。Wnt/β-catenin (β-连环蛋白)通路是调控细胞周期的重要通路,正常成熟细胞中没有Wnt信号,β-catenin在细胞内被降解。胞浆内β-catenin增多,是肿瘤发生过程的关键事件之一[12]。其大致关系是Wnt信号通路中β-catenin水平增加,激活Cyclin-D1基因表达,Cyclin-D1水平升高,激活CDKs,经一系列反应促进细胞增殖导致肿瘤[13-14]。基于此,本实验检测经典Wnt信号通路中β-catenin表达水平,并观察其下游靶蛋白Cyclin-Dl的表达以及被Cyclin-Dl特异性激活的CDK4。由实验结果推测,初步认为南方红豆杉总多糖增强紫杉醇影响肿瘤细胞周期的机制可能是通过对经典Wnt信号通路负调控产生抗肿瘤作用。
Survivin蛋白是迄今为止发现的最强的凋亡抑制因子之一,在几乎所有肿瘤中均有分布,不仅具有抗凋亡作用,还有促增殖作用[15-17]。Survivin抑制细胞凋亡时,Cyclin-Dl同时过度表达,两者协同作用使细胞增殖失控,Survivin与Cyclin-D1存在正相关。本实验观察到相比模型组、紫杉醇组,联合用药后Survivin与Cyclin-D1蛋白表达均下降(P< 0.05)。
4 结论
南方红豆杉总多糖增强紫杉醇诱导S180荷瘤小鼠肿瘤组织细胞发生凋亡效应,该效应可能是通过线粒体途径等促进肿瘤细胞凋亡,对经典Wnt信号通路负调控作用等抑制细胞增殖实现,然机体凋亡机制复杂,其明确的机制还有待进一步研究。
