缺血性脑卒中后认知功能障碍与梗死部位及体积的关系分析
2021-07-24陶汉川姜小兰曹茂红
王 珵,陶汉川,姜小兰,曹茂红
(1.南通大学附属东台医院,江苏 南通 224200;2.南通大学附属医院神经内科,江苏 南通 226019)
卒中后认知障碍是脑卒中常见的并发症之一,它的发病率是在20%~80%左右[1]。PSCI的危害很大,因伴随着认知功能的降低,患者的功能独立性会减弱,社会参与的能力变差,生活满意度也降低[2]。除此以外,PSCI还将会加重患者的残疾情况[3]。PSCI发病机制尚未完全阐明,卒中类型、病变部位、病灶特点及卒中次数等为PSCI的相关因素[3]。本研究主要分析缺血性脑卒中后认知功能障碍和梗死部位及体积的关系。后期可通过评估认知功能的得分情况及梗死部位及体积大小来预测脑梗死患者的认知功能。
1 资料与方法
1.1研究资料及仪器设备
1.1.1研究对象:纳入在2016年12月~2018年7月期间于东台市人民医院神经内科治疗的缺血性脑卒中患者共193例。本次研究经过本院医学伦理委员会同意。纳入的标准:急性缺血性脑卒中的诊断符合2014年的《中国急性缺血性脑卒中诊治指南2014》诊断标准[4],并经头颅磁共振检查确诊;患者病情稳定,能够配合相关的检查;患者知情同意,且签订知情同意书。合并认知障碍组患者需诊断符合2011年的《中国痴呆与认知障碍诊治指南》[5-6]:①符合痴呆的标准;②存在脑血管病变的证据;③痴呆和脑血管病有因果关系。即急性期经MMSE筛查为认知障碍,且6个月后再次筛查为认知障碍:即为文盲组≤17分、小学组≤20分、中学或以上组≤24分[3]。排除标准:既往有脑外伤病史;既往有临床卒中病史;在此次脑梗死事件前已出现认知障碍者;存在可能导致认知障碍的其他内科疾病(如甲状腺机能减退、维生素B12缺乏、严重感染等);合并可能导致认知障碍的帕金森病、阿尔茨海默病、路易体痴呆、脑萎缩、脑淀粉样变等神经系统疾病;合并可引起认知障碍的脑小血管病;合并有抑郁症、双相情感障碍等精神疾病,抑郁量表评分≥21分;合并严重的心脏疾病、肿瘤等;严重失语、肢体瘫痪不能配合智能检查者。
1.1.2主要仪器与量表:采用的是德国西门子公司生产的型号为Auanto的1.5T超导型磁共振成像仪。认知筛查选用MMSE,认知评估则用北京修订版蒙特利尔认知评估量表(MoCA)。MoCA量表是由12项内容组成的,总分30分。主要涵盖了7个认知域,细分为:视空间及执行功能、命名、注意力、记忆力、计算力、复述、语言流畅性、抽象、延迟回忆、定向力,用时10~15 min。本研究采用的分界值是,MoCA≥26分为认知功能正常,<26分有认知功能障碍。受教育程度年限≤12年的总分加1分,用来校正受教育程度所引起的偏倚。
1.2研究流程与方法
1.2.1患者一般资料的收集:所有入组患者行生化、维生素B12、叶酸、甲状腺功能、心电图、头颅磁共振等相关检查。记录纳入研究的患者的年龄、性别、吸烟史、饮酒史、高血压病史、糖尿病史、高脂血症史、受教育年限、偏手性(左利手或右利手)等信息,入组患者的年龄(57.7±10.5)岁,包括女74例,男119例。饮酒是指近一年每周平均饮酒≥3次者。吸烟是指每日吸烟≥1支,连续吸烟1年及以上者[6];受教育年限为患者接受正规教育的总年限。
1.2.2患者认知功能评定:量表的评估由两位神经内科的医师完成,首先由医师对急性缺血性卒中患者,在病情基本稳定(即病程的12~15 d),能配合认知评估的情况下进行MMSE筛查;接着采用MoCA量表对符合入组条件的患者进行认知功能测定,取二者的平均分值作为患者MoCA评分值。在缺血性脑卒中急性期患者评估结果存在认知障碍的总人数为173例,无认知障碍组人数为125例,对以上298例患者进行随访,在其病程6个月时再次进行认知筛查及评估,同时行头颅磁共振检查,按照排除标准剔除了105例患者(合并认知障碍组剔除78例,无认知障碍组剔除27例),即合并认知障碍组留存95例,无认知障碍组留存98例。记录并分析病程6个月时的这193例患者的MoCA评分。
1.2.3脑梗死部位的统计:患者脑梗死急性期及6个月后均行头颅磁共振检查。该研究有两名放射学主治或副主任医师独立读片,观察并记录梗死部位梗死侧别(左侧或右侧)、梗死灶部位(额叶、顶叶、颞叶等)及梗死灶数量,并根据头颅MRI的DWI(扩散加权成像,diffusion weighted imaging)序列区分陈旧性脑梗死和新发脑梗死,有2个以上的梗死灶为多发性梗死[7]。
1.2.4脑梗死体积的统计:脑梗死体积以MRI检查结果为依据,两名放射学主治或副主任医师对符合图像质量标准的头部MRI图像独立读片采用双盲法进行独立分析,意见不一时,由第3名放射学副主任医师参与,直到三人达成一致的意见。对于急性期的脑梗死患者记录梗死灶的部位,而在病程6个月时使用FLAIR图像进行梗死灶体积测量。用后处理软件在头颅相关的序列中,分别勾画每一层脑梗死的梗死轮廓,可自动计算出面积并逐层累加,最后乘以层厚与层距之和得出脑梗死的梗死体积[8]。对比同一患者的两次磁共振梗死部位,对于出现新发梗死的患者予以删除;采用6个月时患者的磁共振所测体积的结果,每组将本组所有患者的梗死体积,分别按梗死部位相加,得出合并认知障碍组和无认知障碍组的每个梗死体积的总体积值,然后进行两组的比较。

2 结果
2.1两组患者一般资料比较:两组患者的年龄、男女比率、吸烟率、饮酒率、患高血压病比率、患糖尿病比率、患高脂血症比率、受教育的年限、偏手性(右利手/左利手)等差异均无统计学意义(均P>0.05)。见表1。
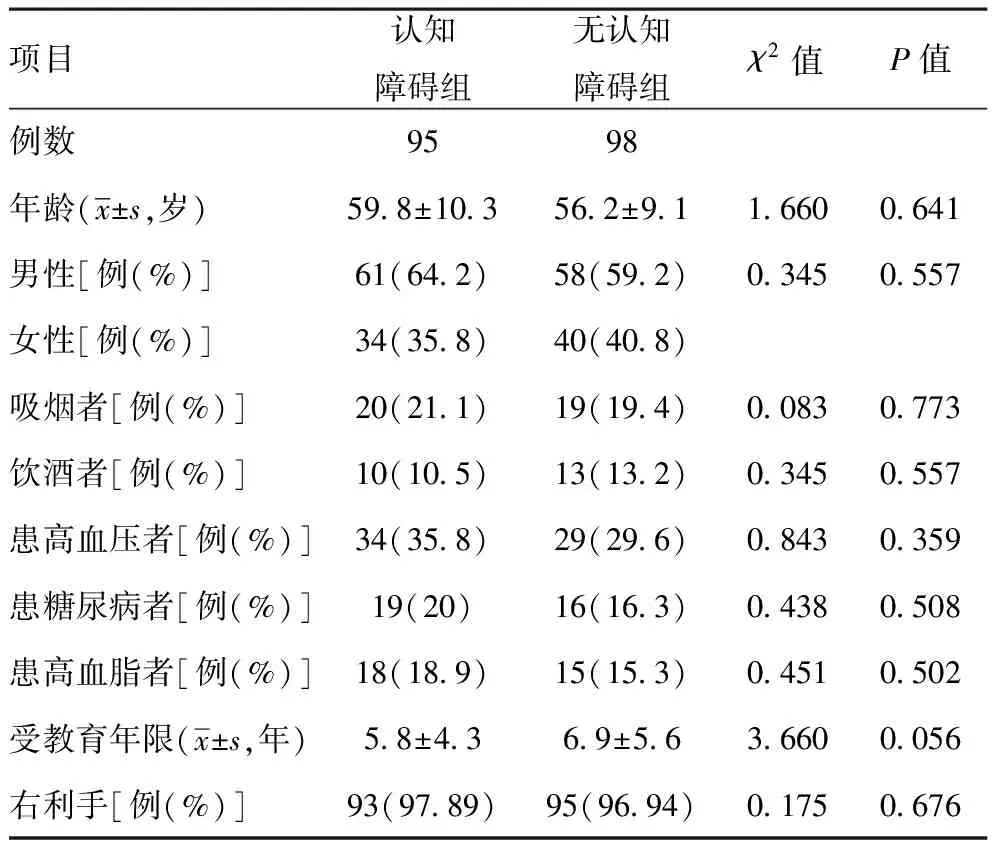
表1 两组患者的一般资料比较
2.2两组的各梗死部位发生人数和梗死体积的比较
2.2.1两组梗死部位发生人数的比较:合并认知障碍组和无认知障碍组的部分梗死部位发生人数比较差异存在显著的统计学意义(P<0.05),合并认知障碍组的丘脑、基底节部位的梗死人数显著性高于无认知障碍组,差异有统计学意义(P<0.05)。见表2。
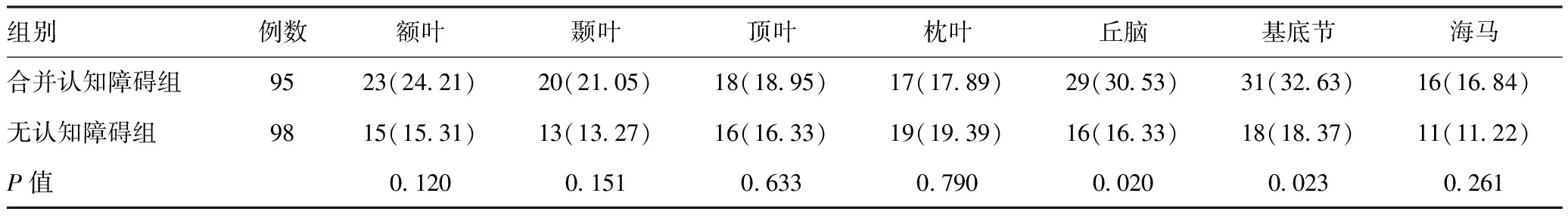
表2 两组梗死部位人数比较[例(%)]
2.2两组梗死部位的梗死体积的比较:合并认知障碍组患者梗死体积[743.50ml(304.25,1160.50)]显著性大于无认知障碍组[412.00ml(286.50,881.25)],差异有统计学意义(P<0.05)。见图1。
合并有认知障碍组与无认知障碍组在不同的梗死部位的体积比较提示在额叶、颞叶、顶叶、枕叶、丘脑、基底节部位的梗死体积的有显著的统计学差异,且均为合并认知障碍组梗死体积显著大于无认知障碍组,差异有统计学意义(P<0.05)。见表3。

表3 两组梗死部位的体积比较
2.3合并认知障碍的梗死部位MoCA各分项评分值的比较:对合并认知障碍组中大脑皮层(颞叶、额叶、顶叶、枕叶)、海马、丘脑、基底节等部位梗死的患者的MoCA各分项评分值进一步比较。我们发现视空间与执行功能评分在不同梗死部位之间存在显著性差异(P=0.021),其中额叶、海马评分偏低,顶叶、枕叶评分偏高;注意力评分在不同部位之间存在显著性差异(P=0.036),额叶和丘脑评分偏低,枕叶评分偏高;语言功能评分在不同部位之间存在显著性差异(P=0.018),颞叶和丘脑评分偏低;抽象概括能力评分在不同部位之间存在显著性差异(P=0.047),额叶评分偏低;记忆力评分在不同部位之间存在显著性差异(P=0.025),颞叶和海马评分偏低;命名能力、定向力评分在各个梗死部位间差异无显著统计学意义(P>0.05)。见表4。

合并认知障碍组与无认知障碍组脑梗死体积的比较,P<0.05

表4 合并认知障碍组的梗死部位 MoCA各分项评分值的比较
2.4两组梗死体积比与MoCA总分值相关性分析:合并认知障碍组患者梗死体积与MoCA总分值呈负相关(rs=-0.598,P<0.001),而无认知障碍组患者梗死体积与MoCA总分值无显著相关性(rs=-0.077,P>0.05)。见图2。


图2 两组梗死体积与MoCA总分值相关性分析
3 讨论
缺血性脑卒中后认知功能障碍有很多的危险因素,国外研究表明男性、高龄、高血压、糖尿病、高血脂、低教育程度是缺血性脑卒中后认知功能障碍的独立危险因素[9-12]。国内符晓艳等人的研究表明吸烟与饮酒是脑梗死后认知障碍的危险因素,而高血压、糖尿病等均未进入logistic分析方程[12]。可能由于样本量不足,本次研究中两组患者的年龄、男女比率、吸烟率、饮酒率、高血压病史、糖尿病史、高脂血症史、受教育的年限、偏手性(右利手/左利手)等差异均无显著性。
本次对脑梗死患者的分析结果显示,缺血性脑卒中后认知障碍的发生与患者梗死部位相关,合并认知障碍组的丘脑、基底节的梗死人数显著高于无认知障碍组,合并认知障碍组额叶、颞叶、顶叶、枕叶、丘脑、基底节部位的梗死体积大于无认知障碍组,说明这些部位与认知损害相关,与吕林利等人的研究[13]结果基本一致。大脑皮层主要负责的是认知、情感、学习等高级功能,梗死灶在皮层的患者易合并认知功能障碍。额叶是大脑的最高级活动中枢,额叶损害,可通过前额叶纹状体环路影响患者执行功能[14]。本次研究中,额叶梗死患者视空间与执行功能损害最严重。而颞叶是重要的记忆中枢,颞叶梗死可以累及颞叶的内侧与海马结构,阻断了海马-内侧颞叶-皮质下通路,从而会引起认知障碍[15]。在本研究中,颞叶梗死患者的记忆力和语言能力损害较其他部位梗死严重。顶叶主要负责命名和判断力[16],本次研究中,梗死灶在顶叶的患者,其命名功能域评分较其他部位梗死低,但差异尚不具有统计学意义(P>0.05),可能与样本量小及严重失语不能配合认知评估的患者未纳入研究相关。海马是组成边缘系统的重要部分之一,与学习记忆有着密切的关系,是脑内缺血最敏感的区域[17]。缺血性脑卒中后认知障碍的患者,其海马和相关脑区间的功能连接减弱可能为引发认知功能减弱的原因之一[18],一项以磁共振高分辨脑解剖成像技术为基础的临床研究发现轻度认知障碍患者出现海马及海马旁回的皮质厚度的减少[19]。在本次研究中梗死灶在海马的患者,其记忆能力、视空间与执行功能下降明显。基底节是由豆状核、尾状核、黑质等结构组成,它和丘脑共同组成了皮质-纹状体-苍白球-黑质-丘脑-皮质环路系统,故基底节和丘脑部位的梗死会导致该环路的阻断,可出现类似额叶损伤的特点。丘脑为感觉传导的皮质下中枢和中继站,丘脑的背内侧核团与额叶的皮质、海马、纹状体等都有联系,丘脑是通过参与额叶-纹状体-苍白球-丘脑-皮质回路调节执行功能、注意力和情感功能[16]。本研究中,丘脑梗死的患者语言功能显著降低。大脑白质是神经纤维重要的走行部位,有报道发现脑缺血病变引起的大脑脑白质疏松可引起认知障碍[16-17]。
本次研究结果显示多发性梗死患者较易合并认知功能障碍,且在不同部位的脑梗死体积的比较中,笔者发现了伴有认知障碍组额叶、颞叶、丘脑、基底节部位的梗死体积显著大于无认知障碍组。究其原因,多发性梗死病灶可波及大脑的功能区及神经纤维传导束,切断部分神经传导路径,阻碍皮质信号的联系,降低认知功能[18]。
脑梗死的发生次数与认知功能障碍密切相关,本次研究中,合并认知障碍组合中多发性脑梗死患者病例数明显大于无认知障碍组,提示病灶数目及体积的累积是导致卒中后认知障碍的影响因素。
脑梗死体积与认知障碍发生密切相关,既往研究资料显示梗死灶最大直径>3 cm患者发生脑梗死后认知障碍是梗死灶最大直径<3 cm的2.715倍[19]。本研究中,合并认知障碍组脑梗死体积显著高于无认知障碍组;相关性分析结果提示:合并认知障碍组患者梗死体积与MoCA总分值呈负相关(rs=-0.183,P<0.05),而无认知障碍组患者梗死体积与MoCA总分值无显著的相关性(rs=-0.094,P>0.05)。
综上所述,本研究发现额叶、颞叶、顶叶、丘脑、基底节、海马部位梗死合并认知功能障碍,梗死部位不同,认知功能损伤特点不相同。梗死体积大的脑梗死容易合并认知功能障碍,认知障碍程度与脑梗死体积呈正相关。因此对于大脑这些关键部位梗死或梗死体积大的梗死患者有必要进行认知功能测评,早期识别脑梗死后认知障碍,并选择干预措施。
