播散性荚膜组织胞浆菌感染继发噬血细胞综合征1例
2021-07-21吕小林汪丁枝陈国安
吕小林,汪丁枝,呙 阳,陈国安
噬血细胞综合征(hemophagocytic syndrome,HPS)是由多种因素引起的淋巴细胞、组织细胞非恶性过度活化、增殖,并分泌大量炎性因子,进而引起机体一种严重的炎症反应,临床分为原发性HPS和获得性HPS[1]。原发性HPS常见于儿童,继发性HPS以成人居多。感染、风湿性疾病、肿瘤等是引起继发性HPS常见原因。HPS患者若未及时干预,病死率极高[2]。荚膜组织胞浆菌(Histoplasma capsulatum)是一种嗜潮湿环境的双相真菌,具有一定的侵袭性,引起组织胞浆菌病(histoplasmosis),临床常见局灶性感染和播散性感染,荚膜组织胞浆菌感染机体后临床表现无明显特异性,极易漏诊、误诊[3]。由荚膜组织胞浆菌感染引起的HPS极为少见,现就我院诊治的1例该病患者资料报道如下,以期引起临床重识。
1 临床资料
患者男,27岁。于2018年9月无明显诱因出现畏寒发热,体温多在38.0~39.0℃,最高达40.5℃,伴全身肌肉酸痛、乏力,多次就诊于外院,拟诊断发热,予抗感染、补液等治疗,效果不佳,仍有反复发热等症状,遂2018年10月20日来我院诊治。入院查体:体温38℃,脉搏124次/min,呼吸21次/ min,血压118/70 mmHg,皮肤、巩膜轻度黄染,心律齐,无杂音,双肺呼吸音清,未闻及干湿啰音,腹饱满,无腹壁静脉曲张,腹肌软,全腹轻压痛,无反跳痛,肝脏平脐,脾肋下未触及,移动性浊音阳性,肠鸣音正常,双下肢轻度水肿。既往乙型肝炎病史8年,否认糖尿病病史,否认药物过敏史,近期无海鲜食用史。实验室检查:血常规,白细胞 3.45×109/L、红细胞 3.25×1012/L、血红蛋白87 g/L、血小板32×109/L,凝血酶原时间15.3 s、部分凝血活酶时间32.3 s、凝血酶时间13.6 s、纤维蛋白原3.6 g/L、D-二聚体 2.27 mg/L,血液生化,丙氨酸转氨酶98.6 U/L、天冬氨酸转氨酶 32.3 U/ L、总蛋白53.0 g/L、白蛋白24.0/L、总胆红素 55.2 μmol/L、直接胆红素38.5 μmol/L、γ谷氨酰转肽酶 100 U/L、碱性磷酸酶119.2 U/L、肌酐46.6 μmol/L、乳酸脱氢酶468 U/L、磷酸肌酸激酶49 U/L、磷酸肌酸激酶同工酶38/L、C反应蛋白88.0 mg/L、降钙素原4.53 ng/L、铁蛋白 1 900.0μg/L,HBV-DNA、HCV-RNA、CMV-DNA、EBDNA均为阴性,抗双链DNA抗体筛查、ANA谱(11项)、抗结核抗体均为阴性,真菌半乳甘露聚糖试验(GM试验)阴性,TNFα 125 ng/L;细菌、真菌多次培养均为阴性;白细胞介素因子、真菌(1,3)-β-D葡聚糖(GS)结果见表1;骨髓细胞学提示吞噬性组织细胞占3%(见图1)、荚膜组织胞浆菌感染;HPS基因突变检测(15个相关基因)均为阴性;影像学检查,胸、腹部CT示两肺下叶感染、脾肿大、腹膜后及肠系膜区少许淋巴结肿大(2.2 cm×2.6 cm);PET/CT示纵隔、肝门区及腹膜后多发淋巴结影,肝脏、脾脏体积增大,两肺下叶纤维灶。综合所有检查及患者体症诊断为获得性HPS、荚膜组织胞浆菌感染。入院初期根据患者体征予左氧氟沙星、美罗培南及替考拉宁抗感染,并补充人血白蛋白、利尿、护肝等对症支持治疗;确诊荚膜组织胞浆菌后再予头孢哌酮-舒巴坦抗细菌感染同时予卡泊芬净及两性霉素B脂质体抗真菌治疗,1周后患者病情出现好转,但仍存在神志淡漠、发热、头痛、胀痛等症状,复查结果示噬血相关指标呈上升趋势,临床考虑HPS未得到控制,予实施DEP方案治疗(脂质体阿霉素40 mg 1次/d;依托泊苷90 mg d1,d8,d15,d22 ;甲泼尼龙250 mg 1~28 d逐渐减量),期间并予以护肝、护心、间断输血等对症治疗,4周后患者情况明显好转,顺利出院。
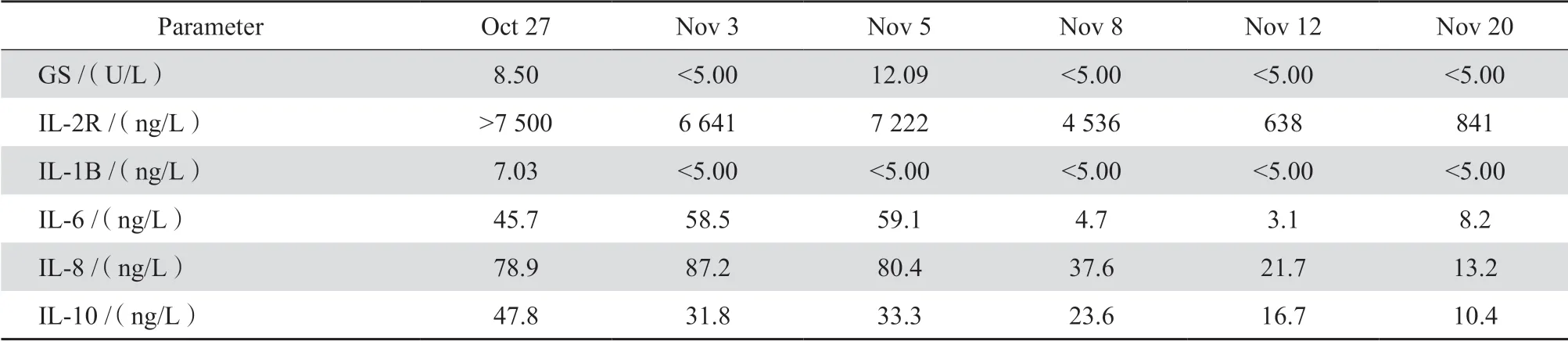
表1 患者治疗过程中白细胞介素因子、真菌(1,3)-β-D葡聚糖检测结果Table 1 Interleukins and (1, 3)-β-D-glucan synthase levels over time during treatment

图1 骨髓涂片瑞氏染色像(1000×)Figure 1 Wright's stain of bone marrow smear(1000×)
2 讨论
HPS是一种由于多种原因造成的淋巴细胞、单核/巨噬细胞系统反应过度为特点的疾病,其发病率较低,约1/80万[4],Scott等[5]1939年首次发现并报道了1例HPS,并由Strippoli等[6]命名为巨噬细胞活化综合征,1952年Farquhar和Claireux首次提出HPS概念[7]。根据发病机制HPS分为原发性HPS和继发性HPS。原发性 HPS多见于2岁以下婴幼儿,常伴有常染色体的隐性突变(主要有HPLH1、PRF1、UNC13D、STX11、STXBP2等基因),继而影响机体的NK细胞和细胞毒性T细胞的功能[8];继发性HPS主要由感染、肿瘤、自身免疫性疾病等因素引起,其中以感染因素为主。HPS发病机制较为复杂,目前研究认为主要是由于NK 细胞和细胞毒性T淋巴细胞介导的穿孔素依赖性细胞毒作用缺陷所导致的炎性反应,其缺陷可能导致机体内抗原物质不能及时被清除,存留机体的抗原持续刺激机体免疫系统,继发巨噬细胞、T细胞等功能失控,分泌大量的细胞因子,进而导致“细胞因子风暴”现象,紊乱的免疫系统可攻击正常的组织、细胞,引起机体组织受损和器官衰竭[9]。基于HPS患者机体的免疫系统紊乱及“细胞因子风暴”发生,故对相关炎性因子的检测有助于HPS的诊断及病程判断,董文渊等[10]、潘晨等[11]研究发现部分细胞因子的表达与HPS的诊断和预后判断相关。本例患者在诊断初期细胞因子明显升高,予抗感染治疗后疾病未能得到控制时,细胞因子呈上升趋势,换用化疗方案继缓解病程后细胞因子明显下降,可见动态检查细胞因子具有监测病程作用。本例患者就诊时伴有高热,肝、脾肿大等体征,血常规示三系降低,细胞因子、铁蛋白明显增高,骨髓细胞中见3%的吞噬性组织细胞,HPS基因突变检测阴性,根据指南符合获得性HPS表现[12],确诊后在积极治疗原发病的同时予DEP方案治疗,20余天后患者病程明显好转,各种噬血相关指标明显下降,复查骨髓细胞学未见噬血现象,顺利出院。
荚膜组织胞浆菌是一种嗜潮湿环境的双相真菌,具有一定的侵袭性,主要感染免疫力低下人群。2006年Antinori等[13]提出了播散型组织胞浆菌病的诊断标准。目前检测荚膜组织胞浆菌感染的方法主要包括直接镜检、培养、抗原抗体检测及分子生物学方法等,其中直接镜检和培养是诊断金标准[14]。播散性组织胞浆菌病如果没有得到及时诊疗,可累及多个脏器,死亡率较高,组织胞浆菌病治疗指南推荐两性霉素B相关制剂及伊曲康唑为主要治疗方案[15],并建议轻中度患者首选伊曲康唑,重症患者首选两性霉素B。本例患者伴发热,肝、脾、淋巴结肿大等体症,GS试验阳性,骨髓中检见吞噬荚膜组织胞浆菌的组织细胞,测序结果示荚膜组织胞浆菌基因序列,综合检测结果及患者病史考虑为播散性荚膜组织胞浆菌感染,确定病程后,予卡泊芬净联合两性霉素B脂质体抗真菌感染治疗,1周后患者一般情况良好,GS试验转阴,骨髓检测中未见荚膜组织胞浆菌,考虑治疗有效,综合患者的体征、实验室检查及治疗,临床诊断:①荚膜组织胞浆菌感染;②HPS。
播散性荚膜组织胞浆菌感染伴噬血细胞综合征是一种少见疾病,起病急,进展快,死亡率极高,且临床特点无特异性,极易引起漏诊、误诊,因此应尽快完善骨髓细胞学、分子学等相关检查,力争早诊断、早治疗。
