一株母猪产道益生性粪肠球菌的分离鉴定
2021-07-21汪惠琳曹刚黎佳杰陈松昌冯祥瑞
汪 溪 汪惠琳曹 刚黎佳杰 陈松昌 冯祥瑞
(1江西农业大学动物科学技术学院,江西南昌 330045;2南昌金牧动物保健服务有限公司,江西南昌 330013;3永丰县农业综合行政执法大队,江西永丰 331500)
哺乳动物生殖道是一种肌肉纤维结构,分为黏膜层、肌肉层和外膜层。黏膜层形成许多称为阴道褶皱的横向褶皱,依次分为2层:固有层和鳞状上皮层。从根本上讲使上皮层与肌肉层相连的独立结缔组织是鳞状上皮,其中存在的微生物群落被称为阴道微生物群。在正常状态下,阴道微生物在维持阴道健康和保护宿主免受疾病侵袭方面具有重要意义[1]。新的分子技术和计算机科学的出现使研究人员能够深入探究阴道微生物群落组成,并将阴道微生物群落结构与机体健康联系起来[2]。尽管群落的结构在不断变化,但阴道菌群数量有限这一点已达成共识。阴道微生物群由多种厌氧和需氧微生物组成,其中乳酸菌是最主要的微生物,并在预防泌尿生殖系统疾病方面起决定性作用[3]。乳酸菌成为阴道防御者的主要原因是其产生的乳酸和H2O2能够维持酸性环境,保持pH值约为4.0,对需氧性阴性细菌的生长不利[4,5]。在围产期,母猪体内残留的雌激素会使阴道上皮增厚,使得糖原沉积在上皮细胞中,糖原通过上皮细胞脱落而释放出来,有利于乳酸菌发酵葡萄糖[6]。母猪产后,体内雌激素水平下降,阴道黏膜变薄,从而导致糖原和乳酸菌发酵葡萄糖减少,可提供多种需氧和兼性厌氧菌的生存环境。
益生菌(EM)是在适量服用后,对宿主健康有益的、活的微生物,能促进有益微生物的生长,抑制有害菌的繁殖。益生菌通常分为乳酸菌类和芽孢杆菌类,其中乳酸菌是一类能利用葡萄糖或乳糖产生大量乳酸的无芽孢、革兰氏阳性、球状或杆状细菌的总称[7]。近年来,随着消费者对动物食品安全的逐渐重视,人们对动物养殖模式不断优化,因益生菌无毒、无污染、无二重感染等特点成为替代抗生素的首选添加剂,用于疾病的预防和治疗。作为水产生物、家禽、家畜饲料添加剂的益生菌,在促进动物健康生长的同时,能够降低食品安全隐患,从而提高畜牧业的经济效益[8]。近年来,乳酸菌也广泛应用于医学领域治疗阴道疾病,郭淑敏等[9]发现利用乳酸菌制剂治疗RVVC(阴道假丝酵母菌病)疗效优于单纯抗菌药物。在养猪行业,多以母猪的繁殖性能为评价指标,其生产性能决定了养猪业的经济效益,因此,提高母猪生产效率和降低生产成本是养殖户追求的共同目标。不同生理阶段的母猪常伴随发生消化、繁殖性疾病,而母猪的特殊生理期如妊娠、产仔、哺乳和断奶等是不宜使用抗生素和抗菌药物的,因而使用益生菌辅助或替代治疗母猪的繁殖类疾病是当前养殖业的需求。
菌群移植包括整体菌群移植(FMT)和选择性菌群移植(SMT),SMT技术是将部分功能性菌群移植到消化道、生殖道、呼吸道及皮肤等部位,以改善移植部位菌群而治疗相关疾病的一种方法。目前SMT技术还处于研究阶段,发现和深入研究具有治疗作用的新型优势益生菌株,是发展SMT的重要前提。产道内的微生态系统在维持宿主健康中起着重要的作用,产道的黏膜上存在大量微生物,菌群平衡被打破易引起产道的相关疾病,及时增加益生菌含量对产道相关疾病的预防和治疗有积极作用[10]。
本研究采集健康且窝产14头的母猪产道分泌物进行分离纯化出4株候选菌株。进一步对其中一株进行了生化鉴定、抗生素敏感性试验、16S rDNA测序、体外抑菌试验后确定该株菌为一株具有益生特性的粪肠球菌,为绿色防治母猪生殖道炎症提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验样本采集
在江西省南昌市安义神农猪场,用121℃30 min高压灭菌后的无菌母猪检测用采样器(专利:201920389 022.X)采集1头窝产14头仔猪的高产母猪产道中段分泌物,棉拭子立即放入事先准备好的装有500 μL生理盐水的无菌EP管中并做好标记,置于冰上再送回实验室。放在-80℃超低温冰箱保存。
1.1.2 试验试剂
药敏试纸片来自杭州微生物试剂有限公司,MRS培养基来自青岛海博生物有限公司,革兰氏染色试剂来自北京索来宝科技有限公司,菌株生化鉴定标准试剂盒、LB琼脂培养基来自青岛海博试剂有限公司;ddH2O为实验室自制;DL 2 000 DNA Marker、Taq DNA聚合酶等均来自Takara公司。
1.1.3 试验器材
恒温培养箱来自上海新苗医疗器械制造有限公司,高温灭菌锅来自上海中安医疗器械厂,高速离心机购自Eppendorf,Nanodrop、超低温冰箱均购自美国Thermo公司,PCR仪来自中国东胜仪器有限公司,超净工作台来自苏州净化设备有限公司,琼脂糖凝胶电泳仪来自北京六一仪器厂,紫外凝胶成像系统购自上海培清科技有限公司,厌氧罐及厌氧充气罐购自广州海太光电生物科技有限公司,显微镜购自道斯光学仪器公司,电阻炉购自北京市永光明医疗仪器有限公司。
1.2 试验方法
1.2.1 细菌的分离纯化
在超净工作台上将装有棉拭子的EP管中的生理盐水混匀,取10 μL在MRS平板上划线后放入厌氧罐并充入惰性气体,37℃厌氧培养48 h。再挑选形态不一的单个菌落参照《兽医微生物学实验指导》进行革兰氏染色和镜检。在载玻片上滴一滴dd H2O,用接菌环勾取单个菌落的一半涂片,放在酒精灯上固定,再加结晶紫染色液初染1 min,缓慢水流冲洗后加碘液媒染1 min,再次水洗后加95%酒精脱色30 s,用水流冲掉酒精后加番红复染1 min,最后水洗、自然晾干后镜检。将(40×100)油镜下为蓝色杆状或球状的菌留在MRS培养基上,单个菌落余下部分接入MRS液体培养基,4 000 r/min离心5 min弃上清,再加入1 mL 30%的甘油吹打混匀后放入-80℃超低温冰箱保存菌种。
1.2.2 抗生素敏感性试验
采用K-B纸片扩散法,选取常用抗生素氯霉素、红霉素、恩诺沙星等共13种进行药敏试验。取200 μL按照1%比例复苏的菌液用无菌棉签在MRS平板上均匀涂布,待菌液完全渗透进培养基后,用酒精灯灼烧过的镊子夹取药敏纸片贴在平板上[11]。将处理好的平板放进厌氧罐并充入惰性气体,37℃恒温箱培养24 h后测量抑菌圈直径(mm)。
1.2.3 菌株生化鉴定
依据细菌的菌落形态及革兰氏染色的镜检结果,参照菌株生化鉴定标准对分离菌株进行相关的生理生化试验。将分离出来的菌株接种于明胶、七叶苷等微量生化反应管中,放入37℃恒温箱培养24 h后观察结果。
1.2.4 DNA提取及PCR扩增
用水煮法提取DNA。取1 mL过夜培养的分离菌菌液至1.5 mL EP管中,12 000 r/min离心30 s后弃上清,再向EP管中加入1 mL dd H2O吹打混匀,12 000 r/min离心30 s后弃上清,重复操作1次,之后向EP管中加入100 ddH2O沸水浴20 min,再放入-20℃冰箱10 min后取出,待内容物彻底融化后12 000 r/min离心1.5 min取上清。取2 μL上清用NanoDrop核酸浓度检测仪检测,结果符合进行PCR扩增的要求。
用水煮法提取所分离菌株的基因组DNA作为模板进行16S rDNA的PCR扩增,扩增引物为生工生物工程(上海)股份有限公司合成的细菌16S rDNA基因通用引物 27F(5’ -AGAGTTTGATCMTGGCTCAG-3’) 和1 492R(3’-TACGGYTAC CTTGTTACGACTT-5’)。按照表1配置好25 μL反应体系,配置好的PCR体系按照如下反应条件进行PCR扩增。反应条件为上样后94℃预热10 min,使模板DNA变性充分;接下来30个循环:94℃变性30 s,55℃退火30 s,72℃延伸100 s;最后72℃保持7 min,使产物延伸完整。取5 μL PCR产物和DL 2 000 DNA Marker经1%琼脂糖凝胶电泳直至孔中所加样品跑开,再用凝胶电泳成像分析系统观察结果。其余PCR扩增产物暂时放入4℃冰箱等待送检。
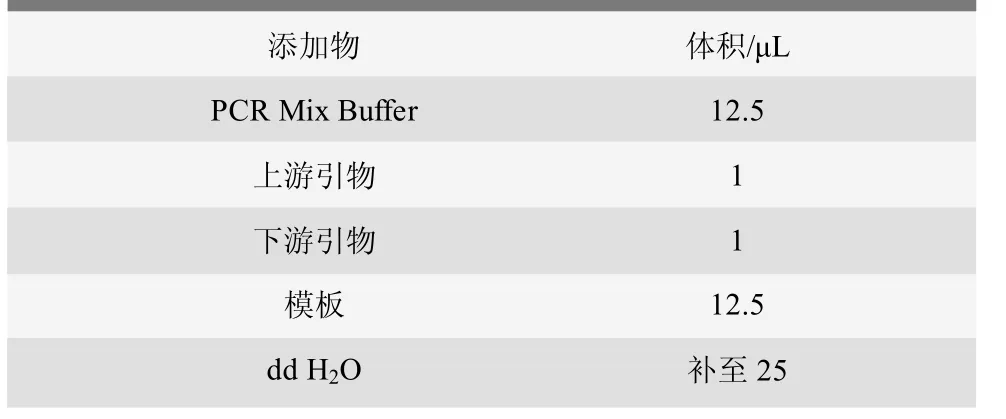
表1 PCR反应体系
1.2.5 序列同源性比对
将PCR扩增后的产物送北京擎科生物科技有限公司湖南分公司进行测序,测序结果在NCBI GenBank数据库中进行BLAST同源比对分析。
1.2.6 牛津杯法抑菌试验
用大肠杆菌k88和变形杆菌作为指示菌,分别取200 μL在LB平板上用无菌棉签均匀涂布,再将高压灭菌后的牛津杯放在平板上,一个平板放入4个牛津杯,其中3个分别加入200 μL分离菌菌液,另一个加入200 μL营养肉汤作为阴性对照。室温下放置30 min后放入37℃恒温箱培养12 h,用直尺测量抑菌圈大小。
2 结果
2.1 分离纯化结果
初步分离得到4株革兰氏阳性菌,从其中挑选出1株命名为H8-4,以供后续试验。H8-4镜检为球状,呈短链排列的革兰氏阳性菌。纯化后在MRS培养基上菌落呈圆形、小而凸起、边缘整齐、半透明、乳白色、表面光滑、湿润(图1)。
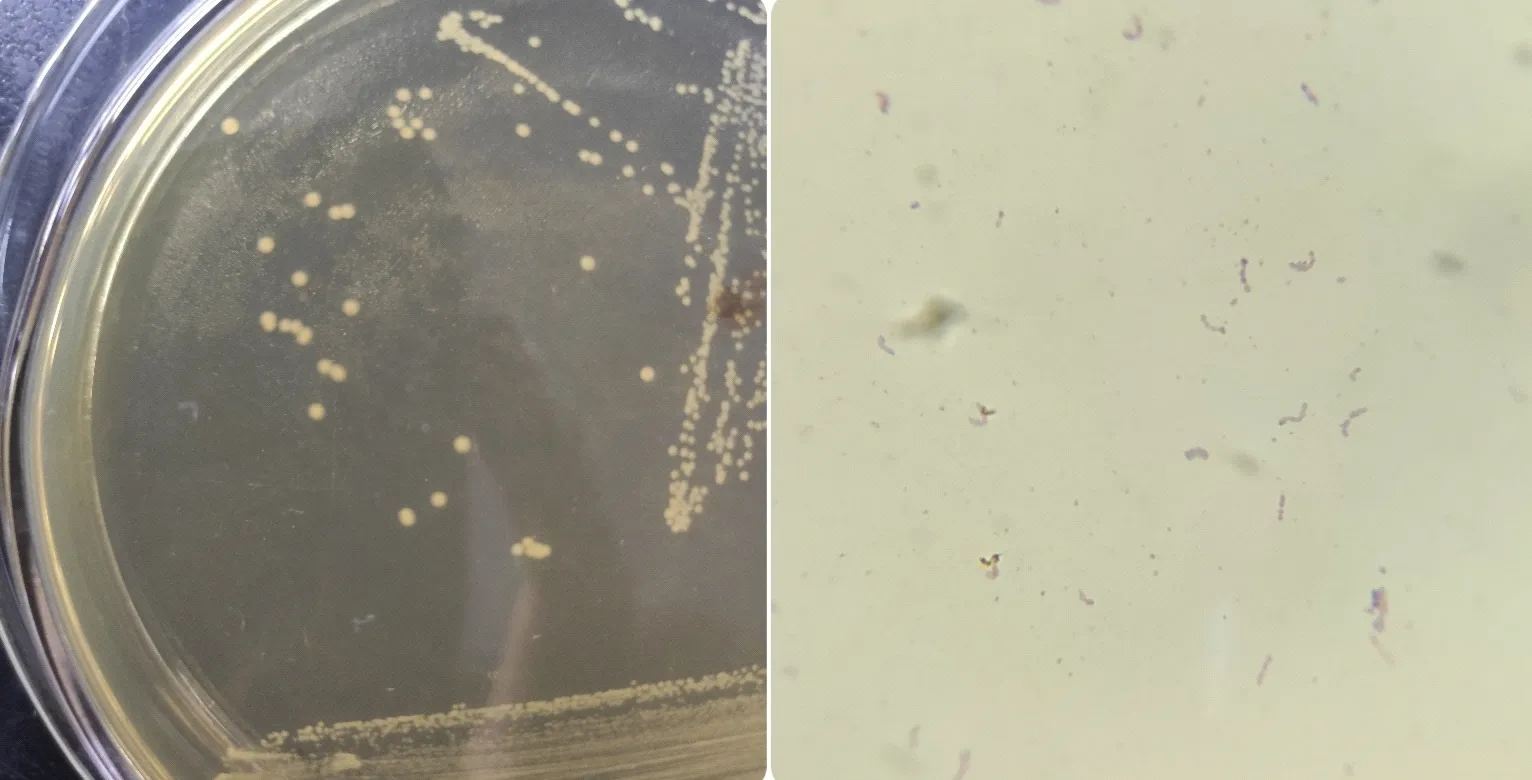
图1 分离菌株初筛结果
2.2 抗生素敏感性试验
表2结果表明青霉素、头孢哌酮等对高产母猪产道分离的益生菌H8-4有良好的体外抑制效果,而红霉素和阿奇霉素等对其无抑制作用。
2.3 分离菌生化鉴定
根据细菌生化鉴定管说明书对筛选出的H8-4进行判定,明胶、果糖等为阳性,葡萄糖酸盐为阴性(表3)。
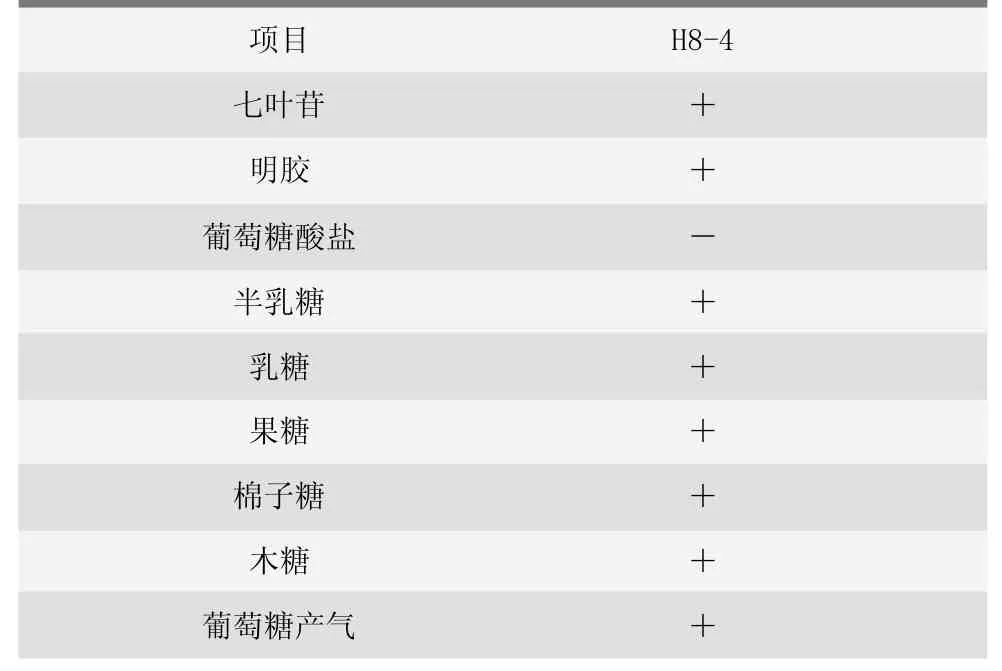
表3 分离菌生化特性
2.4 DNA提取及PCR扩增结果
NanoDrop核酸浓度检测仪检测用水煮法提取的高产母猪产道分离菌的DNA浓度为113 μg/mL,OD值为2.0,符合PCR扩增要求。

表2 药敏试验结果(mm)
PCR扩增后的产物经1%琼脂糖凝胶电泳检测结果如图2所示,扩增条带大小约1 500 bp。

图2 H8-4电泳条带
2.5 序列比对结果
将PCR扩增产物送北京擎科生物科技有限公司湖南分公司进行测序后结果用Chromas软件打开,显示如图3,截去前后100个bp再在NCBI上进行Nucleotide BLAST比对,结果表明H8-4与Enterococcus faecalis sp.Le5-1a序列的同源性高达99.79%,登录号为EU794735.1。由此可鉴定H8-4是粪肠球菌。
2.6 分离菌牛津杯法抑菌结果
在MRS平板上H8-4对变形杆菌的抑菌圈直径分别为2.50 cm、2.41 cm、2.43 cm,平均抑菌圈大小为2.45 cm。H8-4对大肠杆菌抑菌圈直径分别为2.31 cm、2.45 cm、2.33 cm,平均抑菌圈大小为2.45 cm。表明该株粪肠球菌对大肠杆菌和变形杆菌有较好的体外抑制作用。营养肉汤对照组未见抑菌圈。见表4和图4。
3 分析与讨论
3.1 分离菌的种属
根据分离菌培养和生化特性,比对《伯杰氏细菌分离鉴定手册》[12],得知H8-4生化特性与粪肠球菌一致,再通过16S rDNA确定为粪肠球菌。粪肠球菌是一种天然的微生物链球菌,其存在于肠道中,主要通过影响宿主的免疫功能来对自身进行保护,在消化道中,粪便可以被降解为沼气和CO2,在体内还能产生一些有益的物质;也可能将粪便分解成其他有害气体和H2S等,这些成分能够促进机体的新陈代谢。粪肠球菌还可以作为候选益生菌进行深入研究[13]。
3.2 分离菌的抗生素敏感性
抗生素敏感性试验表明,H8-4对红霉素、庆大霉素等抗生素表现为耐药,对青霉素、头孢哌酮等抗生素敏感性高。表明该株益生菌不含有青霉素、头孢哌酮等的耐药基因。
3.3 分离菌的生化特性
H8-4的生化特性与《临床常见微生物鉴定指南》中粪肠球菌的明胶、七叶苷、葡萄糖酸盐、半乳糖、乳糖、果糖、棉子糖等的生化试验结果均一致。葡萄糖产气试验说明该株粪肠球菌产酸不产气。
3.4 分离菌的益生性
H8-4对大肠杆菌k88和变形杆菌有良好的抑制作用,可作为益生菌候选优势菌株。
4 结论与展望
养殖业中滥用抗生素现象屡见不鲜,致使超级细菌不断涌现。农业农村部在2020年7月1日发布了“禁抗令”,严禁使用含促生长类药物作为饲料添加剂,由此看来,益生菌的作用将显得愈发重要。母猪生殖道炎症是导致其繁殖性能下降的主要原因之一,严重影响养殖业生产效益。母猪生殖道疾病一般多由病原微生物单一感染或混合感染引起,细菌是最主要的病原微生物。益生菌能够较好地防治阴道感染疾病,其作为人类和动物的重要组成部分,作用机理和种类也在不断探索当中。
产道菌群种类的改变和数量的失衡可引起产道炎症,在SMT的原理基础上提出母猪产道选择性菌群治疗方法的设想,分离并鉴定更多的母猪产道的益生菌将有利于筛选出优质、适应性强的候选益生菌株。本试验从实际出发,在高产母猪产道分离出1株粪肠球菌,粪肠球菌可以通过与各种细菌混合在一起来控制致病性微生物的生长和传播。徐帅帅[15]对生猪肠道细菌菌群进行了alpha多样性分析,得出在生猪肠道益生菌菌群中粪肠球菌占比68%。此外,有研究表明饲料中添加粪肠球菌可以显著降低虾的累计死亡率,明显改善虾肠道微生物群落的组成和丰度[16]。因此对不同益生性细菌的研究是非常有必要的。
席晓霞[17]的研究已证实,早期初产婴幼儿的肠道菌主要可能遗传自母体的生殖道。因此母猪产道中的益生菌可能更有利于初生仔猪在早期建立健康的肠道微生态平衡,从而保证仔猪肠道健康。
本试验无菌采集江西省某养殖场窝产14头仔猪的母猪产道中段阴道分泌物并成功分离了一株具有潜在益生性的粪肠球菌,对该菌的药物敏感染性试验中发现,该菌株对兽药中常用的青霉素等敏感,提示其不存在与之相关的耐药基因,初步具备了成为候选益生菌的条件,并为进一步的相关益生菌的筛选奠定了研究基础。
