Cox A16型手足口病BALB/c乳鼠模型的建立
2021-07-17徐英莉郭姗姗耿子涵庞博周利润王雅欣崔晓兰时宇静
徐英莉,郭姗姗,耿子涵,庞博,周利润,王雅欣,崔晓兰,时宇静
(中国中医科学院 中药研究所,北京 100700)
柯萨奇病毒A16型是引起手足口病(hand,foot and mouth disease,HFMD)的主要病原体之一[1]。COXA16型手足口病感染可以引发手、足、口腔疱疹,少数重症患者可以引发神经系统病变,甚至死亡[2]。目前尚无有效的疫苗和特效药物,构建具有典型临床症状的动物模型是药效及疫苗评价方法的重要环节之一。
目前已建立较为完备的EV71感染动物模型,包括BALB/c[3]、ICR[4]乳鼠模型、恒河猴模型等[5],而COX A16感染动物模型仍需完善。目前已建立通过颅内注射COX A16感染1日龄BALB/c模型[6]、1日龄ICR乳鼠模型[7]以及树鼩模型、猕猴模型等。而已建立的BALB/c乳鼠模型,尚未进行深入的免疫、病理学研究。
本实验借鉴本组EV71型手足口病3日龄BALB/c乳鼠模型[8-9],经腹腔注射建立COXA16型手足口病3日龄BALB/c乳鼠模型,并进行临床症状、体重变化观测,组织病毒载量、趋化因子含量、组织病理病变等指标检测,建立了较完整的COXA16型3日龄BALB/c乳鼠模型,为药物评价及疫苗研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
遗传背景清楚,3日龄,SPF级,BALB/c乳鼠65只(整窝鼠,每窝5只),购于维通利华生物技术有限公司【SCXK(京)2016-0006】。饲养于中国中医科学院中药研究所ABSL-2实验室IVC饲养系统【SYXK(京)2019-0003】。昼夜各半循环照明,湿度50%,温度控制在22~25℃,饲喂普通维持饲料。所有操作符合中国中医科学院中药研究所动物福利伦理委员会要求(审批号:2020D030)。
1.1.2 细胞
非洲绿猴肾细胞(Vero),购于北京北纳创联生物技术研究院(编号:BNCC337868)。肠道病毒Cox A16株购于清华大学生命科学院,经本实验室常规传代、保存。
1.1.3 主要试剂与仪器
柯萨奇病毒16型(CA16)核酸测定试剂盒(QR-0439-02,Liferiver);核酸提取试剂盒(Z-ME-0010,Liferiver);BD Cytometric Bead Array(CBA)Mouse/Rat Soluble Protein Master Buffer Kit(558266,BD)、Mouse G-CSF Flex Set(560152,BD)、Mouse MCP-1 Flex Set(558342,BD)、Mouse MIP-1αFlex Set(558449,BD)。DMEM(26418007,Gibco);胎牛血清(35081003,Gibco);PBS(26318001,Gibco);胰酶(06519005,Gibco);生物安全柜(批号:A2型MSC1.2,Thermo Scientific);倒置显微镜(OLMPUS CKX41,OLMPUS);CO2培养箱(Thermo-371,Thermo Scientific);流式细胞仪(BD FACSCelesta,美国BD);PCR仪(QuantStudio 5)。
1.2 方法
1.2.1 病毒毒力测定
将Vero细胞接种于96孔板,每孔100μL,1×104个细胞/孔。在长至单层的Vero细胞的培养板中,分别加入用培养液做10-1~10-8连续10倍稀释的CoxA16株病毒,每孔100μL,设4个复孔。将细胞培养板置于37℃、5%CO2培养箱中培养48 h,每日于倒置显微镜下观察。按照Reed-Muench法计算50%细胞毒性浓度(TCID50)。细胞的病变判断依据为:(-)为细胞生长正常,无病变;(±)为细胞病变少于整个单层细胞的10%;(+)为细胞病变约占整个单层细胞的25%以下;(++)为细胞病变约占整个单层细胞的50%以下;(+++)为细胞病变约占整个单层细胞的75%以下;(++++)为细胞病变约占整个单层细胞的75%以上。
3日龄,SPF级BALB/c乳鼠,经腹腔注射100、10-1、10-2、10-3倍比稀释的Cox A16株病毒,每只100μL,同时设置正常对照组。记录各组死亡情况及感染程度打分,共观察14 d。感染程度分级标准见表1[7]:

表1 症状打分表Table 1 Clinical score table
1.2.2 动物感染实验
3日龄,SPF级,BALB/c乳鼠每组10只,腹腔注射3 LD50Cox A16株病毒100μL,于感染后第6天,分别取血清、后肢肌肉、脑组织、心脏组织、肠组织。
1.2.3 CBA法测血清中趋化因子含量
按照BD Cytometric Bead Array(CBA)Mouse/Rat Soluble Protein Master Buffer Kit及Mouse MCP-1 Flex Set、Mouse MIP-1βFlex Set、Mouse G-CSF Flex Set说明书进行血清中MIP-1β、MIP-1α、G-CSF浓度测定。将标准品(2500 pg/mL)进行2倍梯度稀释(共9个稀释度),同时设阴性对照;向装有50μL标准品及待测样品的EP管中加入50μL捕获珠混悬液,轻轻吹打混匀,室温避光孵育1 h。加入配置的检测抗体,轻轻吹打混匀,室温避光孵育1 h。每个EP管中加入1 mL洗涤缓冲液,200 g室温离心5 min,弃去上清。用300μL洗涤缓冲液重悬,充分混匀后上机检测。采用BD FACSDiva 8.0.1.1分析各样品中趋化因子含量。
1.2.4 后肢肌肉病毒载量测定
精称每只后肢肌肉组织、心脏、脑、肠20 mg,加入1000μL生理盐水,于冰上研磨为匀浆。按照Liferiver核酸提取试剂说明书的方法,提取RNA。进一步采用柯萨奇病毒16型(A16)核酸测定试剂盒进行实时荧光PCR反应。反应条件为50℃×30 min;95℃×10 min;95℃×15 s→55℃×40 s,循环45次;单点荧光检测55℃,反应体系15μL。使用Sequence Detection System软件分析PCR过程各检测样本的Ct(Threshold of cycle)值,采用ΔΔCt法计算病毒的相对表达量。
1.2.5 病理检测
后肢肌肉组织、脑组织使用5%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,浸蜡包埋,切片,HE染色,中性树胶封片。光学显微镜下进行病理检查。
后肢肌肉组织镜下判断标准:“-”:肌肉组织未见有肌组织断裂、萎缩,间质未见有炎症细胞浸润,组织未见有水肿等变化。“+”:肌肉组织未见有明显断裂、萎缩,间质未见水肿,未见有明显炎症细胞渗出,组织细胞有成群聚集,不明显。
“++”:肌肉组织有不同程度断裂,肌组织有肿胀,间质有炎症细胞渗出,并有少量瘀血。“+++”:肌肉组织有明显断裂、萎缩,肌间质有大量炎症细胞渗出,水肿明显,小血管有瘀血;肌肉间质有大量细胞聚集,无规律。“++++”:肌肉组织大面积断裂、水肿,间质炎症。病理学检查镜下判断标准:“-”:乳鼠脑组织未见有瘀血,细胞未见增生。“+”:乳鼠脑组织脑膜有轻度瘀血,局部性。“++”:乳鼠脑组织局部有瘀血,细胞增生。“+++”:乳鼠脑组织有大片状脑膜缺损,组织脱落,并有局部脑膜瘀血。“++++”:乳鼠脑组织大面积组织细胞软化,脑膜损伤、瘀血。
1.3 统计学分析
数据采用SPSS 26.0进行分析,计量资料以平均值±标准差(±s)表示,采用单因素方差分析(One-Way ANOVA),正态分布等方差资料采用LSD检验,若方差不齐时采用Kruskal-Wallis test检验。等级资料采用Mann-Whitney检验。P<0.05为差异具有显著性。
2 结果
2.1 Cox A16毒力测定
分别用Vero细胞及3日龄BALB/c乳鼠测定其毒力,经Reed-Muench法计算,TCID50=10-4.5。如图1A所示,3日龄BALB/c乳鼠病毒注射剂量与临床症状打分正相关。用病毒原液攻毒,第4天动物全部后肢瘫痪、死亡。用1×10-1稀释度病毒量攻毒,第3天开始出现临床症状,第11天完全死亡。随病毒量减少,1×10-2、1×10-3稀释度动物临床评分降低(见图1B)。经Reed-Muench法计算COXA16对3日龄BALB/c乳鼠模型毒力为每毫升56 LD50。

图1 3日龄BALB/c乳鼠感染COX A16生存率及临床症状打分Figure 1 Survival rate and clinical score of 3 days old BALB/c sulking mice infected COX A16
2.2 乳鼠生存曲线、临床得分及体重变化
3日龄BALB/c乳鼠模型经腹腔注射3 LD50CoxA16株后,11 d内模型组死亡率为100%(见图2 A),其感染程度积分(见图2B)、死亡率、生存天数与正常对照组比较均具有显著性差异(P<0.01)。模型组感染6 d后,出现后肢瘫痪,精神萎靡,体重持续减轻(见图2C),甚至死亡(见图2D)。

图2 CoxA16型手足口病模型的构建Note.A.Survival rate.B.Clinical score.C.Weight.D.Typical effected symptom of sulking mice:hind limb paralysis.Figure 2 Establishment of HFMD model infected CoxA 16 in mouse
2.3 趋化因子的检测
对感染6 d后CoxA16株3日龄BALB/c乳鼠血清中趋化因子采用CBA法进行检测,模型组乳鼠MCP-1、G-CSF含量均显著性升高(P<0.01)(见图3)。

图3 CoxA16株感染BALB/c乳鼠趋化因子含量Figure 3 Chemokine content of mice infected with Cox A16
2.4 病毒载量
对3日龄BALB/c乳鼠感染CoxA16株5 d后,乳鼠后肢肌肉组织、心脏、脑、肠进行RT-PCR病毒载量测定,病毒载量均显著升高(P<0.01),表明CoxA16株感染BALB/c乳鼠,并在其体内进行了有效的复制和增殖,其中后肢肌肉病毒载量最高,心脏次之(见图4)。

图4 CoxA16株感染BALB/c乳鼠组织病毒载量Figure 4 Viral loads in tissue of BALB/c sulking mice
2.5 病理检测
对感染6 d后CoxA16株3日龄BALB/c乳鼠后肢肌肉组织、脑组织进行HE染色。正常对照组乳鼠肌肉组织结构正常,病变评分为0.00。模型对照组乳鼠肌肉组织有大面积萎缩、断裂,间质肿胀,炎症细胞渗出,大量细胞聚集,间质并有瘀血等病理变化,组织病变评分为3.20,病变程度明显(P<0.01)。
正常对照组乳鼠脑组织、脑膜结构正常,病变评分为0.00。模型对照组乳鼠脑组织、脑膜有局限性缺损,组织脱落,细胞局限性增生,局部有瘀血。乳鼠脑组织间质有大面积神经细胞软化区,各级神经细胞有不同程度的萎缩,脑组织并有局限性缺损,组织病变评分为2.70,病变具有显著性差异(P<0.01)(见表2,图5)。

表2 CoxA16株感染BALB/c乳鼠后肢肌肉组织、脑组织病理分级Table 2 Pathological grade of hindlimb muscle and brain of BALB/c sulking mice infected with Cox A16
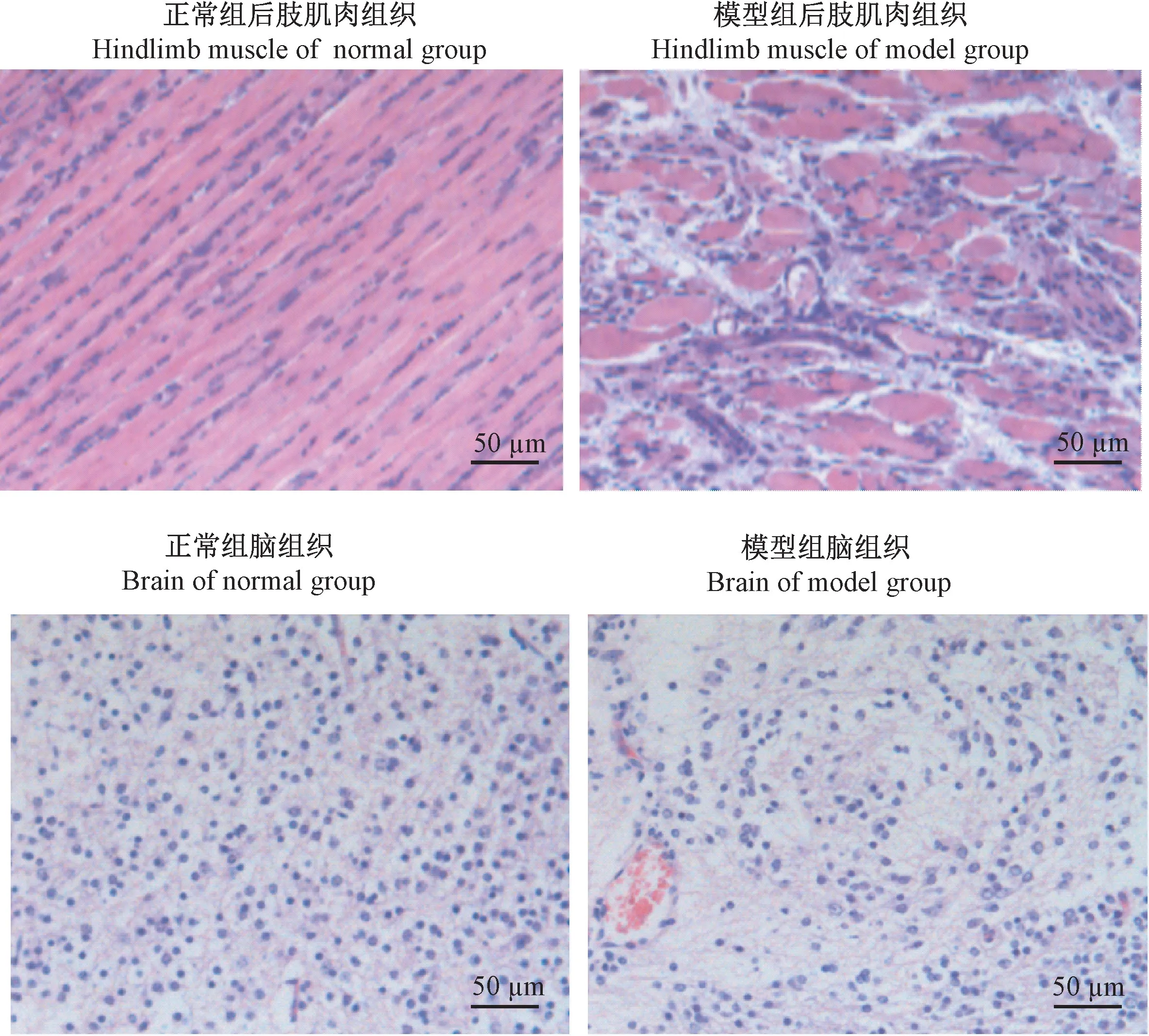
图5 后肢肌肉组织、脑组织病理变化Figure 5 Pathological changes of hindlimb muscle and brain
3 讨论
柯萨奇A16病毒是手足口病的主要致病病原,其感染也可引起严重心肌炎、急性心力衰竭,甚至死亡。然而其致病机制研究有限,疫苗及特效药亟待研发,合适的动物模型是药物评价、疫苗研发及机制研究必要基础。BALB/c乳鼠对肠道病毒敏感,已有较多EV71感染模型研究,且BALB/c乳鼠的生长周期较短、遗传背景明确、伦理问题少,便于操作。
目前,3日龄Cox A16 BALB/c模型免疫学及致病性研究国内尚未见报道。本实验经腹腔感染建立了Cox A16株感染3日龄BALB/c乳鼠模型。本模型可以引发乳鼠后肢麻痹、瘫痪,体重降低,死亡。引发后肢肌肉组织坏死性肌炎,产生大面积萎缩、断裂,间质肿胀,后肢肌肉及脑组织病变显著,该动物模型与Cox A16型手足口病临床表现基本一致。与任庆杰等[10]11日龄C57BL/6J乳鼠模型仅为脑组织轻微淋巴细胞浸润的病理表现相比,本实验3日龄BALB/c乳鼠脑组织病变较为严重。脑膜有局限性缺损,局部有瘀血;间质有大面积神经细胞软化区,各级神经细胞有不同程度的萎缩,与重症HFMD患儿伴有中枢神经损害的临床表现具有一致性[11]。乳鼠感染Cox A16株6 d后,RT-PCR实验表明Cox A16各组织病毒载量与正常对照组比较均有显著性升高,病毒具有广泛的组织嗜性,其中后肢肌肉组织、心肌组织较高,病毒入侵后肢肌肉组织及心肌组织并造成损伤。临床HFMD患儿出现心率失常,心肌酶谱异常,与临床患儿症状一致[12-13]。在乳鼠模型建立中,在操作前应注意用医用酒精喷洒手套,操作后需用医用酒精轻轻擦拭乳鼠,避免母鼠咬伤乳鼠。
Cox A16感染后6 d后,模型组乳鼠血清中MCP-1、G-CSF与正常对照组相比均显著性提高(P<0.01)。中性粒细胞在手足口病致病过程、炎症形成中发挥主导作用,大量趋化因子进入局部组织,引发炎症效应,形成炎症风暴的级联点[10]。GCSF是调动中性粒细胞的重要因子,与手足口病严重程度呈正相关[14],MIP-1α为趋化因子CC家族成员,可以趋化中性粒细胞,激发炎症因子释放,加重炎症反应,可在炎症早期作为药效评价指标之一[15]。
综上所述,本实验成功建立了Cox A16型3日龄BALB/c乳鼠模型,进行了免疫、病理、病毒学研究,完善了Cox A16现有的动物模型,为药物评价及筛选奠定基础。
