系统评价胎盘差异表达蛋白对妊娠糖尿病大鼠模型胎盘生长发育的影响
2021-07-17陈凡葛莉黄萍萍江心泳赖玉婷庞书勤
陈凡,葛莉,黄萍萍,江心泳,赖玉婷,庞书勤
(福建中医药大学护理学院,福州 350003)
妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠常见并发症之一,其发病率逐年上升。目前,GDM的临床筛查诊断主要基于妊娠28周的口服葡萄糖耐量试验,操作复杂且缺乏统一的筛查和诊断标准[1-2]。另外,研究表明经胰岛素治疗血糖控制良好并不能改善胎儿代谢异常情况,并可引起胎盘屏障结构和功能受损[3],表明存在高血糖以外的因素可能导致GDM的发生发展。胎盘是母儿物质交换的重要产所,最近研究发现GDM与胎盘异常有关,包括胎盘功能改变、血管功能障碍和氧化应激[4]。因医学伦理学限制,人类胎盘在妊娠过程中难以获得[5],人和大鼠胎盘同属于半侧型绒毛胎盘,且二者由糖尿病引起的分子机制改变非常相似[6],因此,常被用作分析GDM胎盘相关病理生理变化的关键工具。已有研究证实大鼠胎盘蛋白的差异表达引起的胎盘结构和功能改变可导致胎盘生长发育异常,且与GDM的发生发展密切相关[7-10],但研究所涉及的蛋白种类繁多,蛋白提取时间和表达结果不一。因此,本研究通过系统评价的方法,对GDM大鼠胎盘差异表达蛋白对胎盘生长发育的影响进行总结和分析,以期为推断人类GDM发病机理提供理论依据。
1 资料与方法
1.1 资料
1.1.1 资料来源
计算机检索PubMed、Web of Science、EMBase、Cochrane Library、Ovid和Scopus、知网、万方、维普和中国生物医学文献数据库,检索时间自建库以来至2020年9月30日。
1.1.2 纳入与排除标准
(1)纳入标准:①研究类型:对照实验;②实验对象:大鼠,实验组为GDM大鼠,对照组为正常妊娠大鼠,两组均不给予除造模外的其它措施或仅给予生理盐水或蒸馏水;③结局指标:影响大鼠胎盘生长发育的胎盘差异表达蛋白,和(或)蛋白定位,和(或)胎盘病理。
(2)排除标准:①重复发表;②综述、会议摘要、个案研究;③非中英文文献;④无法获取全文。
1.2 方法
1.2.1 文献检索策略
检索策略为主题词和自由词相结合。中文检索词为“糖尿病,妊娠”、“糖尿病,妊娠性”、“糖尿病,妊娠引致”、“妊娠糖尿病”、“糖尿病妊娠”、“大鼠”、“胎盘”、“蛋白质类”、“蛋白”;英文检索词为“Diabetes,Gestational”、“Pregnancy in Diabet*”、“Gestational Diabetes”、“GDM”、“Gestational Diabetes Mellitus”、“Diabetes Mellitus,Gestational”、“Diabetes and Pregnan*”、“Pregnancy Diabetes Mellitus”、“Diabetes Mellitus in Pregnancy”、“Glucose Intolerance and Pregnan *”、 “Pregnancy Hyperglycemia”、“Diabetes and Pregnancy Induced”、“Diabetes Mellitus Gravidarum”、“Pregnancy Glucose Abnormalities”、“Rat”、“Rats”、“Placenta”、“Placentas”、 “ Placentation”、 “ Placenta Development”、“Proteins”、“Protein”。此外,对最终纳入研究的参考文献进行手工检索,以防漏检。
1.2.2 文献筛选与资料提取
由2名研究者独立进行文献筛选和资料提取,并交叉核对,遇分歧双方讨论或咨询第三方意见。采用预先制定的资料提取表进行资料提取,包括:第一作者、年份、大鼠品系、体重、样本量、造模方法、造模时间、检测时间、蛋白名称、检测方法和结局指标。
1.2.3 文献质量评价
由2名研究者使用SYRCLE动物实验偏倚评估工具(SYRCLE’s risk of bias tool for animal studies)[11]对纳入研究进行独立评估和交叉核对,遇分歧双方讨论或咨询第三方意见。SYRCLE包括6种偏倚类型,10个条目,具体为序列生成、基线特征、分配隐藏、动物安置随机化、盲法(实施偏倚)、随机性结果评估、盲法(测量偏倚)、不完整数据报告、选择性结果报告和其他偏倚来源。该评估工具结果以“是”,“否”和“不确定”表示,其中,是代表“低偏倚风险”、否代表“高偏倚风险”、不确定代表“不确定偏倚风险”。
1.3 统计学分析
由于纳入研究胎盘蛋白种类分散、检测时间不一,故本研究对胎盘蛋白功能、蛋白时空定位和胎盘病理进行描述性分析。
2 结果
2.1 文献检索结果
初检获得文献794篇,排除重复文献235篇,初筛排除453篇,复筛排除90篇,最终纳入16篇,具体见图1。
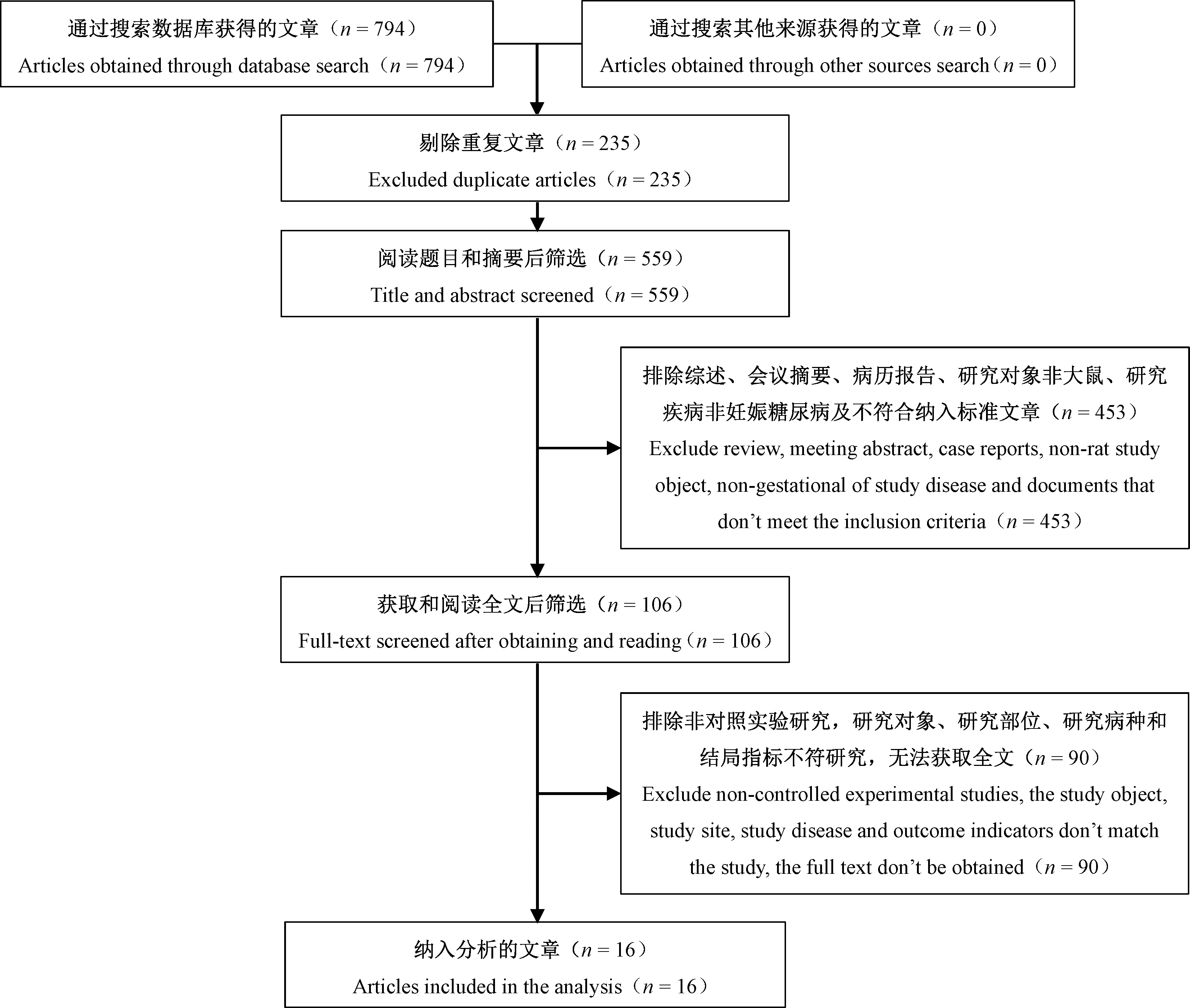
图1 研究筛选流程图Figure 1 Flowchart of study screening
2.2 纳入文献基本特征
纳入研究的基本信息见表1、2。实验对象包括SD大鼠和Wistar大鼠,体重集中在120~300 g。12项研究采用化学诱导法建立GDM模型;2项联合化学和饮食诱导;2项采用自发性GDM模型。共检测到23个胎盘蛋白,提取时间为妊娠11~21 d(G11-21),其中妊娠早期为G1~G9,妊娠中期为G10~G15,妊娠晚期为G16~G21。蛋白表达通过蛋白质印迹(Western Blot)或免疫组织化学(immunohistochemistry,IHC)检测,IHC也用于蛋白定位;苏木精-伊红染色(hematoxylin-eosin staining,HE)检测胎盘病理;血管伊文思蓝(evans blue,EB)检测血管通透性。
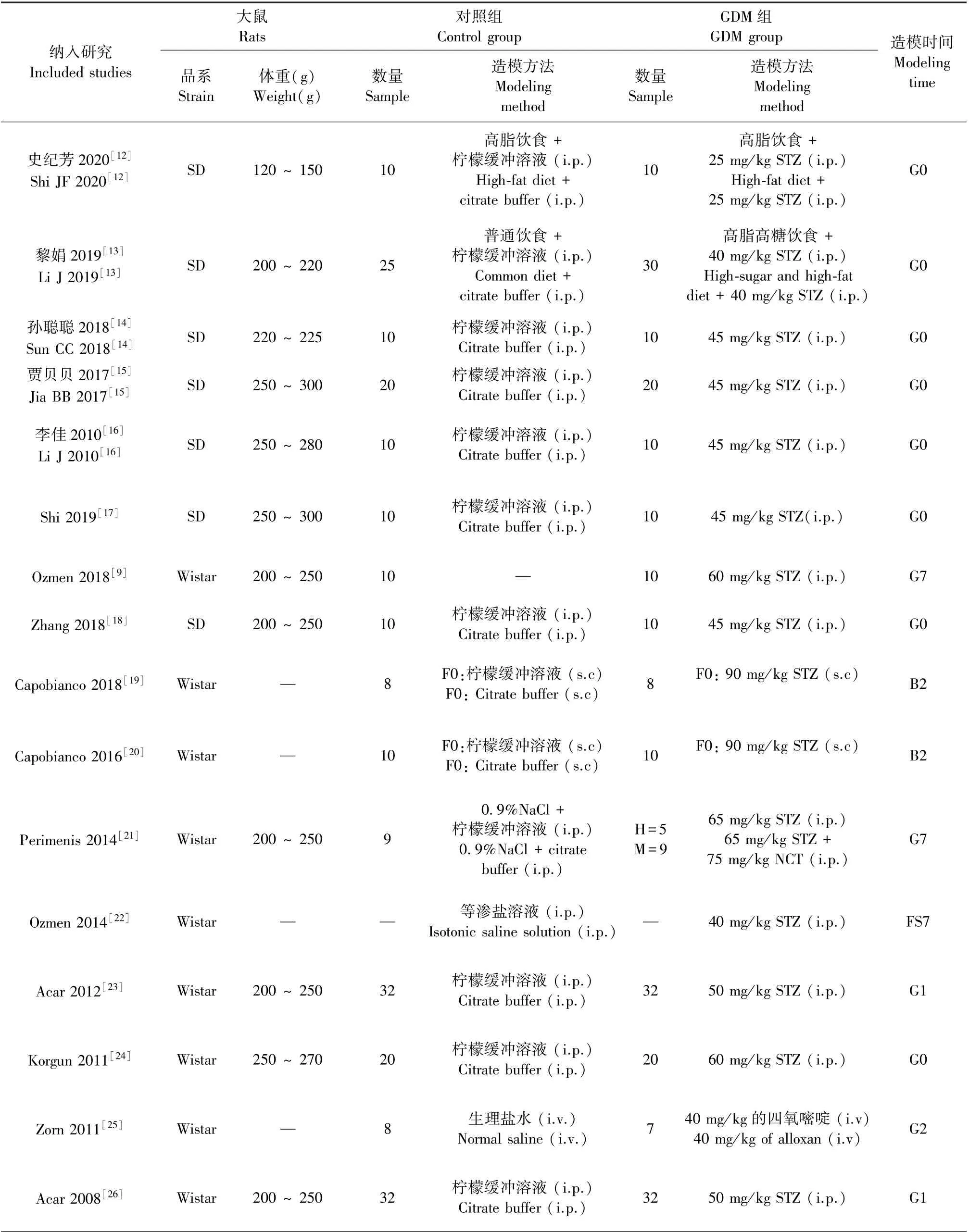
表1 纳入文献的基本特征Table 1 Characteristics of included studies
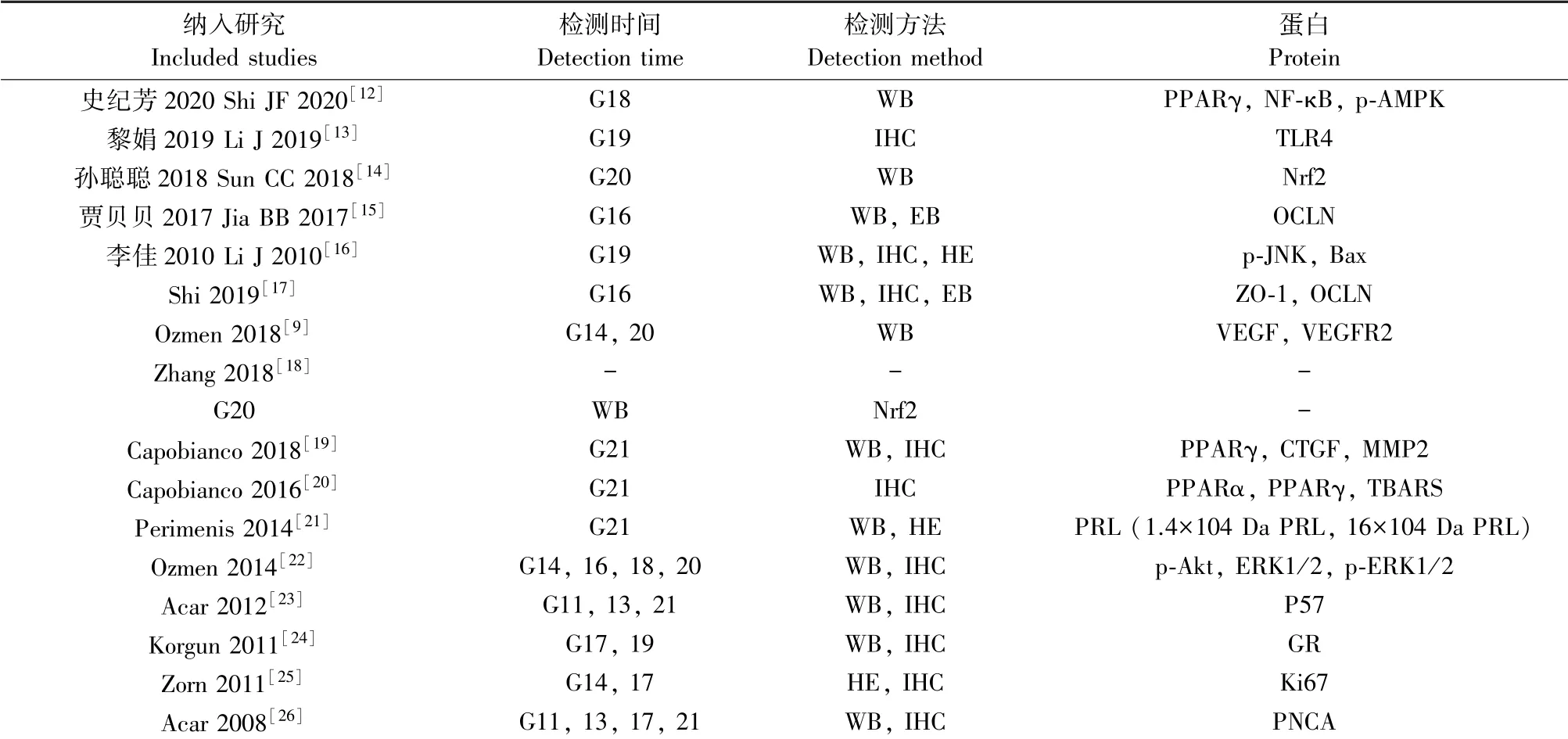
表2 纳入文献的基本特征Table 2 Characteristics of included studies
2.3 文献质量评价
纳入研究偏倚风险评估如图2。在纳入的16篇研究中,仅3篇提及具体的随机序列生成方法[14,16,18];5篇基线特征均衡[12-14,16,18];13篇报道动物安置环境具有一致性[9,13-14,16-19,21-26];1篇未对退出动物是否会影响研究结果进行分析和说明[13];另外,纳入研究均未具体描述是否进行分配隐藏、随机性结果评估和盲法(实施/测量偏倚)。

图2 偏倚风险评估表Figure 2 Risk of bias assessment form
2.4 不同妊娠天数大鼠胎盘蛋白表达变化
GDM大鼠胎盘蛋白表达变化如图3所示。虽然纳入研究均报告了GDM大鼠妊娠期间存在胎盘蛋白表达异常,但由于大鼠品系、造模药物剂量和时间、蛋白种类和测量时间存在较大差异,因此无法对不同研究间的数据进行Meta分析。
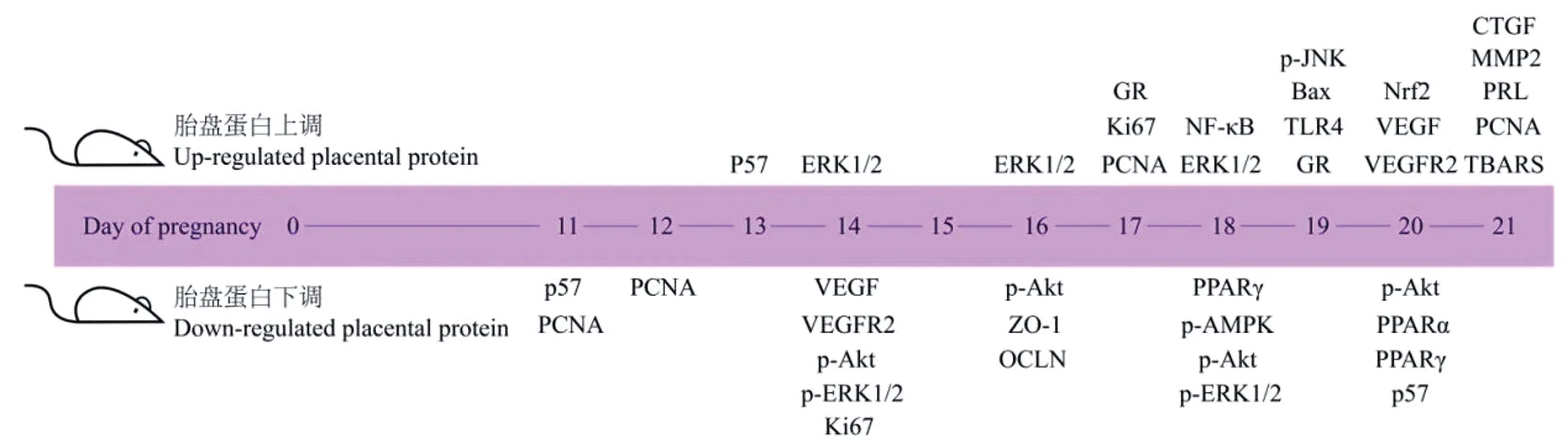
图3 GDM大鼠胎盘蛋白表达水平Figure 3 Expression level of placental protein in GDM rats
2.5 胎盘差异表达蛋白对大鼠胎盘生长发育的影响
2.5.1 影响大鼠胎盘滋养细胞增殖和凋亡
6项研究检测了与GDM大鼠不同妊娠时间胎盘滋养细胞异常行为相关的蛋白(图4)。妊娠中早期Akt和ERK1/2活力降低使滋养细胞凋亡增加[22]。妊娠中早期p57表达上调、PCNA下调,晚期p57下调、PCNA上调,引起细胞周期紊乱,导致妊娠早期小胎盘和晚期胎盘肿大[23,26]。妊娠晚期GR高表达促进糖皮质激素介导的滋养细胞增殖[24];Ki67表达上调促进滋养层细胞增殖[25];p-JNK表达上调诱导Bax过表达,引起滋养细胞凋亡[16]。
2.5.2 干扰大鼠胎盘血管生成、增加通透性
5项研究报道GDM大鼠不同妊娠时间胎盘蛋白表达失调参与胎盘血管异常发育(图4)。妊娠中期ZO-1和OCLN表达下调使胎盘血管完整性破坏,通透性增加[15,17]。妊娠晚期,VEGF及其受体VEGFR2表达上调促进胎盘血管生成,且二者表达模式与胎盘重量呈正相关[9];PRL片段(14×103PRL和16×103PRL)高表达使胎盘血管生成缺陷[21];CTGF和MMP2表达上调使胎盘动脉血管重塑缺损[19]。
2.5.3 增强大鼠胎盘妊娠晚期氧化应激反应
6项研究报道了6个参与GDM大鼠妊娠晚期胎盘氧化应激的蛋白(图4)。其中Nrf2高表达增强细胞清除氧自由基和抗氧化能力[14,18];p-JNK高表达激活JNK信号通路,增强组织氧化损伤,最终导致细胞凋亡和病理改变[16];PPARγ及p-AMPK表达下调,增强胎盘局部氧化应激[12];PPARα和PPARγ低表达上调氧化应激标志物TBARS,引起胎盘脂质过氧化[19-20]。
2.5.4 增强大鼠妊娠晚期胎盘炎症反应
3项研究报道了3个参与GDM大鼠妊娠晚期胎盘炎症反应的蛋白(图4)。其中TLR4表达上调使胎盘局部慢性炎症增强并呈持续性状态[13];PPARγ表达下调及NF-κB表达上调,引起炎症细胞因子表达和释放增多[12]。PPARα和PPARγ表达下调使胎盘蛋白硝基甲基化增强和硝化蛋白量增多,进而引起胎盘发生炎症反应[19-20]。
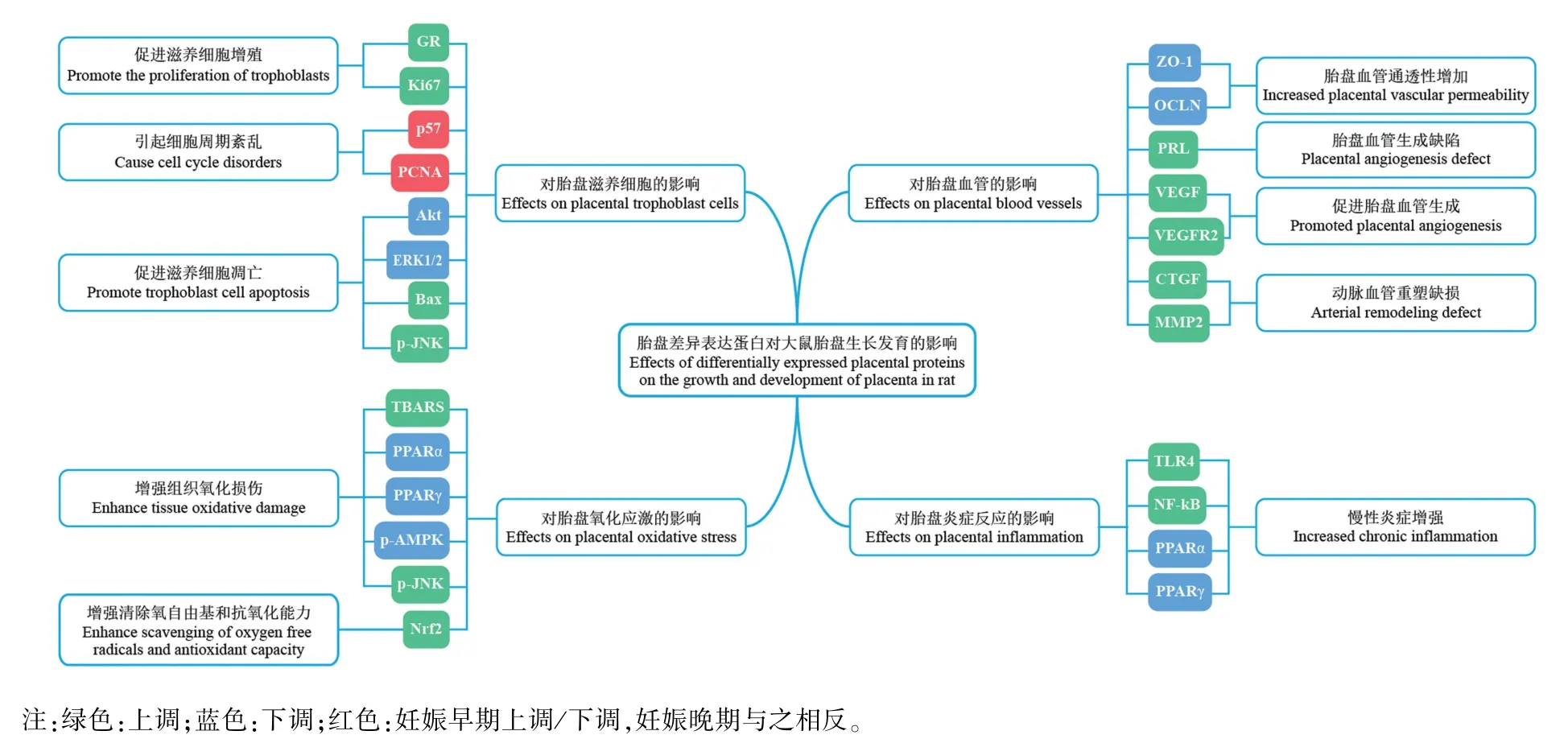
图4 胎盘差异表达蛋白对大鼠胎盘生长发育的影响Note.Green.Up-regulation.Blue.Down-regulation.Red.Up-regulation/dowm-regulation in the first trimester was reversed in the third trimester.Figure 4 Effects of differentially expressed placental proteins on the growth and development of placenta in rats
2.6 大鼠胎盘差异表达蛋白时空定位
纳入研究结果显示:p-JNK在胎盘绒毛膜层及蜕膜细胞(decidual cells,DCs)的胞浆和胞核表达,Bax在合体滋养细胞(syncytiotrophoblasts,Syns)、间质细胞(stroma cells,StCs)及胎儿血管内皮细胞(fetal vascular endothelial cells,FVECs)胞浆表达[16];ZO1、OCLN主要分布在Syns胞膜上,定位于Syns和FVECs的紧密连接处[17];p-Akt主要于海绵滋养细胞(spongiotrophoblasts,STPs)和巨细胞(giant cells,GCs)胞浆中免疫定位;p-ERK1/2主要分布在DCs、GCs、STPs和FVECs胞浆[22];ERK1/2在大鼠妊娠期间几乎表达于所有细胞[22];P57主要定位于迷路滋养细胞(labyrinth trophoblasts,LTs)、FVECs和STPs胞核[23];GR主要于FVECs和STPs胞浆中免疫定位[24];Ki67主要定位于STPs、LTs和GCs胞核[25];PNCA主要定位于LTs、FVECs、SPTs和GCs胞核[26],具体时空定位如图5所示。

图5 大鼠胎盘差异表达蛋白时空定位Note.Left side is a simplified diagram of rat placenta,and the right side is a simplified diagram of cells.LZ.Labyrinth zone.JZ.Junction zone.DC.Decidual layer.DCs.Decidual cells,located in DC.STPs.Spongiotrophoblast cells.GCs.Giant cells,located in JZ.FVECs.Fetal vascular endothelial cells.LTs/Syns.Labyrinth/synchrotrophoblast cells.StCs.Stromal cells,located in LZ.Green.Up-regulation.Blue.Down-regulation.G.Days of pregnancy.Figure 5 Spatiotemporal localization of differentially expressed placental proteins in rats
2.7 大鼠胎盘妊娠晚期病理改变
3项研究报道GDM大鼠妊娠晚期胎盘病理改变。其中1项研究发现GDM大鼠胎盘绒毛肿胀,间质水肿,滋养层细胞增生,毛细血管管腔空虚狭窄,细小的空泡化,正常细胞减少,组织结构紊乱[16]。1项研究表明胎盘重量显著增加,海绵滋养层面积增加和滋养层巨细胞分布的经典模式的改变[25]。1项研究显示胎盘表面血管密度减少,毛细血管管腔狭窄[21]。
3 讨论
妊娠糖尿病是妊娠期间的高发疾病,是全世界面临的重要公共卫生问题。GDM的发病机制较为复杂,经典的观点认为胎盘分泌的胰岛素拮抗激素可介导机体产生胰岛素抵抗,进而促进GDM发生。近年来,研究发现GDM所致高血糖可导致胎盘蛋白表达异常,反之,胎盘蛋白表达异常又可促进GDM及其并发症的发生发展,可作为GDM筛查的特异性生物标志物和治疗靶点[27-29]。因医学伦理学限制,人类胎盘在妊娠期间难以获得。正常妊娠大鼠胎盘主要由蜕膜层、交界区和迷路区三层构成,其病理结构呈中央厚、边缘薄、细胞分布均匀、毛细血管丰富的暗红色半侧型结构[30-32],与人类胎盘在结构和功能有许多相似之处,可将其用于推断人类胎盘相关疾病方面提供依据。
本研究结果显示GDM大鼠胎盘交界区与迷路区GR、p-Akt、p-ERK1/2、ERK1/2、p-JNK、Bax和细胞周期相关蛋白(p57、PCNA和Ki67)表达异常影响滋养细胞的存活、增殖、迁移、侵袭和凋亡功能。胎盘的生长发育本质上是滋养细胞增殖、分化和侵袭适当协调的结果[31]。大鼠胎盘滋养细胞异常行为可引起滋养层面积增加,细胞间间隙变大,细胞松散无序,胎盘出现明显水肿和重量改变等病理变化,这与先前的研究一致[32]。糖皮质激素是机体应激和免疫反应的主要介质,细胞实验表明高表达的GR具有刺激糖皮质激素介导的滋养细胞增殖、迁移和侵袭作用[33]。与GDM大鼠模型一致,免疫组化显示GDM孕妇胎盘Bax主要定位于合体滋养细胞[34],p-JNK可促进Bax过表达并向线粒体膜移位,使线粒体膜通透性增加,并通过与其它凋亡因子相互作用诱导滋养细胞凋亡[35]。细胞实验表明ERK1/2和Akt活性降低可抑制滋养细胞增殖,促进滋养细胞凋亡[36-37],造成GDM大鼠妊娠早期小胎盘形成;妊娠晚期活性降低可对高血糖条件起防御作用,抑制滋养细胞过度增殖,为正常胎盘和胎儿生长创造最佳条件[22]。此外,研究发现维持妊娠期间胎盘细胞周期相关蛋白稳态水平也是控制滋养细胞存活、增殖和侵袭的重要机制[38-39]。由此推断,上述胎盘蛋白异常表达通过影响GDM大鼠胎盘滋养细胞存活、增殖、迁移、侵袭和凋亡能力,引起胎盘发生病理改变,导致胎盘生长发育异常,这可能是促进或加重GDM发生发展的原因之一。
除滋养细胞外,胎盘蛋白的异常表达还可通过干扰GDM大鼠胎盘血管生成、重塑和增加血管通透性来改变胎盘的结构和功能,影响胎盘的生长发育,从而进一步引起GDM的发生或加重[40]。正常的血管生成和转化是胎盘生长和发育所必需的[30]。妊娠中期迷路区紧密连接蛋白ZO1、OCLN表达下调不仅可引起血管内皮细胞通透性增加[41],还可使迷路滋养层细胞紧密连接结构破坏进而影响胎盘功能的正常发挥[42]。基质细胞蛋白CTGF和重塑因子MMP2是血管重塑的关键,二者表达上调可能通过促进内皮细胞的异常增殖、迁移和侵袭,使细胞外基质胶原沉积减少和动脉螺旋重塑缺陷,且MMP2已被证实可作为检测糖尿病严重程度的临床指标[43-44]。PRL具有血管收缩功能,其水解片段于妊娠晚期高表达可刺激内皮细胞凋亡,引起血管通透性增加、胎盘表面血管密度降低和血管管腔塌陷,从而导致胎盘功能障碍[45]。与之相反,VEGF作为内皮细胞和血管生成的主要介质[46],VEGF及其受体VEGFR2表达上调可诱导内皮细胞增殖和迁移,促进血管生成,进而导致胎盘增大[47-48]。由此,推断胎盘血管生成发育障碍可能导致胎盘结构和功能异常,进而诱发或加重GDM。
此外,胎盘差异表达蛋白还可增强GDM大鼠胎盘氧化应激和炎症水平。有研究发现一定程度的氧化应激可使胎盘形成缺氧状态,维持GDM大鼠胎盘氧化还原稳态,缓解氧化应激并预防GDM并发症的发生[49]。临床、细胞和动物实验均表明PPARα和PPARγ减少或缺失可使胎盘产生过量的一氧化氮和活性氧,引起胎盘氧化应激因子和炎症因子释放增多,使胎盘脂质过氧化和蛋白硝基甲基化增加,进而影响滋养细胞的增殖、分化、浸润、迁移和细胞外基质的重塑,引起血管内皮损伤,加剧胎盘氧化应激和炎症状态形成的恶性循环,诱发胎盘发生病理改变[50-54],这可能是促进或加重GDM发生发展的另一重要原因。
本研究对符合纳入标准的16个动物实验进行系统评价,尚存在一定的局限性。其一,由于纳入研究在实验动物品系、造模药物剂量和时间、结局指标的种类和测量时点方面存在较大的异质性,使得纳入研究数据无法进行Meta分析,在一定程度降低结论的可靠性。其二,大鼠胎盘蛋白表达水平均采用定性或相对定量分析方法进行检测,包括Westen Blot和IHC;二者为蛋白检测的传统技术方法,尚存在操作步骤多,实验可控性、稳定性和一致性差,以模拟信号展示的实验结果易受人为因素影响等问题[55-56],使得纳入研究结论可信度降低。今后研究可考虑采用单分子阵列(Simoa)和iTRAQ蛋白组学等新技术对胎盘蛋白进行检测,以获得更精准、更全面、接受度高和可靠的数字信号证据[57-58]。其三,纳入实验忽视了对研究方法的详细介绍,降低了研究内在真实性;其中,13/16的研究随机分组方法不确定,仅5/16的基线特征均衡,所有研究均未报道分配隐藏、动物安置随机化和盲法(实施/测量偏倚),1/16项研究未对失访动物是否会对结局造成偏倚进行评估,上述均可引起文献偏倚风险评估困难。因此,今后的动物实验应更加科学合理地设计并描述实验方案,以降低偏倚风险和提高证据质量。
综上所述,GDM大鼠胎盘差异表达蛋白分布具有时间性和空间性,其在妊娠期间异常表达可能通过影响胎盘滋养细胞的存活、增殖、迁移、侵袭和凋亡,干扰胎盘血管生成、重塑和增加血管通透性,增强胎盘氧化应激和炎症反应,引起大鼠胎盘发生一系列生理病理改变,进而促进GDM及妊娠并发症的发生和发展。但其结果由于偏倚风险难以评估、内部真实性较差和检测方法易受人为因素影响等原因,结论尚需大量设计科学严谨、检测方法精准全面的实验研究进行进一步验证。此外,本项研究虽是关于动物实验的系统评价,但GDM动物实验模型将允许更好地区分孕前糖尿病和GDM的发病机制,并且其结果可能有助于推断人类GDM发病机制。
