溃疡性结肠炎与湿热证溃疡性结肠炎大鼠模型的比较研究
2021-07-17李沁媚王玉涵吕菲菲徐百昌崔瑶彭小敏王颍司红彬
李沁媚,王玉涵,吕菲菲,徐百昌,崔瑶,彭小敏,王颍,司红彬
(广西大学动物科学技术学院,南宁 530004)
溃疡性结肠炎(ulcerative colitis,UC)属于炎性肠病之一,主要病理变化为乙状结肠和直肠黏膜及黏膜下层的炎性损伤。UC在欧洲和北美的平均患病率超过0.3%,其中挪威的发病率高达0.5%[1]。值得注意的是,亚洲国家的炎性肠病发生率和患病率较欧美地区偏低,然而90年代成为亚、非等国的炎性肠病发病率的转折点,尤其是韩国和中国香港等亚洲地区的发病率明显增加[2-3]。UC已经发展成为一种全球性疾病,因其反复发作和长期治疗的特性被称为“绿色癌症”,因此受到了越来越多的关注。
湿热证(damp-heat syndrome,DH)是中医常见证候,多因感受湿热外邪、喜食肥甘厚腻、嗜酒、饮食不节等因素引起机体内酿湿生热、湿热交蒸。2017年《溃疡性结肠炎中医诊疗专家共识意见》中指出活动期UC多属实证,主要病机为湿热蕴肠[4],大肠湿热证是UC活动期最重要的证型[5]。尽管目前有少量关于湿热病因所致UC的免疫标识物的报道[6],然而湿热因素在UC疾病发展进程中的影响及机制尚不完全清晰。
目前国际较为认可的造模方法是葡聚糖硫酸钠(dextran sulfate sodium,DSS),其诱导的结肠炎模型因其简单性和与人类溃疡性结肠炎的许多相似性而被广泛使用[7-9],前期总结了近年来中药防治湿热证的药效作用及机制研究[10],为进一步研究UC发病机制及中药疗效机理,选择使用“DSS”和“DSS+复合因素”分别构建普通UC大鼠模型和湿热证UC大鼠模型,通过对比这两种模型,试图说明普通UC与湿热证UC的区别与联系。
1 材料与方法
1.1 材料
1.1.1 实验动物
24只7~8周龄SPF级SD大鼠,雌雄对半,体重200~220 g,由长沙市天勤生物技术有限公司提供【SCXK(湘)2019-0014】。饲养于广西植物研究所生物技术中心屏障环境动物室【SYXK(桂)2020-0002】,饲养环境保持12 h的明暗循环,温度(24±2)℃,相对恒定的湿度(50%±10%)。大鼠维持饲料购自北京科澳协力饲料有限公司,常规标准喂养,自由饮水。所有操作均遵守广西大学实验动物管理和伦理委员会准则(审批号:2019-084)。
1.1.2 主要试剂与仪器
DSS(MP Biomedicals,Q8378),冠生园蜂蜜(上海冠生园,SC12731012000317),牛栏山二锅头(北京顺鑫,56%vol),猪油购自南宁大康惠超市,二甲苯(国药集团,10023418),中性树胶(国药集团,10004160),HE染液(上海照华,G1005),分化液(上海照华,G1005-3),返蓝液(上海照华,G1005-4),大便隐血检测试剂盒、二胺氧化酶(DAO)、髓过氧化物酶(MPO)测试盒、还原型谷胱甘肽(GSH)测试盒、丙二醛(MDA)测试盒均购自南京建成生物公司(C027-1-1,AO88-1-1,A044-1-1,A006-2-1,A003-1-2),大鼠皮质醇(Cortisol)、大鼠热应激蛋白(HSPs)、总蛋白定量测定、大鼠白细胞介素10(IL-10)、大鼠肿瘤坏死因子α(TNF-α)、大鼠巨噬细胞炎性蛋白1α(MIP-1α)、大鼠巨噬细胞炎性蛋白1β(MIP-1β)酶联免疫吸附试验(ELISA)试剂盒均购自江苏酶免实业有限公司(MM-0574R1,MM-0686R1,MM-2002577,MM-0195R1,MM-0104R1,MM-0180R1,MM-2002577)。
高速组织研磨仪(塞维尔,KZ-II,武汉),酶标仪(赛默飞世尔,Multiskan FC,上海),洗板机(Thermo Labsystems,AC8,芬兰),离心机(Eppendorf AG,810R,德国),分析天平(菁海,FA1004,上海),恒温水浴锅(金坛市医疗,HH-S4,金坛),正置光学显微镜(尼康,Nikon Eclipse E100,日本),紫外分光光度计(津岛制作所,UVmini-1240,日本),恒温生化培养箱(精宏,BPH-9162,上海),智能恒温恒湿培养箱(生元,LHS-250,郑州),全自动动物生化分析仪(优利特,URIT-8021Vet,桂林)。
1.2 方法
1.2.1 分组及造模
24只SD大鼠,在1周适应期结束后,随机分为空白对照组、UC组、UC+DH组,每组8只。实验周期29 d,各组造模方式(图1)如下:

图1 造模方式Figure 1 Modeling method
(1)空白组自由采食与饮水,饲养环境的温湿度和明暗度与适应期一致,直至试验期结束。
(2)UC组大鼠在实验周期前22 d与空白组一致,第23天起自由饮用5%DSS溶液。
(3)UC+DH组大鼠在前14 d里,自由饮用蜂蜜水,单号管饲4 mL猪油,给与充足饲料,双号禁食不禁饮,经受饥饱交替;第15~22天,自由饮用蜂蜜水,自由采食普通饲料,每日管饲2 mL二锅头,每日需进入恒温恒湿箱中33℃~35℃,湿度为(95±3)%6 h;第23天开始,自由饮用5%DSS溶液,自由采食高糖饲料,每日需进入恒温恒湿箱中33℃~35℃,湿度为(95±3)%6 h。
1.2.2 一般情况观察
大鼠适应性喂养1周后,进行造模。注意饮用DSS期间的体重变化,饮用DSS前1 d给大鼠称体重,将其作为原始体重,每日早上10:00测体重,尤其记录体重增长率,观察每日的粪便性状、血便情况、腹泻程度,进行疾病活动指数(disease activity index,DAI)评分[11]。
1.2.3 样本采集及处理
戊巴比妥(40 mg/kg,BW)麻醉大鼠后,用无菌EP管收集血液,室温下静置0.5 h后放入4℃冰箱,冷藏1 h后经2000 r/min转速离心取淡黄色澄清上清液,备用。采用二氧化碳窒息法处死大鼠,用手术刀剪剖开腹腔,完整取出盲结肠段,记录结肠长度,收集结肠样品,经液氮冷冻后,转移至-80℃冰箱中保存。
1.2.4 结肠病理组织学检测
模型组大鼠结肠组织病变明显处取1.5 cm环状肠腔,其余组取该组大鼠结肠对应位置,选材部位尽量保持一致,然后置于10%中性福尔马林缓冲液中,24 h后进行脱水、浸蜡、包埋、石蜡切片、脱蜡、苏木素染色、伊红染色、脱水封片、镜检集图。病理生物学切片采用盲法评估,根据既往研究依据以下参数进行评分:仅结构改变、炎症、固有层中性粒细胞、上皮中性粒细胞、隐窝破坏、糜烂或溃疡。通过病理切片观察肠道黏膜损伤程度,进行Geboes标准分级评分[12]。
1.2.5 血清生化检测
用1000μL移液枪从上述血清,抽取400μL放入生化检测杯中,将血清样品放入全自动生化检测仪检测血清中的甘油三脂(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血糖(GLU)、胆固醇(CHOL)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)含量。
1.2.6 ELISA法检测皮质醇和热应激蛋白的表达
根据酶免试剂盒说明书检测血清中的皮质醇和结肠HSPs的含量。
1.2.7 血清DAO含量的测定
采用南京建成试剂盒说明书方法,检测血清中的DAO含量。
1.2.8 结肠MPO、MDA、GSH的测定
4℃冷藏的0.86%生理盐水与结肠组织按9∶1比例混合,经研磨仪研磨后,低温离心机转速2000 r/min,在离心15 min后取匀浆上清,制备成不同浓度的结肠上清液,采用南京建成试剂盒说明书方法,检测结肠中MPO、MDA、GSH含量。
1.2.9 ELISA法检测结肠细胞因子变化
称取1 g结肠组织,加入9 mL的pH=7.2~7.4的PBS,用研磨仪将标本匀浆充分。离心20 min左右(2000~3000 r/min),仔细收集上清。根据组织总蛋白定量测定试剂盒说明书提取蛋白样品,采用BCA法对蛋白样品进行定量,按照ELISA试剂盒说明书检测大鼠IL-10、TNF-α、MIP-1α、MIP-1β。
1.3 统计学分析
实验数据采用SPSS 21.0和Graph Pad Prism 8软件处理,数据满足正态分布,方差齐性的情况下,采用单因素方差分析(One-way ANOVA)进行两两比较,假定方差齐性使用LSD法分析,假定方差不齐使用Dunnett’s T3法分析,结果以平均值±标准差(±s)表示,以P<0.05表示差异具有显著性。
2 结果
2.1 一般情况
造模前,所有大鼠精神良好、毛色整洁光亮、饮食量饮水量俱佳、粪便干燥、无腹泻及肉眼血便情况,取新鲜粪便经南京建成大便隐血检测试剂盒检测均呈阴性,无隐血便可能。造模开始后,前22 d,正常环境下的大鼠,食欲良好,体重持续增加,湿热环境下的大鼠食欲由起初良好转为不佳,体重持续增长,但体重增长幅度由大转小。第23~30天,UC组与UC+DH组开始饮用5%DSS,饮用DSS初期,体重均有所增长(图2A),随着DSS刺激机体肠道产生炎症,粪便性状改变,出现腹泻血便等症状。与空白对照组相比,两类模型组大鼠体重增长幅度呈现不同程度的改变甚至下降,DAI指数显著升高;与UC组相比,UC+DH组的体重降低程度更为严重,DAI指数进一步显著升高(图2B)。
2.2 结肠长度
与空白对照组比较,两组模型大鼠结肠的长度显著缩短,具有显著性差异(P<0.05)(见图3A);与UC组比较,UC+DH组结肠的长度显著性缩短(见图3B)。

图3 各组结肠长度变化Note.A.Length of the colon shown here has been removed from the anus.B.Compared with control group,***P<0.001.Compared with UCgroup,###P<0.001.Figure 3 Changes in colonic length in each group
2.3 结肠组织病理学改变
正常大鼠结肠黏膜由柱状上皮、黏膜下层、黏膜肌层及外膜组成,如图4A所示,空白对照组大鼠结肠形态完整,肠腺排列规则,固有层内杯状细胞丰富,黏膜下层未见充血水肿、溃疡,未见炎症细胞浸润。与DAI评分和临床症状发现一致,DSS引起明显的炎症并破坏了结肠隐窝结构,UC组大鼠出现的结肠肠腺大面积消失,腺体变形,杯状细胞丢失,黏液减少,炎细胞浸润,造成严重的肠上皮损伤。与UC大鼠相比,UC+DH组大鼠结肠的肠腺几乎消失殆尽,肠上皮空泡随处可见,由此可知湿热环境与DSS能够协同加剧肠上皮结构的破坏。UC组与UC+DH组大鼠的Geboes指数显著高于空白组大鼠(P<0.001),说明单纯饮用DSS溶液与湿热环境下饮用DSS溶液造成了大鼠结肠黏膜的严重损伤。与UC大鼠相比,UC+DH组大鼠的Geboes指数显著增加(P<0.05)(图4B)。

图4 各组结肠黏膜病理变化及评分Note.Compared with control group,***P<0.001.Compared with UC group,#P<0.05.Figure 4 Pathological changes and Geboes score of colonic mucosa in each group
2.4 血脂水平的变化
与空白组相比,UC组大鼠血清中的TG、CHOL、HDL_C、LDL_C、GLU浓度无显著性差异(P>0.05)。与空白组和UC大鼠相比,UC+DH组大鼠TG、CHOL、LDL_C显著增加(P<0.001),GLU含量有所增加(P<0.05),HDL_C含量显著降低(P<0.001)(图5)。
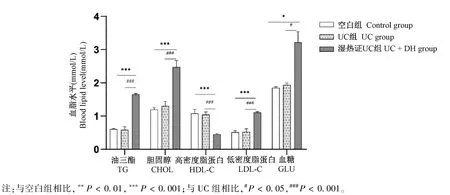
图5 血脂水平变化结果Note.Compared with control group,**P<0.01,***P<0.001.Compared with UC group,#P<0.05,###P<0.001.Figure 5 Changes in lipid levels in each group
2.5 肝功能的变化
与空白组相比,UC组大鼠的ALP、LDH、ALT、AST显著增加(P<0.05),UC+DH组ALP、LDH、ALT、AST浓度显著提升(P<0.05)。与UC组大鼠相比,UC+DH组的ALP、ALT、AST含量进一步显著升高(P<0.01)(见图6)。
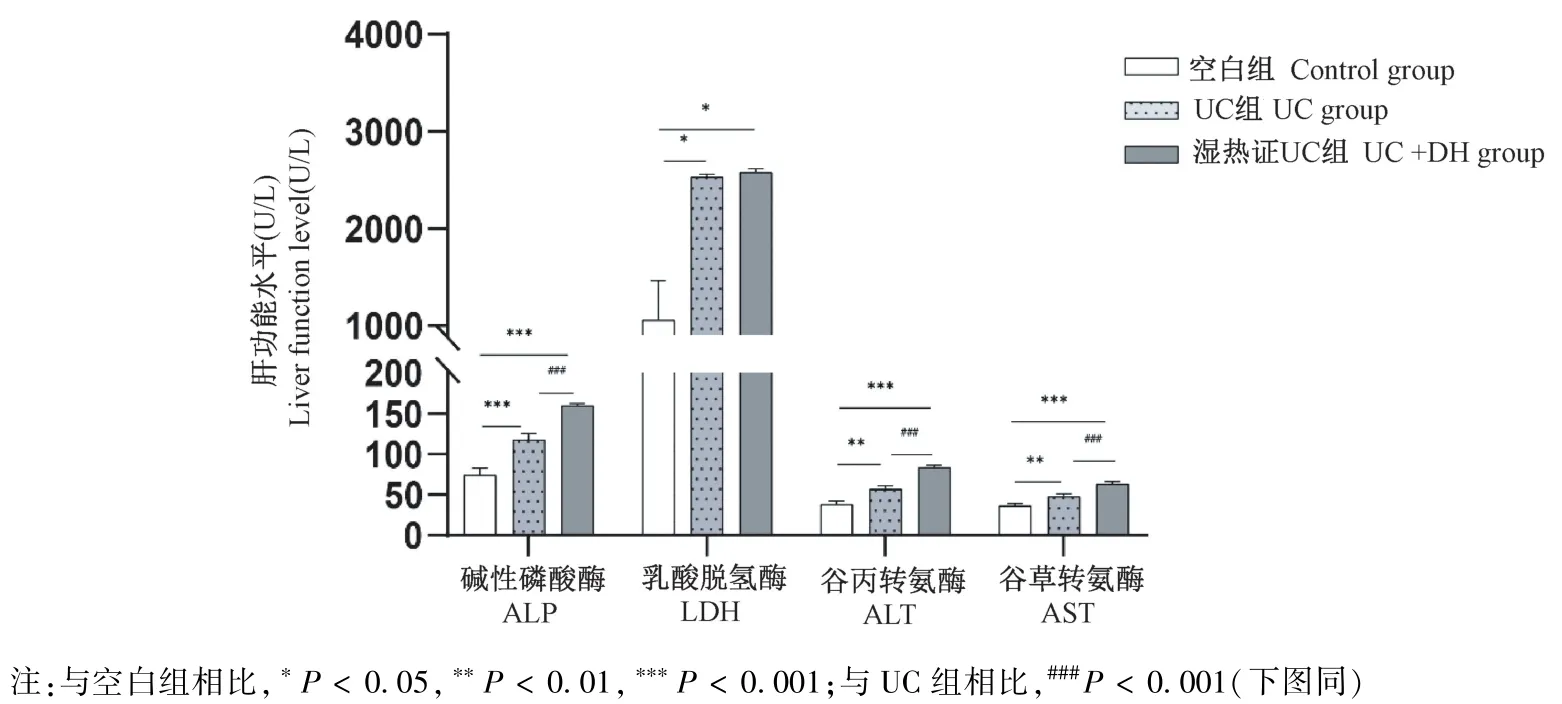
图6 肝功能变化结果Note.Compared with control group,*P<0.05,**P<0.01,***P<0.001.Compared with UCgroup,###P<0.001.(The same in the following figures)Figure 6 Results of liver function changes
2.6 皮质醇、热应激蛋白和DAO的变化
与空白组相比,UC组和UC+DH组大鼠血清中的皮质醇含量显著增加(P<0.001),说明DSS能显著增加大鼠血清中皮质醇含量。其中,与UC组大鼠相比,UC+DH组的皮质醇含量进一步增加(P<0.001)(图7A),说明湿热证能进一步增加血清皮质醇含量。
与空白组相比,UC组大鼠结肠中的HSPs含量无显著性差异(P>0.05),说明DSS对HSPs的表达没有明显的影响。与空白组和UC组大鼠相比,UC+DH组大鼠结肠中的HSPs含量显著增加(P<0.001)(图7B),说明湿热因素能显著增加大鼠血清中皮质醇含量。
与空白组相比,UC组和UC+DH组大鼠血清中的DAO含量显著增加(P<0.001),说明DSS能显著增加大鼠血清中DAO含量。其中,与UC组大鼠相比,UC+DH组的DAO含量进一步增加(P<0.001)(图7C),说明湿热因素能协同DSS进一步增加血清DAO含量。
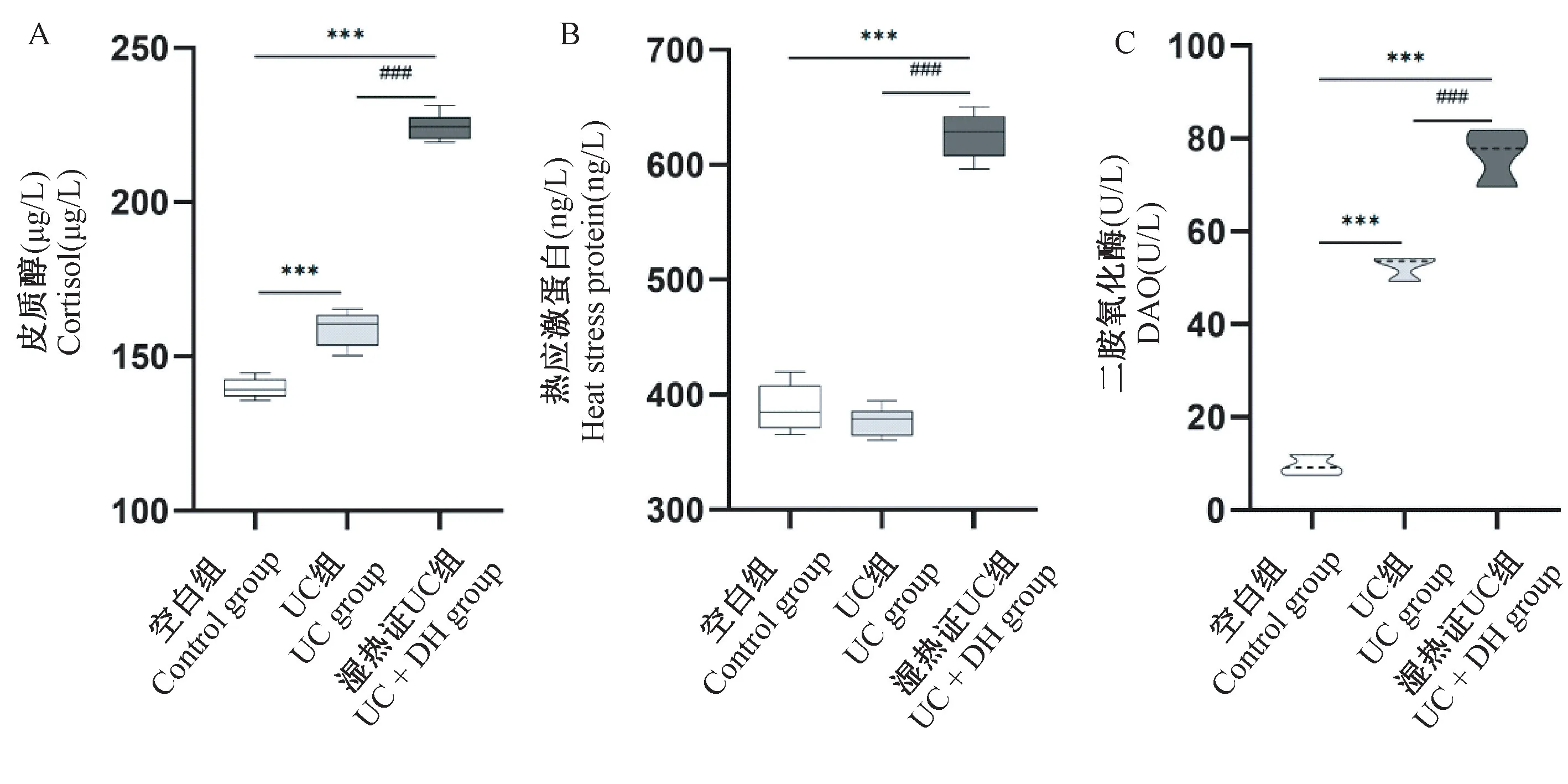
图7 大鼠血清皮质醇、DAO浓度和结肠热应激蛋白表达情况Figure 7 Serum cortisol and diamine oxidase concentrations and colonic heat stress protein expression in rats
2.7 结肠氧化应激反应及抗氧化能力结果
经DSS诱导后,与空白组相比,UC组和UC+DH组大鼠的MPO、MDA含量显著升高(P<0.001),结肠中的GSH含量显著降低(P<0.001),说明DSS能导致机体的脂质过氧化,降低大鼠抗氧化能力;与UC组大鼠相比,UC+DH组的MPO、MDA含量进一步增加(P<0.001)(图8A、B),结肠中的GSH含量进一步降低(P<0.01)(图8C),说明湿热因素能协同DSS过度激活氧化应激反应,抑制机体抗氧化能力。
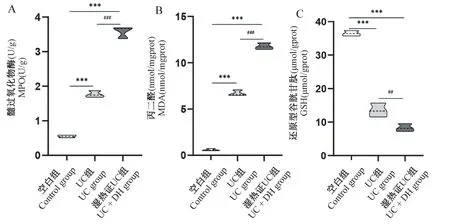
图8 各组大鼠氧化应激反应及抗氧化能力Figure 8 Oxidative stress reaction and antioxidant capacity of rats in each group
2.8 结肠炎症细胞因子的水平
与空白组相比,UC组和UC+DH组大鼠的TNF-α、MIP-1α、MIP-1β 表 达 显 著 升 高(P<0.001),结肠中的IL-10含量显著降低(P<0.001),说明DSS具有促炎作用;与UC组大鼠相比,UC+DH组的TNF-α、MIP-1α、MIP-1β浓度进一步增加(P<0.01)(图9A、B、C),结肠中的IL-10含量进一步降低(P<0.001)(图9D),说明湿热因素能协同DSS加重肠道炎症程度。
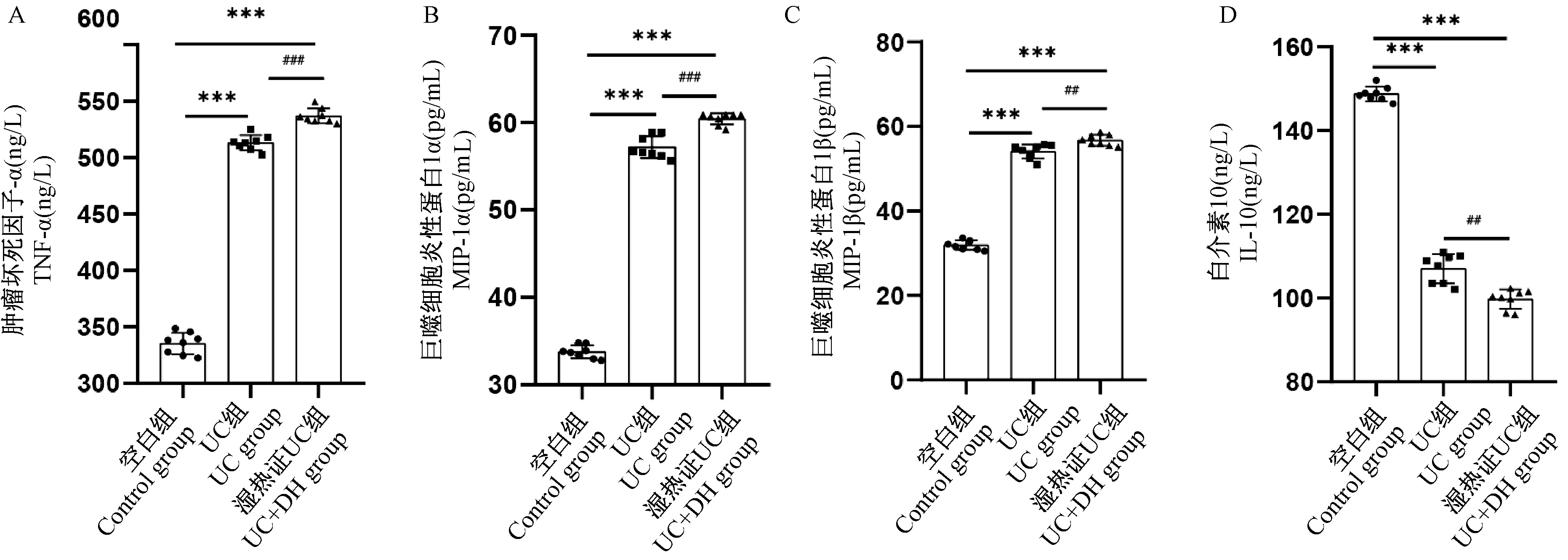
图9 大鼠细胞因子的表达情况Figure 9 Expression of cytokines in rats
3 讨论
中医将溃疡性结肠炎归属于“痢疾”“久痢”和“肠澼”等病范畴[4,13]。UC表现为血性腹泻、腹痛、黏液性脓便、里急后重、体重减轻等,这些症状可导致患者身体状况和心理的衰弱,并加重全球经济负担[14]。伴随UC确诊而来的是患结直肠癌及手术切除、术后并发症和UC肠外并发症(肝胆疾病、骨质疏松、关节炎、皮肤病等)的风险,数据表明,DSS与DSS协同湿热因素可引起不同程度的肝功能损伤和肠黏膜损伤,其中DSS协同湿热因素给机体造成的损伤尤为严重。
DAO是一种催化二胺氧化的细胞内酶,位于肠黏膜上层绒毛膜上皮细胞的胞质中,与肠黏膜内的核酸和蛋白质合成密切相关。DAO大部分来源于肠黏膜,正常状态下血清中的含量极少,当肠上皮细胞破损时,肠黏膜中的DAO经受损部位入血,因此血清DAO水平可作为肠黏膜损伤的理想指标,可作为IBD的主要诊断指标[15-16]。本研究中两种模型大鼠的血清DAO含量升高的结果也支持了这一理论。热应激引起肉鸡肠道屏障功能紊乱并提高肠道通透性,导致血清DAO水平升高[17]。在本研究中,湿热证UC大鼠的血清DAO远高于UC大鼠的水平,可能与湿热证UC大鼠受到的湿热刺激有关,说明湿热应激和UC在促炎和损伤肠屏障方面可能具有协同作用,具体机制需要进一步的研究证明。
在本研究中,发现UC模型大鼠与湿热证UC模型大鼠最明显的区别在于血脂和热应激蛋白的表达水平差异。通过复合因素“高脂高糖饮食+饮酒+饥饱交替+高温高湿环境+5%DSS”构建的湿热证UC大鼠表现出高脂血症和热应激反应。与前人报道一致[18],本研究中湿热证UC大鼠血清中的TG、CHOL、LDL_C、GLU水平显著高于普通环境下的UC大鼠(P<0.05),且血清中的HDL_C低于普通环境饲养的UC大鼠(P<0.05),说明实验周期内的高脂高糖酗酒的饮食习惯配合高温高湿的生活环境,能成功打造高血脂症状的大鼠,高脂血症可能是湿热证潜在的生物基础之一。热休克蛋白(HSPs)的诱导被称为热休克反应(HSR)。HSR在细胞防御系统中起着关键作用,在该系统中,HSP充当蛋白质伴侣,觉察到氧化损伤并修复未折叠或折叠错误的蛋白质,保护细胞免受应激诱导的伤害,有助于提高预处理刺激后产生的细胞存活率[19]。HSPs是细胞内高度保守的蛋白,在应激条件下可以存在于细胞外液中。实验数据也表明湿热应激能增加大鼠结肠组织中的HSPs表达。HSP参与了多种信号传导途径,包括氧化应激途径[20]。Dangi等[21]认为HSPs的高峰表达是山羊长期热应激期间的一种适应机制,抗氧化剂可能会通过降低氧化应激而减弱HSPs表达。因此检测了结肠中的MPO、MDA、GSH浓度的变化。
既往研究表明,肠道黏膜损伤的关键因素之一是氧化-抗氧化失衡[22]。氧化应激反应过度激活可以抑制抗氧化酶,促进结肠细胞中活性氧增多,活性氧本身具有细胞毒性,引起蛋白质变性和酶激素失活。同时活性氧可使不饱和脂肪酸发生脂质过氧化反应,造成生物膜损伤。MPO是一种存在中性粒细胞中的酶,活性大小与炎症区域中的中性粒细胞浓度成正比,MPO活性增加是嗜中性粒细胞浸润和炎症的指标[23]。因此,MPO活性的测量被认为是急性肠道炎症的定量和灵敏测定法。MDA可以通过蛋白质变性交联作用影响膜蛋白,使其无法用作受体或酶,它是脂质过氧化的标志物[24-25],本研究中MPO、MDA活性的增加与结肠肠上皮层的大量丧失、浆膜炎性细胞浸润、黏膜下层水肿、出血、坏死性溃疡的出现有关。ROS的清除主要依靠体内的抗氧化酶完成,数据表明湿热因素协同DSS共同抑制了结肠组织中的GSH活性,导致过量的ROS堆积,生物氧化失衡,从而加重湿热证UC的氧化应激反应。
目前普遍认为,UC机体存在肠黏膜炎症免疫耐受紊乱,肠黏膜免疫反应异常激活是UC发生、发展的重要因素。1988年Wolpe等[26]采用脂多糖刺激小鼠后,从小鼠巨噬细胞中分化得到炎性蛋白MIP-1。这种趋化性细胞因子在内毒素血症、氧化应激反应、炎症反应中具有广泛的生物学活性,能触发中性粒细胞产生过氧化氢,协同其他活性氧,过度激活氧化应激反应;同时MIP-1α可特异性地趋化单核细胞、巨噬细胞、淋巴细胞、中性粒细胞增殖并向炎症部位迁移,诱导其释放TNF-α、IL-6、IL-1等炎症因子[27],具有潜在的促炎作用。有学者发现在严重发炎的肠粘膜中,表达MIP-1α和MIP-1β的细胞频率明显高于对照组[28]。在IBD中,抗原呈递给抗原呈递细胞(APC)以及APC与T辅助细胞的相互作用导致巨噬细胞的活化。活化的巨噬细胞产生广泛活性的炎性细胞因子的混合物,包括TNFα、IL-1β,它们通过NF-kB途径进一步增强炎症反应,从而导致各种白介素以及细胞因子和趋化因子的上调[29-30]。在本研究中,推测DSS协同湿热因素通过TNF-α将循环血中炎症细胞募集至局部组织,诱导肠黏膜循环障碍,与MIP-1α和MIP-1β协同放大炎症效应,破坏肠上皮固有层,诱导肠黏膜局部溃疡,可导致UC的发生。
肠道中IL-10的主要来源是调节性T(Treg)细胞,IL-10可控制肠道中微生物和食物抗原的慢性刺激并保持免疫系统平衡[31]。因此被认为是人类最重要的抗炎细胞因子之一,IL-10可以限制促炎性细胞因子如TNF-α、IL-1、IL-6、IL-12的分泌,防止对肠内稳态重要的Th1/Th17致病反应[32-33]。近日的一项研究表明,IBD中的抗TNF治疗通过巨噬细胞IL-10信号传导发挥治疗作用[34]。反之,IL-10或其信号通路中降低或消除其抗炎特性的突变被认为参与了高炎症性疾病的发病机制,如炎症性肠病[35]。本研究中发现两种环境下的UC大鼠结肠中的IL-10活性下降,与前述研究一致。Kühn等[36]在1993年开发IL-10缺陷(IL-10-/-)小鼠模型,显示出与人IBD相似的组织学、生理学和生化特征。在IL-10-/-的情况下,幼稚T细胞分化为Th1或Th17以及增加引起自发性结肠炎的炎性细胞因子的产生[37],另一项研究评估了IL-10-/-BALBC小鼠12周龄时自发性结肠炎的预期发生率约为69%[38]。上述研究提供了可能的推理,湿热环境协同DSS干预IL-10的信号传导,加重肠道炎症。
综上所述,UC与湿热UC模型既有区别又存在联系,区别在于仅湿热证UC模型存在高脂血症与热应激反应;联系在于湿热证UC模型的脏器损伤(肝、肠)严重程度高于UC模型,尤其是肠黏膜损伤。湿热能加重UC的肠黏膜损伤,可能与湿热促炎、促进脂质过氧化、抑制抗氧化、提高肠黏膜渗透性有关。相比经DSS诱导的普通UC大鼠模型,本研究通过复合因素构建的湿热证UC模型更切合岭南地区湿热证UC患者实际,一定程度上为湿热体质人群的UC辨证与防治提供参考。
