不同时间电针干预痛厌恶大鼠焦虑行为的前扣带皮层机制研究
2021-07-23沈科展吴学文何淑峥孙鑫周之东朱雨鑫陈扬方剑乔房军帆杜俊英
沈科展,吴学文,何淑峥,孙鑫,周之东,朱雨鑫,陈扬,方剑乔,房军帆,杜俊英
(浙江中医药大学第三临床医学院康复医学院 浙江省针灸神经病学研究重点实验室,杭州 310053)
疼痛是实际或潜在组织损伤相关的一种不愉悦的感觉和情感体验[1]。据流行病学统计,慢性痛在某些不发达地区的发病率高达76%[2],其中,50%伴发痛情绪[3]。慢性痛引发的焦虑、抑郁、厌恶等情绪,长期甚至终生折磨患者[4-5]。其中痛厌恶情绪可产生过度警觉,易激惹性增高,极力回避疼痛事件的再现等病理行为,常并发创伤后应激障碍(post-traumatic stress disorder,PTSD)等心理问题[6-7],严重降低生活质量。目前临床上对焦虑、抑郁的治疗仍主要依赖药物,但长期应用不良反应显著[8],探寻低毒高效的治疗方法缓解慢性痛和调节痛情绪已成为现代医学神经与镇痛领域的前沿问题。
电针作为一种安全有效镇痛、抗焦虑的常用疗法[9-10],具有潜在优势。临床研究表明其对慢性痛,疼痛记忆引发的痛感觉及痛情绪的调节效佳[11-12]。前期实验观察到电针对痛厌恶大鼠的焦虑情绪行为具有良好的调节作用且其与前扣带皮层(anterior cingulate cortex,ACC)水平的神经肽S/神经肽S受体系统相关[13]。ACC是疼痛以及痛情绪信息传导与调控的关键脑区[14-15],ACC内N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)和γ-氨基丁酸(γaminobutyric acid,GABA)含量及其受体的表达与慢性痛的缓解相关[16-17]。据研究,提前介入电针治疗对疼痛具有良好的干预作用[18]。但是不同时间点电针干预对痛厌恶大鼠的焦虑行为及机制是否一致尚无相关报道。基于此,本研究通过建立完全弗氏佐剂诱导的条件位置回避(complete Freund’s adjuvant induced conditioned place avoidance,CCPA)痛厌恶大鼠模型,于造模前后进行电针干预,观察其对痛厌恶大鼠的疼痛、焦虑情绪行为及ACC内NMDAR和GABAR的调节作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
32只6~7周清洁级健康雄性成年SD大鼠,体重(220±10)g,购自中国科学院上海实验动物中心【SCXK(沪)2018-0006】,饲养于浙江中医药大学动物实验中心【SYXK(浙)2018-0012】,维持适宜的室温(22~26℃)和湿度(60%),环境安静,通风良好,昼夜各半循环光照,给予标准饲料及自由饮水。本实验所有操作均符合中华人民共和国《实验动物管理条例》。所有动物实验操作(见图1)均经过浙江中医大学实验动物伦理委员会许可(伦理审批号为:IACUC-20180319-12)。

图1 实验流程图Figure 1 Experimental flow chart
通过随机数字表法将大鼠完全随机分为4组:空白(NS)组(n=8)、模型(C-CPA)组(n=8)、常规电针(EA1)组(n=8)、预电针(EA2)组(n=8),每笼4只进行饲养。
1.1.2 主要试剂与仪器
完全弗氏佐剂(complete Freund’s adjuvant,CFA)(美国Sigma公司),75%医用消毒乙醇(杭州欧拓普生物技术有限公司),von Frey纤维丝测痛仪(美国Stoelting公司),韩式HANS-200 A穴位神经刺激仪(南京济生医疗科技有限公司),高架O迷宫(elevated zero maze,EZM)、旷场(open field,OF)(瑞沃德生命科技有限公司),Smart 3.0分析软件(美国Panlab公司),兔抗大鼠GABAAR、GABABR抗体、兔抗大鼠NR2A、NR2B抗体(美国Abcam公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的驴抗兔二抗(美国Abcam公司),HRP标记的βactin抗体(美国Cell Signaling Technology公司),全能台式高速冷冻离心机(美国Thermo Scientific公司),电泳-转印系统(美国Bio-Rad公司),lmage Quant LAS4000型凝胶成像系统(德国GE公司)。
1.2 方法
1.2.1 建立C-CPA痛厌恶模型
如图2所示,参照Wu等[19]方法,CPA为黑色的不透光长盒,中央被黑色活动挡板等分成30 cm×30 cm×30 cm的A、B两区。A区、B区分别在四面贴有间隔一致的三角形和圆形白色图案,分别涂抹5%醋酸和肉桂油。条件化前(pre-conditioning day):将挡板取出,连通两区,放入大鼠使其自由活动,30 s适应期后记录10 min内大鼠在两区的停留时长,剔除对某区有偏好(停留时间≥7 min)的大鼠。随机定义一区为“痛环境”区,另一区为“非痛环境”区。条件化(conditioning day):挡板插入分隔两区,将大鼠放入“非痛环境”区45 min,之后放回饲养笼。2 h后C-CPA组、EA1组和EA2组大鼠左足底皮下注射0.1 mL CFA,NS组在相同部位注射0.1 mL生理盐水(normal saline,NS)。6 h后将各大鼠放入“痛环境”区45 min,之后放回饲养笼。条件化后(post-conditioning day):与条件化前相同操作,记录10 min内大鼠在两区的停留时长。若在“痛环境”区的停留时长较条件化前明显减少,则C-CPA痛厌恶模型建立成功。用大鼠条件化后“痛环境”区的停留时长减去条件化前在该区的停留时长所得差值为回避分数(CPA score)。每次实验后,用10%乙醇擦拭,清除排泄物,以消除前1只大鼠遗留的气味。

图2 C-CPA痛厌恶模型建立图Figure 2 Establishment of C-CPA pain aversion model chart
1.2.2 电针干预
EA1组:建立C-CPA模型后开始介入电针,将大鼠放置于特定的黑色布袋中,充分暴露双下肢,用华佗牌0.18 mm×13 mm毫针刺入大鼠双侧“后三里穴”(膝关节后外侧,在腓骨头下约5 mm处)、“昆仑穴”(后肢外踝与跟腱之间的凹陷中),韩式电针仪器连接。参照温存等[20]干预参数:2/100 Hz疏密波,强度先为0.5 mA,每10 min增加0.5 mA,共30 min,1次/日。
EA2组:造模前3 d开始介入,模后操作、取穴和干预参数同EA1组。
1.2.3 机械缩足阈(paw withdrawal thresholds,PWTs)
采用Chaplan等[21]建立的Up-Down方法测定大鼠的机械缩足阈(PWTs)。保持环境安静,室温23℃左右。大鼠置于测痛架上适应约30 min,待大鼠安静后,采用von Frey纤维丝(0.4、0.6、1.0、2.0、4.0、6.0、8.0、15.0、26.0 g)垂直刺向大鼠左后足掌底中部皮肤(避开足垫),刺激时纤维丝弯曲成S形并保持6~8 s。从4.0 g刺激强度开始,若大鼠出现缩足、舔足或逃逸等阳性反应时,记录“X”,换相邻小一级纤维丝刺激;若大鼠未出现阳性反应时,记录“O”,换相邻大一级纤维丝刺激。第1次“O”和“X”交替出现后,再刺激4次,得到一串含“O”和“X”的序列。通过公式PWTs(g)=(10[xf+κδ])/10000计算大鼠的机械缩足阈(xf为最后一个有效符号所在的von Frey纤维丝上的log值,κ为阴性或阳性反映符号排列所代表的值,δ为所有刺激强度log均差,实验中为0.231)。若所得序列为“OOOOO”或计算值≥26 g,则记为26 g;若所得序列为“XXXXX”或计算值≤0.4 g,则记为0.4 g。
1.2.4 高架O迷宫实验(elevated zero maze,EZM)
参照温存等[20]方法,将待测大鼠放入实验室中适应30 min,室温23℃左右。开始测试时,将大鼠头部面向开放臂迅速轻置于闭合臂与开放臂交界处。适应30 s后,应用Smart 3.0分析软件记录并统计大鼠5 min内“开放臂运动距离”、“开放臂停留时间”、“开放臂进入次数”和“总运动距离”。每次测试后,用10%乙醇擦拭高架O迷宫,清除大鼠残留的排泄物和气味,干燥后进行下一次实验。
1.2.5 旷场实验(open field,OF)
环境要求、适应条件同高架O迷宫实验。开始测试时,将大鼠快速轻置于旷场实验箱正中区域。应用Smart 3.0记录并分统计大鼠5 min内“中央区运动距离”、“中央区停留时间”、“中央区进入次数”、“总运动距离”。每次测试后,清理排泄物、去除气味、干燥等同高架O迷宫实验。
1.2.6 免疫印迹(Western Blot)
行为学结束后以4%的异氟烷麻醉大鼠,剖开胸腹暴露心脏,用灌注针从左心房穿入升主动脉,剪开右心耳,快速灌注4℃生理盐水每只200 mL,快速开颅取出全脑,按照Paxinons&Watson的大鼠脑立体定位图谱(第六版)获取左侧ACC核团,经液氮后,置于-80℃保存。ACC中加入裂解液100μL(RIPA:PMSF:磷酸酶抑制剂=98∶1:1配置混合液),冰上剪碎,超声粉碎仪(每次3 s,间隔12 s,6次)粉碎。14 000 r/min 4℃离心5 min,吸取上清液,用BCA法测浓度,1∶1加入2×SDS-PAGE上样缓冲液,蛋白变性(煮沸10 min)。15μg蛋白上样,SDS-聚丙烯酰胺凝胶电泳分离蛋白,湿转至PVDF膜。5%脱脂奶粉封闭1 h,兔抗大鼠β-actin(1∶5000),GABAAR(1∶5000),GABABR(1∶1000),NR2A(1∶1000),NR2B(1∶1000)的一抗置于4℃冰箱孵育过夜约16~18 h,TBST缓冲液清洗3次,每次10 min。室温孵育HRP标记的驴抗兔二抗(1∶5000)2 h,TBST缓冲液清洗3次同上。以βactin作为内参,ECL发光试剂显色,lmage Quant LAS4000凝胶成像系统拍摄,Image J软件测量灰度值,将目的蛋白与β-actin灰度值的比值归一化处理。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析,数据以平均值±标准差(±s)表示。两组前后比较采用配对样本t检验,多组间比较采用单因素方差分析(One-way ANOVA)。若呈正态分布且方差齐,则组间两两比较采用S-N-K法;若不符合,采用Dunnett’s T3法。以P<0.05表示差异具有统计学意义,用GraphPad Prism 7.0软件绘制统计图。
2 结果
2.1 C-CPA痛厌恶模型的建立
如图3所示,NS组大鼠造模前后,“痛环境”中停留时间无明显变化,C-CPA组、EA1组和EA2组大鼠造模后在“痛环境”中停留时间显著减少(P<0.01)。与NS组比较,C-CPA组、EA1组和EA2组大鼠的CPA scores明显减少(P<0.01),且三组之间无显著差异(P>0.05)。结果表明C-CPA痛厌恶模型成功建立。
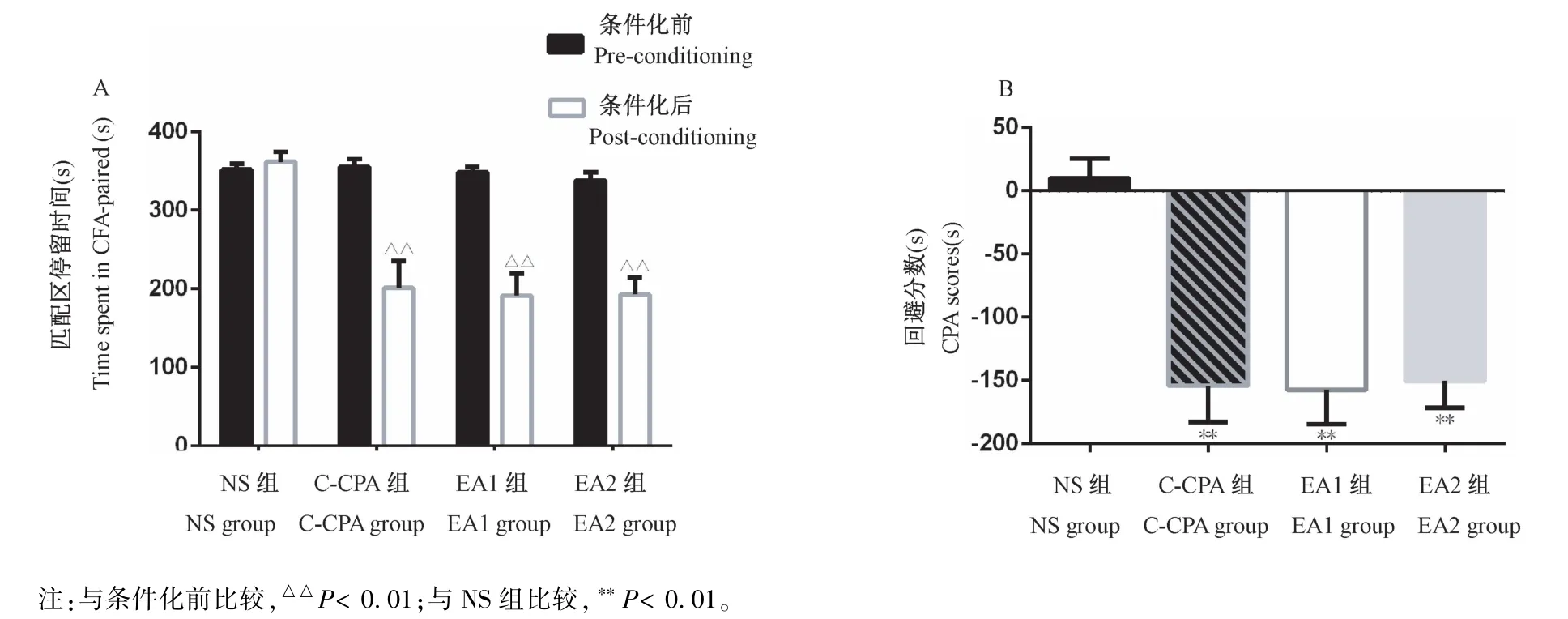
图3 CFA诱导的大鼠条件位置逃避反应Note.Compared with pre-conditioning day,△△P<0.01.Compared with NSgroup,**P<0.01.Figure 3 CFA-induced conditioned place avoidance response of rats
2.2 各组大鼠PWTs变化情况
如图4所示,模前第5天,四组大鼠基础PWTs均无差异(P>0.05)。造模后第2天,与NS组比较,C-CPA组、EA1组和EA2组大鼠患侧PWTs显著降低(P<0.01);与C-CPA组比较,EA1组和EA2组大鼠患侧PWTs明显增加(P<0.01)且两组间相比无显著差异(P>0.05)。结果表明造模前后介入电针均可有效缓解C-CPA大鼠的疼痛。

图4 各组大鼠患侧PWTs变化情况Note.Compared with NSgroup,**P<0.01.Compared with C-CPA group,▲▲P<0.01.Figure 4 Changes of ipsilateral PWTs of rats in each group
2.3 各组大鼠焦虑行为变化情况
采用高架O迷宫观察大鼠的焦虑行为。如图5所示,对于开放臂运动距离,与NS组比,C-CPA组、EA1组、EA2组大鼠均显著减少(P<0.05);与CCPA组比,EA1组、EA2组均显著增加(P<0.05);EA1组与EA2组差异不明显(P>0.05)。对于开放臂停留时间和开放臂进入次数,与NS组比,C-CPA组大鼠均显著减少(P<0.05),EA1组、EA2组差异不明显(P>0.05);与C-CPA组比,EA1组、EA2组显著增加(P<0.05);EA1组与EA2组无显著差异(P>0.05)。对于总运动距离,与NS比,C-CPA组、EA1组和EA2组显著减少(P<0.05),且后三组组间两两比较无显著差异(P>0.05)。
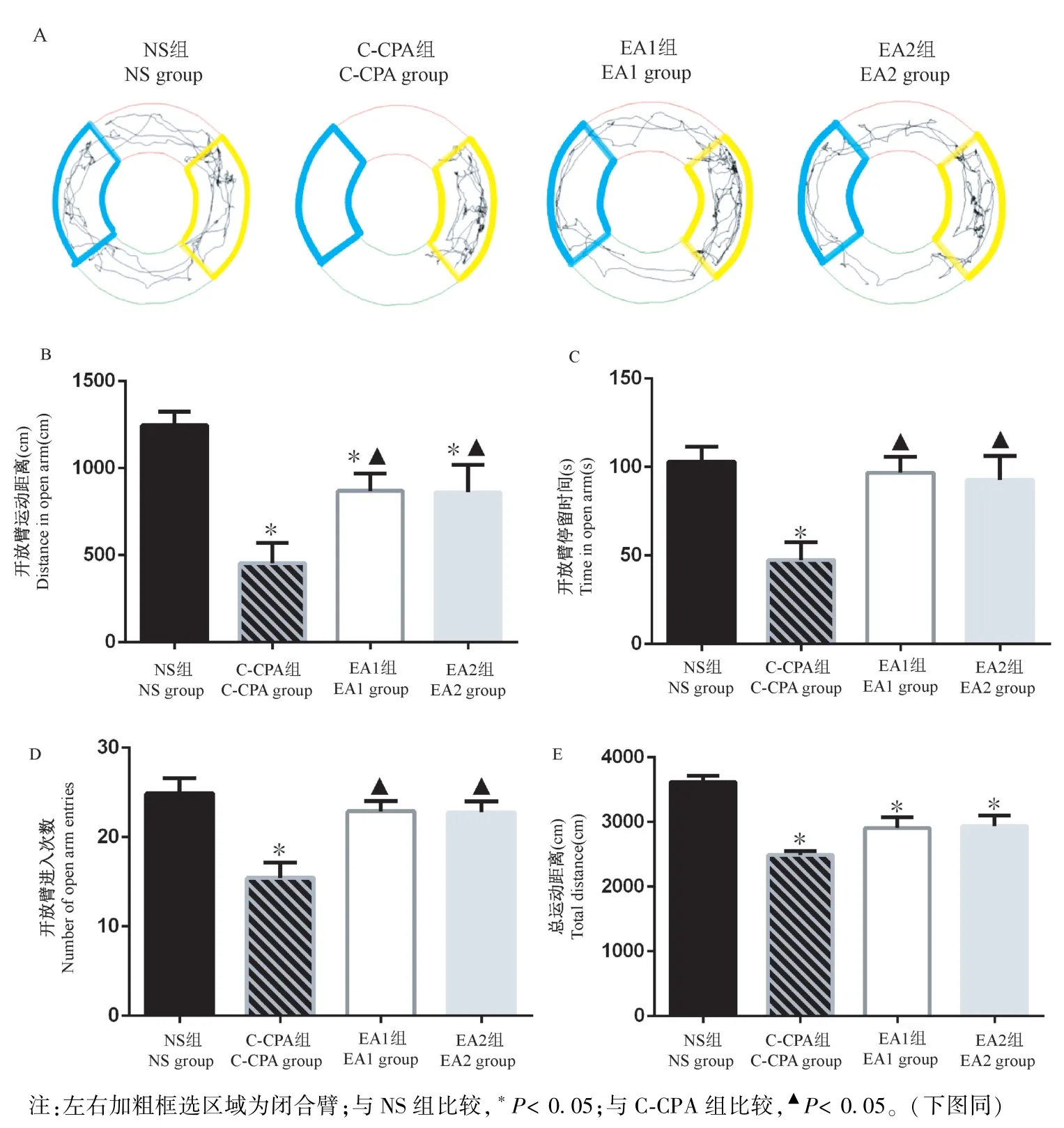
图5 各组大鼠O迷宫行为学变化情况Note.The left and right bold boxes are selected as closed arms.Compared with NS group,*P<0.05.Compared with C-CPA group,▲P<0.05.(The same in the following figures)Figure 5 Behavioral changes of elevated zero maze of rats in each group
同时采用旷场观察各组大鼠的焦虑行为。如图6所示,对于中央区运动距离、中央区停留时间、中央区进入次数和总运动距离,与NS组相比,C-CPA组大鼠均显著减少(P<0.05),EA1组、EA2组差异不显著(P>0.05)。与C-CPA组相比,EA1组、EA2组显著增加(P<0.05)。EA1组与EA2组相比无显著性差异(P>0.05)。结果表明不同时间介入电针均能有效缓解C-CPA大鼠的焦虑行为。

图6 各组大鼠旷场行为学变化情况Figure 6 Behavioral changes of open field of rats in each group
2.4 各组大鼠患侧ACC中NMDAR和GABAR总蛋白表达差异
如图7A、B所示,与NS组比较,C-CPA组、EA1组和EA2组大鼠患侧ACC脑区GABAAR总蛋白显著增加(P<0.05);与C-CPA组比较,EA1组无显著性差异(P>0.05),EA2组的GABAAR总蛋白明显减少(P<0.05);与EA1组比较,EA2组的GABAAR无显著性差异(P>0.05)。如图7C~H所示,各组患侧ACC中GABABR、NR2A、NR2B总蛋白含量组间两两比较无统计学意义(P>0.05)。结果表明预电针提高了C-CPA大鼠患侧ACC脑区GABAAR蛋白表达,效果优于模后电针,对GABABR、NR2A、NR2B总蛋白表达无明显影响。
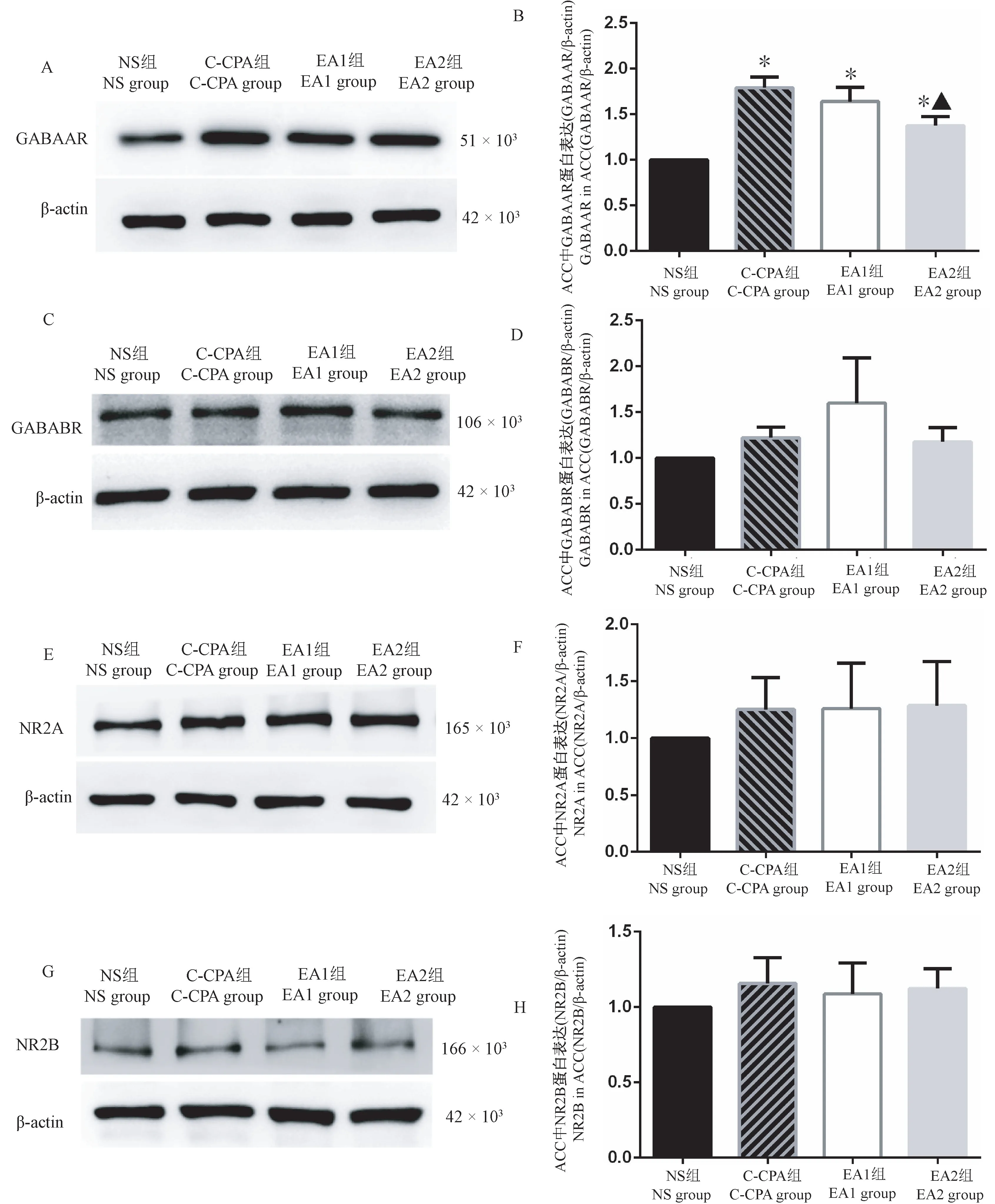
图7 各组大鼠患侧ACC中受体蛋白表达变化Figure 7 Protein expression changes of receptor in ipsilateral ACC in each group
3 讨论
慢性痛产生持久的疼痛记忆难以消除,易表现为厌恶、逃避、焦虑等痛情绪[22]。电针通过调节神经-免疫-内分泌系统发挥镇痛、调节情绪等疗效[23]。研究报道预电针比常规电针的镇痛效应更显著[18],同时,预电针对长期应激所致的焦虑行为缓解显著[24]。但相比于常规电针,预电针对于痛情绪的调节是否更具优势,其作用机制与常规电针是否存在差异,目前尚无报道。基于此,采用预电针和常规电针干预痛情绪大鼠,比较并探究疗效差异及相关分子机制。
目前已有多种痛情绪模型研究其发生、发展机制,如福尔马林(formalin)诱导的条件位置回避(formalin-induced conditioned place avoidance,FCPA)痛厌恶模型[14]、足电击诱导的条件位置回避(electric foot-shock conditioned place avoidance,S-CPA)恐惧模型[25]、利血平(reserpine)诱导痛抑郁大鼠模型[26]。选用足底注射CFA诱导条件位置逃避建立C-CPA痛厌恶模型,其优势在于足底注射CFA短期即可出现红肿热痛等现象[27];相较于福尔马林,无吸入毒性,无臭无味,避免与肉桂油、醋酸等气味混杂;而S-CPA模型的条件性位置回避并非疼痛引发,可能更多的与恐惧和电击不适感相关[25];另外,相比于利血平诱导的痛抑郁模型[28],C-CPA模型涵盖焦虑、抑郁、厌恶等多类痛情绪[19,29]。本次实验中,成功建立C-CPA模型,与马洋等[30]研究结果相似。电针缓解CFA所致慢性痛的报道众多[31-32],本实验也观察到了电针对C-CPA大鼠具有良好的镇痛作用,与课题组既往研究结果[33-34]类似。赵宇等[18]发现2 h内仅进行预电针比模后电针的镇痛效果更显著。结果提示EA1与EA2组电针后PWTs无明显差异,以上差异可能与造模方式、测量时间不同有关。
高架O迷宫(EZM)和旷场(OF)是经典情绪行为学检测工具,其基于啮齿类动物本能地回避在无臂保护的高架与中央空旷地带活动,趋向于相对封闭、狭小的安全区或角落的特性来测量大鼠的焦虑情绪行为[35]。邵芳冰等[34]发现注射CFA的大鼠在EZM的开放臂或OF的中央区运动距离、进入次数、停留时间均减少。佘丽娇[36]发现电针治疗CFA致痛的大鼠在EZM开放臂进入次数显著增加。任泽琴等[37],吕竹青[38]发现电针显著改善了抑郁等病态情绪大鼠在OF中的焦虑行为。Wu等[26]发现100 Hz电针对reserpine注射大鼠在EZM、OF中原有的焦虑样行为有显著缓解,也观察到类似的结果,如电针后C-CPA模型大鼠在EZM开放臂和OF中央区的运动距离、停留时间和进入次数均减少。同时,比较观察了不同时期电针干预对C-CPA大鼠的焦虑行为差异,结果提示EA1组和EA2组均能改善C-CPA大鼠的焦虑情绪行为,这与Zhou等[24]发现预电针同样能显著缓解PTSD大鼠焦虑行为的结果一致。
前扣带皮层(ACC)属于边缘系统,是痛感觉与痛情感控制的关键皮质区域[25],ACC的过度兴奋与慢性炎性痛和情绪行为的关系已得到充分证明[14,39-40]。ACC含大量以谷氨酸为代表的兴奋性氨基酸和以γ-氨基丁酸为代表的抑制性氨基酸及各自受体[41-42]。这两种主要的氨基酸神经递质的平衡决定了中枢神经系统的生理稳态,防止产生焦虑等病态情绪[43]。
NMDAR是谷氨酸受体之一[44],其中NR2A、NR2B两种受体参与疼痛与痛情绪信号传递[45]。如任文华[46]发现炎性痛等有害刺激可诱导大鼠ACC内NR2A和NR2B的表达,激活NR1中的Gly位点,通过细胞外信号调节激酶-环腺苷酸反应元件结合蛋白信号通路形成痛情绪。另有文献报道[45],利血平诱导的炎性痛大鼠ACC中NR2A和NR2B的表达量增加,与特殊的情境(如CPA)搭配时会产生痛厌恶情绪。而在CFA诱导的炎性痛小鼠中,仅观察到ACC水平NR2B的表达增多,但对NR2A的表达不影响[47]。在本次实验中,观察到,C-CPA模型大鼠相较于NS组,其ACC中NR2A和NR2B蛋白表达相较均无明显变化。因此,猜测,ACC水平的NR2A和NR2B未参与C-CPA大鼠模型的疼痛和痛情绪的调节。已有研究观察到,电针治疗Wistar大鼠肠易激综合征所致腹痛效佳,且不同穴位的电针都能减少大鼠ACC中NR2A的表达,但对NR2B的表达无明显效果或表现出减少[48]。EA1组和EA2组大鼠ACC中NR2A和NR2B蛋白表达相较于C-CPA组,均无明显变化,猜测NR2A和NR2B不参与C-CPA大鼠模型的疼痛和痛情绪的调节,因此电针干预对其表达也未起到调节作用。
GABA是一种重要的抑制性神经递质,其介导突触前抑制和突触后抑制效应需与神经元细胞膜上GABA受体结合[49],目前主要有3类GABA受体:GABAAR、GABABR 和 GABACR,其 中GABAAR、GABABR与疼痛、焦虑抑郁等情绪关系密切[32,50-51]。已有研究观察到,在神经病理痛诱导的痛情绪大鼠模型中,杏仁核内GABAAR和GABABR的基因及蛋白表达减少,电针干预可上调两者的基因及蛋白表达[52]。在CFA诱导的慢性炎性痛大鼠模型中,可观察到下丘脑和ACC脑区GABAAR的mRNA表达无显著变化,且电针干预对其表达无影响[53]。本次研究观察到C-CPA大鼠患侧ACC脑区GABAAR的蛋白表达显著增加,GABABR无显著变化;EA2组ACC脑区GABAAR的蛋白表达减少,EA1组无明显变化。因此,认为ACC脑区GABAAR蛋白的高表达是C-CPA模型疼痛和痛情绪产生的主要原因之一。提前介入电针通过下调GABAAR蛋白的高表达起到镇痛和抗痛情绪的作用,常规电针对C-CPA模型的疼痛和痛情绪的调控机制可能与ACC脑区内GABAAR蛋白的表达无关,其具体机制还需进一步研究。
综上,通过建立痛厌恶模型,观察经典的疼痛和情绪行为,发现不同时间介入电针干预均能有效改善痛厌恶模型大鼠的疼痛和焦虑情绪行为。其中预电针的疗效可能与调控ACC脑区GABAAR蛋白表达相关,这可能是电针干预痛情绪的中枢机制之一。
