阿尔茨海默病的纳米疗法研究进展*
2021-07-13王晓珍
王晓珍,李 泽,王 蓉,3**
1 首都医科大学宣武医院 中心实验室,北京 100053;2 北京市老年病医疗研究中心,北京 100053;3 北京脑重大疾病研究院,北京 100053;4 首都医科大学附属友谊医院 药剂科,北京 100053
研究表明[1],我国2015 年的AD 患者人均年花费近两万美元,预计到2030 年,我国AD 的经济负担将达2.54 亿美元,2050 年将达到9.12 亿美元。AD 在发病的5~10 年内是渐进的,同时也具有致死性[2]。AD 是多因素的复杂疾病,发病机制尚不明确,治疗的策略集中在缓解症状上,这意味着AD被视为一种无法解决的神经退化性疾病。血脑屏障(BBB)是血液循环与中枢神经系统之间的生物屏障,可以控制血脑两侧的物质转运,保证中枢神经组织内环境的相对稳定。传统上用于中枢神经系统的药物存在不能有效穿过血脑屏障的局限性;但当纳米载体用于AD 靶向给药时可以克服该局限。纳米技术的应用为神经退行性疾病的治疗提供了另一种策略。本文综述了AD 的发病假说和近年来纳米(NMs)在治疗AD 方面的进展。
传统AD 药物的有效性取决于几个生理因素[3],即BBB和P-糖蛋白对药物的影响,这些都限制了药物到达中枢神经系统(Central nervous system,CNS)的能力。近年来新型纳米释药系统的研究正成为治疗多种疾病的新方向[4,5]。在纳米颗粒(Nanoparticles,NPs(1~100 nm))的制备上,纳米技术使用的工程材料与设备具有至关重要的作用,它由多种材料制成,如聚合物、脂质、核酸和金属有机化合物等,它在贮存期间或在体内均具有较好的稳定性。纳米颗粒有多种构建方法,如图1 所示[6]。
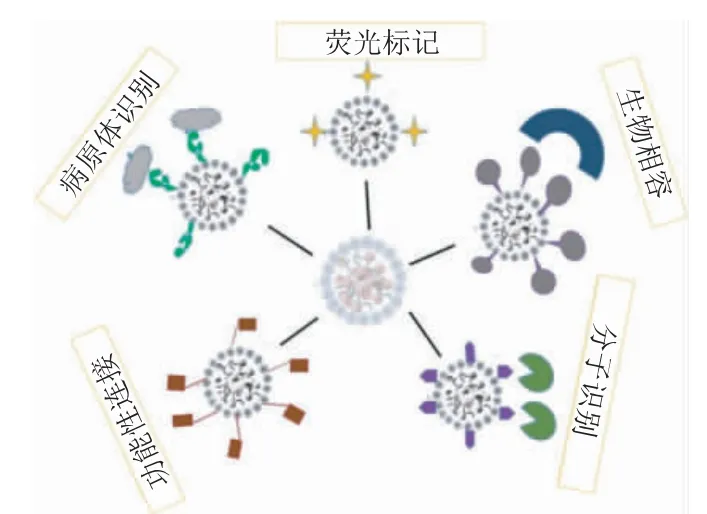
图1 构建纳米颗粒的不同方法
大量的纳米载体和NPs 前体药物在动物模型中的细胞毒性可以忽略不计,纳米释药系统还可以非侵入性地将药物递送至大脑,通过靶向给药可增强治疗AD 的各种药物、生物活性剂的生物利用度或生物有效性,NMs 在穿过BBB 治疗脑部疾病方面更是发挥着重要作用。
1 AD 发病机制假说
AD 的主要的病理特征为脑内β 淀粉样蛋白(amyloid β,Aβ)沉积以及神经细胞内神经元纤维缠结。由于具体发病机制及诱因并不明确,目前主要基于不同的发病机制假说进行AD 药物的研发,大多是用于延缓病情的发展而并不能彻底治愈患者。图2 为AD 的主要病理生理学过程,主要的发病机制有以下几种假说:
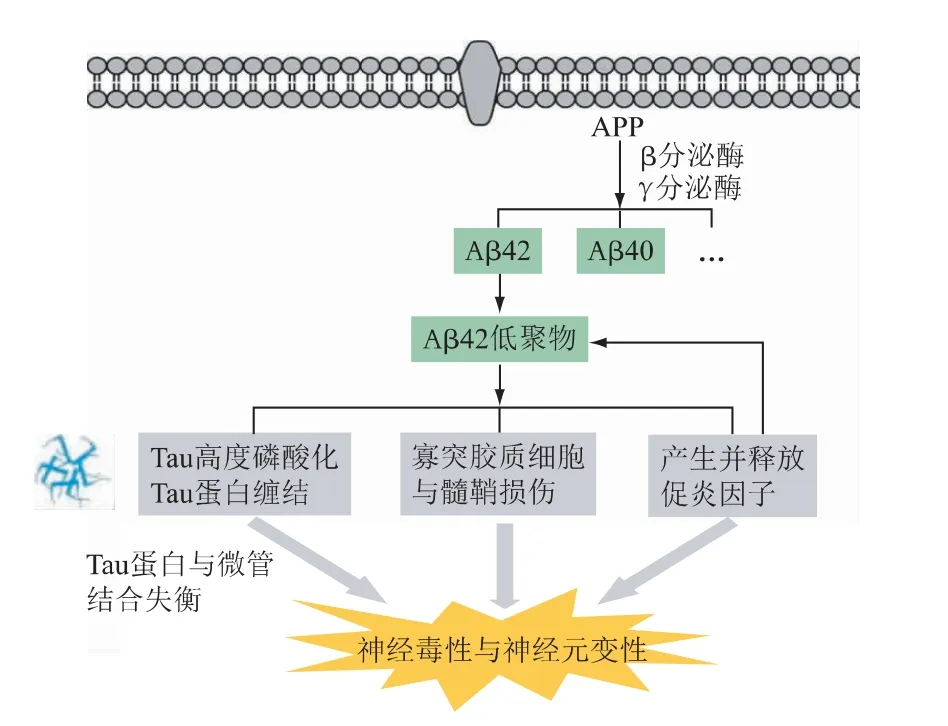
图2 AD 的主要病理生理学过程
1.1 Aβ
淀粉样前体蛋白(APP)是一种在各种组织中广泛存在、并集中表达于神经元突触部位的膜蛋白质,经分泌酶切割成不同的亚单位(如Aβ40 和Aβ42)。Aβ42 不溶于水,粘附在细胞表面,AD 患者脑内Aβ 的产生和消除失衡,过多的Aβ导致其他蛋白质与之凝聚或缠结,并彼此形成Aβ 斑块,从而杀死神经元[7]。
1.2 Tau 蛋白
Tau 蛋白是与负责轴突运输的微管有关,主要分布在脑部神经元轴突中。在正常情况下,Tau 蛋白的磷酸化和去磷酸化维持动态平衡,调节细胞骨架的稳定性,影响神经元的功能。在AD 患者中,Tau 蛋白过度磷酸化,构象发生变化,形成螺旋片段,产生神经纤维缠结,最终导致神经元死亡。目前发现的Tau 蛋白磷酸化位点至少有45 个,其中主要发生在丝氨酸残基和苏氨酸残基的羟基上。Tau 蛋白的磷酸化受一系列激酶的调节,包括蛋白激酶A、糖原合成酶激酶3β、酪氨酸激酶和细胞周期蛋白依赖激酶5 等[8]。研究表明,相比β-淀粉样蛋白的异常沉积,Tau 蛋白的异常磷酸化所致的聚集同AD 的相关性更高。
1.3 小胶质细胞
小胶质细胞是固有的免疫效应细胞,在中枢神经系统的生理过程和AD 发病过程中发挥着重要作用。有研究表明,小胶质细胞介导的炎症反应与AD 密切相关,AD 患者脑内海马区域附近有小胶质细胞聚集,引发炎症因子的大量释放,使神经毒性物质增加,炎症反应增强,导致Aβ 沉积,神经元损伤,加重了AD[9]。
1.4 其他
研究人员还提出其他几种AD 发病的假说:与胆碱能神经元的缺失相关,在AD 发病早期发现胆碱能神经元出现退化,认知功能损失,脑内乙酰胆碱水平下降[10];泛素化蛋白的堆积和聚集是许多神经退行性疾病的标志,AD 患者脑中的泛素-蛋白酶体功能障碍与Aβ 沉积、Tau 蛋白磷酸化等均密切相关[11];在金属离子假说中,AD 患者脑内的金属离子发生聚集,存在于Aβ 斑块中,参与其聚集并产生毒性作用[12]。此外,AD 的发生与氧化应激的增加也密切相关,氧化应激产物损伤细胞结构,导致细胞功能和活力受损[13]。
2 与AD 相关的纳米药物研究进展
以下扼要分述不同类型纳米药物及其主要特点,见表1。

表1 不同类型纳米药物及其特点
2.1 聚合物纳米粒子
聚合物纳米粒是将药物包载于载体材料骨架内或药物通过共价链接/吸附作用,修饰在载体材料的表面形成的纳米药物给药系统,其设计目的是防止药物降解和失活,并提高药物的生物利用度[14]。由于其稳定,易于制备,可与小分子药物结合,同时易于修饰配体,从而达到靶向作用。聚合物纳米粒被广泛合成并用于治疗实践[15]。
Kulkarni PV 等[16]开发了一种基于2-氰基丙烯酸正丁酯的脑靶向纳米多聚体系统,包载了放射性标记的淀粉样脂肪酸药物125I-氯碘喹啉(CQ,5-氯-7-碘-8-羟基喹啉),用于AD 的早期诊断,在小鼠模型中,负载的NPs 可有效地穿过了BBB,显著提高药物的生物利用度。Wilsin B 等[17]研究了壳聚糖NPs 与酒石酸卡巴拉汀在AD 治疗中的联合应用。通过乳化法制备了含有酒石酸卡巴拉汀的壳聚糖NPs(平均粒径为47nm±4 nm)。Zeta 电位分析表明,在壳聚糖纳米粒表面包覆聚山梨酯-80 可降低其正电荷,由(+32.6±0.9)mV 降至(+30.2±0.7)mV。观察到NPs 的药物释放呈双相、Fickian 扩散释放模式。此外,在NPs 表面涂上1%聚山梨酯-80 还可改变不同器官对NP 的摄取。
Jaruszewski KM 等[18]考虑到AD 中的Aβ 聚集,利用壳聚糖在BBB 中进行药物传递。设计的免疫载体将壳聚糖包被PLGA 纳米颗粒与新型抗Aβ 抗体相结合,结果表明,BBB 的摄取增强,体外对Aβ 有更好的靶向性。此外,壳聚糖在冻干过程中增强了免疫纳米载体的液体分散性和稳定性。这一特性表明其适用于神经疾病的可能性,特别适合AD 和帕金森病的治疗和作为诊断药物的载体。Zhang C 等[19]开发了一种双功能NPs 药物递送系统,该系统由聚乙二醇聚乳酸(PLA)聚合物与靶向肽TGN 肽和QSH 肽结合而成,分别针对BBB配体和Aβ1-42。这些核动力源有效而精确地靶向AD 小鼠大脑中的AD 病变部位,却没有引起其他的细胞毒性作用。
姜黄素是一种天然的植物化学物质,具有抗氧化、抗应激、自由基清除、抗炎和亲脂活性,在体内和体外都有可能结合Tau 蛋白[20,21]。姜黄素还可在极低浓度范围内显示出抗淀粉样蛋白的特性[22]。然而,姜黄素很容易在酸性和碱性条件下水解、氧化,因其溶解度小而生物利用度低[23]。研究表明,与游离姜黄素相比,含有姜黄素的聚(丁基)氰基丙烯酸酯(PBCA)NPs 显著提高了姜黄素在大脑中的半衰期和浓度[24]。
在一项Mulik RS[25]研究中发现,姜黄素修饰的载脂蛋白E3 配体修饰的PBCA NPs 表现出低密度脂蛋白受体介导的跨BBB 和跨SH-SY5Y 神经母细胞瘤细胞的转运。Shankar N 等[26]将姜黄素包封在可生物降解的聚乙二醇-聚乳酸聚乙醇酸共聚物(PEG-PLGA)纳米粒中,使其增加了水溶性,Aβ 水平降低约30%,抗氧化活性为90%,细胞活力提高20%以上。
2.2 脂质体
脂质体具有其非免疫原性、生物降解性、低毒性、流动性和生物相容性等特点[27]。脂质体的亲水性和疏水性部分,可以包封水溶性和脂溶性药物,以此来增加生物利用度。有研究表明,脂质体有助于药物穿过BBB,这也使得脂质体作为纳米载体用于治疗脑部疾病方面被广泛应用[28]。
Mourtas V 等[29]设计了含有姜黄素衍生物和BBB 转运介质[抗转铁蛋白抗体(TrF)]的多功能脂质体。对AD 患者死后大脑样本的解剖分析表明,含有姜黄素衍生物或姜黄素衍生物的抗TrF 的脂质体,对淀粉样沉积具有较高的敏感性。此外,姜黄素-聚乙二醇-脂质体的存在并没有降低大脑靶向能力。Ismail MF 等[30]制备的利伐斯的明脂质体可降低血糖C反应蛋白、同型半胱氨酸和不对称二甲基精氨酸水平,调节AChE 和Na+/K+ATP 酶活性的正常化。与利伐斯的明溶液相比,利伐斯的明脂质体增加了制剂的亲脂性和药物穿过BBB 的渗透性,对改善由AlCl3 诱导的大鼠空间记忆的恶化具有更好的效果。Chen ZL 等[31]采用药物靶向BBB 的常用配体转铁蛋白(Tf),通过PEG 与α-M 脂质体共价连接,得到的Tf-α-M 脂质体粒径小于200 nm,用于递送多酚占吨酮α-M。大鼠体内实验表明,Tf-α-M 脂质体脑部含量约是α-M溶液的1.5 倍。
2.3 固体脂质载体
脂质纳米粒(LNPs)和固体脂质纳米粒(SLNs)的开发,旨在克服各种胶体载体中某些局限性,如稳定性差,保质期短等缺点。LNPs 的开发已经实现了靶向给药,提高药物的物理稳定性并具有良好的药物释放性能[32]。Yusuf M 等[33]制备了一种含有胡椒碱的SLN 用于治疗AD,在AD 模型实验中显示,胡椒碱SLN 可以降低超氧化物歧化酶,使乙酰胆碱水解量降低,组织病理学显示,淀粉样斑块也有所减少。Dhawan S 等[34]将具有抗氧化活性的天然类黄酮化合物槲皮素,通过微乳液技术制备出了槲皮素SLN,该SLN 对氧化铝处理过大鼠的有害神经变性有逆转作用,可以显著提高槲皮素的抗氧化能力。
2.4 脂质/脂蛋白纳米颗粒
基于脂蛋白的纳米颗粒对Aβ 具有高度的亲和力,从而促进其降解,可用于诊断和治疗。该类纳米颗粒具有良好的载药能力,稳定性高,还可以降低药物的不良反应,是一类新型药物载体制剂。Song Q 等[35]为移除Aβ 设计了一种载脂蛋白E3-重组高密度脂蛋白(ApoE3-rHDL)纳米颗粒系统,小鼠经过ApoE3-rHDL 治疗后,Aβ 沉积、小胶质增生、神经系统变化和记忆缺失都有所减少,这表明ApoE3-rHDL 可能用于AD 的治疗。Meng F 等[36]用乳铁蛋白(Lf)修饰并加载姜黄素的新型低密度脂蛋白(LDL)纳米粒,用于治疗AD,可以有效地渗透BBB 并优先在脑中累积,实验证明,Lf 修饰的纳米结构脂质载体在控制与AD 相关损伤方面疗效更为优秀。Muntimadugu E 等[37]报道了含有白藜芦醇的葡萄皮和葡萄籽提取物抑制AD 患者的Aβ 聚集,将SLNs 与抗转移酶受体单克隆抗体(OX26)一起作为载体把生物活性提取物运送到体外的人体BBB 模型中,实验表明,在人脑内皮细胞上,OX26 SLN 的细胞摄取量显著高于非功能性SLN 和带有非特异性抗体的SLN。
2.5 金属基载体
最近开发的金属基纳米颗粒已被用作光敏剂药物的载体,并由磁响应载体或金作为载体组成,这类NPs 的稳定性和对组织(如癌组织)的渗透性都有所提高[38]。纳米金属制剂也被用于研究中枢神经系统药物的靶向给药。氧化铈(CeO2)纳米颗粒具有自由基清除、抗干扰和抗凋亡的活性,铈的各种价态(氧化还原状态)均具有自由基清除活性,可用于创造抗氧化微环境和促进脑细胞修复[39]的作用。有研究表明,尺寸小于5 nm 的CeO2NPs 通过其超氧化物歧化酶模拟和过氧化氢酶模拟其活性,通过氧原子的可逆结合和在其表面上的Ce3+(还原)和Ce4+(氧化)状态之间的转换,CeO2NPs 体现了强大的氧自由基清除能力[40]。TPP 是一种亲脂性阳离子,能够靶向线粒体,研究发现,合成的三苯基膦酸铈纳米粒子(TPP-Ceria NPs)在5XFAD 转基因AD 小鼠模型中,可以定位到线粒体并抑制神经元的死亡[41]。
有研究将超小型钆纳米粒子(AGuIX-NPs)与两个均包含KLVFF 序列(残基16-20)的肽段相连接,该肽段对应着Aβ的疏水核心,对形成β-片状结构有重要的影响,该片段还可与Aβ 相结合,从而影响其形成斑块[42]。此外,金纳米粒[43]、硒纳米粒[44]等金属载体NPs 在诊断和治疗AD 上也表现出优秀的活性。
2.6 其他几种典型的纳米递药策略在AD 治疗领域中的应用
富含褪黑素的NPs 在AD 诊断和治疗中的作用:褪黑激素是一种自由基清除剂,也可以保护生物体的细胞核DNA和膜脂免受氧化损伤,对年龄相关的神经性疾病(如AD)具有神经保护作用[45]。Schaffazick AR 等[46]通过纳米沉淀制备了负载褪黑素的NPs(纳米乳液、纳米胶囊和纳米球),用脂质体和微粒体作为脂质膜模型,实验结果显示,由于褪黑激素的存在,脂质体的抗氧化能力在8%~51%不等。其他类似的研究表明,褪黑激素NPs 与聚山梨酯结合可促进通过BBB,与游离褪黑素相比,这些NPs 可以靶向到小鼠大脑(额叶皮质和海马体)和肝脏[47]。血管活性肠神经保护肽(VIP)具有神经保护作用,还可以防止由Aβ 引起的细胞毒性相关的细胞死亡。研究表明,经鼻内注射VIP NPs 后,小鼠脑内肽的浓度大量增加[48]。
自组装纳米结构也具有一定优势,药物结构本身在水溶液中即可实现纳米尺寸的自组装,近些年发现的寡肽修饰的生物活性分子具有两亲性结构,在水溶液中形成的纳米物质,寡肽作为靶头将小分子药物递送到靶部位,可提高药物的治疗效果,减少周身毒性[49]。用抗Aβ1-42 功能化的NPs治疗AD 转基因小鼠可完全恢复记忆缺陷,可显著降低大脑中的Aβ 可溶性肽及其低聚物水平,并显著提高血浆中的Aβ 水平[50]。外泌素(Exosome)是一种用于细胞间通讯的纳米囊性载体。这些纳米囊泡与一些主要疾病的病理学有关,在某些情况下,它们在疾病发展过程中起着中心作用[51]。利用这些载体运输治疗药物是治疗阿尔茨海默病等疾病的一种新的、有前途的方法。
3 纳米药物治疗AD 所面临的问题
NPs 在治疗神经退行性疾病方面具有巨大的潜力,然而迄今为止NPs 在治疗AD 进行的研究多为临床前研究,还没有提供任何可用于人类的重要结果[52]。纳米技术治疗神经退行性疾病的主要限制之一,是每个患者都有不同的基因组、神经功能和特征,因此没有一种方法可以用于治疗所有这些疾病[53]。此外,NPs 在治疗过程中的另一局限在于其吸收时间很短,注射不充分时药物往往不能被血液或身体其他部位所吸收,无法到达治疗部位[54]。另外,NPs 的成本问题也是限制其进入临床研究的原因之一。
4 小 结
AD 是最常见的与年龄相关的疾病,然而一些AD 药物有其固有的缺点,它们不能通过BBB。NPs 可利用现有的通过BBB 的生理机制,包括受体和吸附介导的跨细胞作用,可以促进小分子、其他药物或标记物进行从血液到大脑的跨细胞转运。今后,NPs 可被设计成增加病理部位药物的积累和释放,通过改善药代动力学、生物利用度、水溶性和生理条件下的稳定性来提高治疗效果,并通过限制其在健康组织中的定位来降低副作用的发生率。尽管NPs 给治疗AD 带来了许多新的机遇,一些纳米药物制剂已经进入临床试验阶段;但大部分的研究还处于各种体外模型或体内动物模型等的临床前研究阶段。可以预言,随着AD 病理机制的研究和NPs研究的进步,相信纳米释药系统在AD 的早期诊断和治疗方面将会发挥巨大潜力。
