肾透明细胞癌孤立性第四脑室转移手术完全切除1例☆
2021-07-12杜晓亮刘建雄张坚万群王明明彭绍鹏
杜晓亮 刘建雄 张坚 万群王明明 彭绍鹏
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是起源于近曲小管,预后较差的高侵袭性泌尿系统恶性肿瘤,占所有肾细胞癌70%~75%[1],约有4%~17%会发生脑转移,转移至脑室内的约占脑转移的1/3[2-3],而其中90%以上转移至侧脑室,转移至第四脑室者少见[2,4]。我科收治了1例Fuhrman Ⅰ级肾透明细胞癌继发孤立性第四脑室转移的患者,手术完全切除,现报道如下。
1 临床资料
患者,女,52岁,主因“头痛头晕伴恶心1月余”入院。患者自诉于入院前1月余无明显诱因出现弥漫性头痛,可耐受,伴头晕及恶心,仰卧位加重,站立后减轻,无黑朦,无视物旋转,无呕吐等其余不适症状。既往11年前因“宫颈癌”行子宫切除术,4年前因肾癌行右肾根治性切除术,术后病检提示:透明细胞型肾细胞癌(Fuhrman Ⅰ级),1年前入院复查,头颅MRI未见异常(图1)。此次入院后,查体提示患者步态不稳,后倾,闭目难立征阳性,余无明显阳性体征。血常规、生化,脑脊液常规、生化及细胞学等无异常。头颅MRI平扫发现:第四脑室见一混杂短T1长T2结节占位,瘤周白质无水肿,DWI为等低信号,ADC为等高信号,病变位于第四脑室右侧(图2),脑实质未见明显异常占位性病灶;增强后可见明显不均匀强化(图3)。于入院后第4天行显微镜下经膜髓帆入路+蚓垂扁桃体间隙第四脑室肿瘤切除术,术中见肿瘤呈樱桃红色,质略韧,血供极丰富,血供主要源自小脑后下动脉分支,肿瘤与四脑室侧孔处脉络丛关系密切,与脑室内脑组织无明显粘连。术后免疫组化(图 4)提示:RCC(+),EMA(灶+),CA9(+),CD(10+),CKp(+),CD31(血管网+),CD34(血管网+),CAIX(+),Vimentin(-),CK5/6(-),s-100(-),P40(-),GFAP(-),Ki-67(index:30%);苏木精-伊红染色提示癌组织呈泡巢状和腺泡状结构,由小的薄壁血管构成网状间隔,少数区域囊腔形成,细胞形态不规则,胞浆透明或嗜酸,细胞核小或中等大,结合肾癌病史、HE切片组织形态及免疫组化染色结果,病检确诊第四脑室占位为肾细胞癌(透明细胞型)脑室转移。术后第2天患者出现双侧眼球外展受限,左侧轻度中枢性面瘫,House-Brackmann分级2级,出院时尚未恢复,余无并发症。术后第3天复查头颅MRI提示占位病灶全切除(图5、6),术后20 d复查发现患者外展神经功能、面瘫逐渐改善。
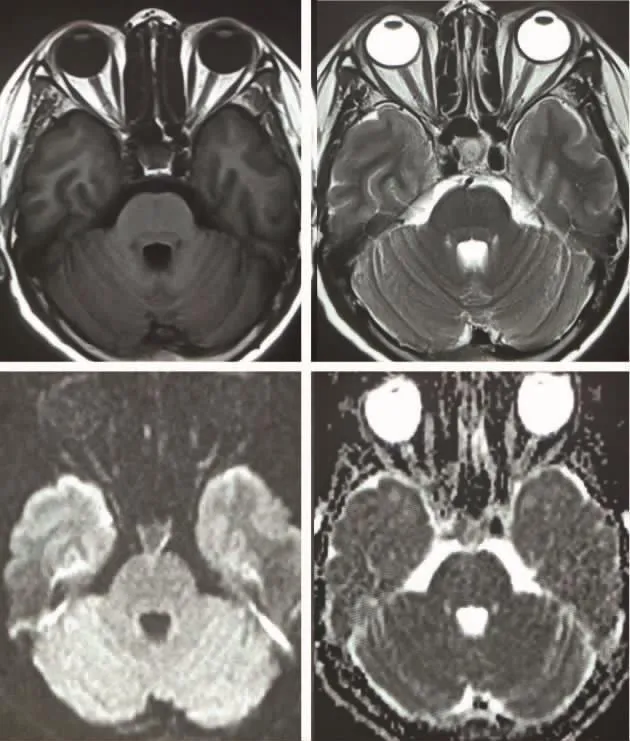
图1 头颅 MRI T1、T2、DWI、ADC 相均未见明显异常

图2 头颅MRI平扫 第四脑室见一混杂短T1长T2结节占位,DWI为等低信号,ADC为等高信号,病变位于第四脑室右侧。

图3 头颅增强MRI 轴位、矢状位、冠状位示四脑室明显不均匀强化,可见血管流空影(红色三角形尖端)

图4 第四脑室占位免疫组化 CD10阳性 (A)、CKP阳性(B)、RCC阳性(C)。

图5 术后头颅平扫MRI T1轴位、T2轴位及矢状位第四脑室病灶未见明显残余
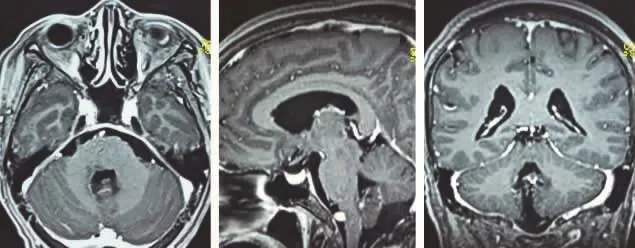
图6 术后头颅增强MRI 轴位、矢状位、冠状位第四脑室未见明显强化灶
2 讨论
肿瘤脑转移途径主要有4种:①直接浸润,鼻咽癌等头颈部恶性肿瘤常可突破颅底侵犯颅内[5],关于鼻咽癌颅内转移的具体途径,目前更倾向于主要通过血行转移,但是否可通过脑脊液播散目前尚无定论;②通过血行转移,最常见转移部位是肺、淋巴结,其次是大脑、乳腺等部位;③通过脑脊液种植转移,肿瘤细胞通过蛛网膜下腔播散,通常转移至脑实质,该转移方式主要见于肺癌脑转移,部分病例报道肾癌也可发生,可通过脑脊液细胞学及脑脊液生化、常规加以诊断;④尚有<1.0%的肿瘤可通过脉络膜动脉发生孤立性脉络丛转移(solitary metastasis to the choroid plexus,SMCP)[2,4,6],亦有学者将之归为第②种转移途径,但因此种转移途径的罕见及发病原因不同,故本文另做分类。
SMCP不同于多发性脑实质转移[7],通常转移部位仅累及单一脑室脉络丛。脉络丛血供极丰富,血脑屏障不健全,理论上此处更易发生转移,但实际上转移发生率极低,可能与以下原因相关[3,8-10]:①脑转移通常发生于灰白质交界处或供血动脉远端区域,这些区域脑血流缓慢,更适于肿瘤微栓子种植。脉络丛血供虽极丰富,但血流速度约为脑实质血流速度的5倍,因此肿瘤微栓子极易流失,不利于捕获及定殖。②脉络丛血脑屏障不健全,但脉络丛基底部极易沉积抗基底膜抗体的免疫复合物等,不利于肿瘤细胞的定殖。③转移至此处的肿瘤多具有潜伏期长、恶性度低的特点,转移率较低。④与趋化因子的导向过程相关。本例中年女性患者在右肾根治性切除术后4年发现第四脑室占位性病灶,不足1年该部位肿瘤已占据第四脑室体积近90%,头颅MRI显示病灶与周边脑组织界限清,瘤周白质无水肿,脑实质未发现转移病灶,增强MRI发现瘤内血管流空影,单从影像学来看,血管网状细胞瘤可能较大;但结合肿瘤生长速度、临床病史及影像学表现,初步考虑该肿瘤恶性度较高,肾癌脑室转移不排除;脑室内脑膜瘤发病率低、生长缓慢、增强呈均匀强化,但不排除间变性脑膜瘤可能,诊断可疑;该部位常见的室管膜瘤、脉络丛乳头状瘤等脑室原发肿瘤常见于儿童,生长缓慢,MRI无血管流空现象,诊断待排。术后免疫组化RCC(+)、CD10(+)提示该肿瘤来源于近端小管,CAIX(+)提示该肿瘤与肾透明细胞癌关联密切,EMA(+)提示该肿瘤可能源于上皮组织,结合HE染色所见,最终病理证实四脑室占位为肾透明细胞癌脑室转移。本例患者术中发现肿瘤血供极丰富,血供主要源于小脑后下动脉分支,术中可见肿瘤源于四脑室脉络丛右侧孔,该病例在一定程度上为脑室内脉络丛转移理论增添了依据。
肾癌脑转移多发生于肾癌切除术后数十年,但肾癌脑室内转移多发生于肾癌切除术后数年[4,10]。本例患者孤立性脑室转移发生于术后第4年,且在1年内肿瘤体积迅速增大,笔者分析认为与肿瘤、脉络丛微环境及转移方式关联密切。
ccRCC 患者常有 VHL(Von Hipple-Lindau,VHL)双等位基因突变,导致VHL基因产物pVHL明显减少,低氧诱导因子α(HIF-α)难以降解,其作用的靶点蛋白如血管生成素样蛋白4(ANGPTL4)、碳酸酐酶9(CA9)、血管内皮生长因子(PDGF)、红细胞生成因子(EPO)、基质金属蛋白酶 1(MMP1)等与转移密切相关的蛋白转录增强,肿瘤细胞突破“脉络丛锁”进入脑室,释放补体C3等片段突破“脉络丛-血-脑脊液屏障”,改变脑脊液微环境,以适应肿瘤快速增殖[11-12]。
第四脑室位于小脑与延髓、脑干中间,其腹侧脑干富含大量神经核团,因此该部位手术难度极大,既往从蚓部入路需切开小脑蚓部,该种手术破坏了正常解剖结构,术后容易出现小脑缄默症和平衡障碍等并发症[13]。近年来,膜髓帆入路以其利用小脑与延髓间自然裂隙到达第四脑室而逐渐用于第四脑室病灶切除,且后者有更少的并发症[13]。本例患者肿瘤体积相对较大,上界接近中脑导水管,紧贴上髓帆,前方与第四脑室底关系密切,单纯膜髓帆入路难以有效暴露病灶,故经膜髓帆入路分离后显露肿瘤下界,自蚓垂扁桃体间隙切开,向上、向外暴露肿瘤,逐步离断肿瘤血供、分块全切肿瘤。患者术后未出现小脑缄默症及平衡觉改变,但出现复视及中枢性面瘫。既往研究[13]认为,外展神经(CNⅥ)及面神经(CNⅦ)受损与手术入路即经蚓部入路明显相关,因为该手术损伤了位于面神经丘深部的面神经膝和展神经核。本例患者术后虽出现面神经及外展神经麻痹的表现,但患者2个月后复查发现外展神经麻痹症状明显改善,残留轻微面神经麻痹症状,不同于前人研究,我们认为患者出现面神经、外展神经麻痹与桥脑被盖神经核团术中受干扰相关。
