扁桃体癌患者人乳头瘤状病毒DNA整合位点分布分析
2021-07-09张欣欣陈南翔
魏 健,张欣欣,刘 坤,陈南翔
1 解放军总医院 耳鼻咽喉头颈外科医学部,北京 100853;2 国家耳鼻咽喉疾病临床医学研究中心,北京100853
全世界范围内约4.5%的肿瘤与人乳头瘤状病毒(human papilloma virus,HPV)相关[1-2]。近年来,越来越多的研究发现,口咽癌的发生与HPV感染相关[3-5]。最新版美国癌症联合会(American Joint Committee on Cancer,AJCC)肿瘤TNM分期已将HPV阳性口咽癌进行单独分期[6]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)头颈肿瘤临床指南更增加了针对HPV阳性口咽癌的规范化诊疗原则[7]。然而HPV对扁桃体癌的致癌机制尚不明确。在宫颈癌中,HPV的致癌作用已经被证实主要是通过其癌基因表达的相关癌蛋白E6和E7实现的[8-11]。Akagi等[12]提出了一种“环”模型,通过该模型,发现HPV整合引起的DNA复制和重组可能导致病毒-细胞DNA连接体形成,破坏了抑制肿瘤发生的基因,并扩增HPV癌基因E6和E7,从而导致基因组的不稳定。因此,病毒基因组整合是肿瘤发生过程中的关键一步。基于上述认知,本研究选择口咽癌中HPV感染率最高的扁桃体癌为研究对象。通过HPV基因捕获和二代测序技术,分析扁桃体癌患者HPV的感染情况以及HPV DNA整合到人类基因组中的位点,揭示HPV相关扁桃体癌的致病机制。
材料和方法
1 样本来源 收集2015年10月- 2020年7月解放军总医院耳鼻咽喉头颈外科收治的扁桃体鳞癌患者的临床资料,共收集32例样本,包括19例扁桃体癌新鲜冷冻标本和13例扁桃体癌石蜡包埋组织标本。本研究经过解放军总医院伦理委员会审批(伦审第S2019-056-01号)。
2 主要仪器与试剂 NanoDrop 1000分光光度计(v3.7.1)、全自动基因扩增仪(PCR System 9700)、Illumina HiSeq 2000测序仪、高速台式离心机(Centrifuge 5424R)、微孔洗板机(Elx50)、Rotor Gene 6000荧光定量PCR仪、光学显微镜、恒温可调节式烤片机(HI1220)、恒温可调节式捞片机(HI1210)、石蜡切片机(RM2245);Proteinase K溶液、DNA提取试剂盒(康为世纪、Qiagen)、GA缓冲液。
3 DNA的提取 1)石蜡包埋组织样本DNA的提取:首先将切好的石蜡切片(至少5个切片)放入1.5 mL EP管,EP管中加入二甲苯进行脱蜡,摇晃20 s。然后将EP管离心2 min,转速12 000 r/min。加入1 mL无水乙醇,混合均匀;再次离心2 min,转速12 000 r/min。接着向a管中加入20 µL Proteinase K溶液和200 µL GA缓冲液混匀配制成的溶液,依次56℃水浴1 h,90℃水浴1 h;最后采用DNA提取试剂盒(康为世纪、Qiagen)提取DNA。2)新鲜组织标本DNA的提取:首先将标本表面的贮存液吸干,倒入液氮,用研钵将其研磨成粉末,加入1 mg Proteinase K,37℃水浴2 h。加入1 mL 5 mol/L NaCl溶液,摇匀后离心1 min,转速5 000 r/min;然后取上清置于新的无菌离心管,加入酚、氯仿、异戊醇混匀配制成的溶液,待分层后离心5 min,转速3 500 r/min;接着将上清移至15 mL离心管,在通风橱中加入乙醚进行抽提,吸除上层乙醚;加入3 mol/L的NaAc,再加入无水乙醇,混匀后在室温下静置20 min,沉淀DNA。最后用玻璃棒钩取白色絮状DNA沉淀,用70%乙醇进行漂洗,溶解于1 mL TE,置于-20℃冰箱保存。
4 文库构建及目的基因捕获 运用Covaris打断法,将样品DNA打碎为100~700 bp范围的片段;对片段进行末端修复、加poly‘A’尾及产物磁珠纯化;运用PCR进行文库扩增并对产物磁珠纯化;使用Nanodrop 2000和琼脂糖凝胶电泳对文库进行质检;使用根据17种HPV型(6、11、16、18、31、33、35、39、45、52、56、58、59、66、68、69、82)的全基因组设计的HPV探针,与文库DNA液相杂交;用链霉亲和素修饰的磁珠共价结合生物素标记的探针,抓取目的基因;磁力架吸附携带目的基因的磁珠,洗脱纯化,富集目的基因。
5 上机测序 采用Illumina独特的“桥式”扩增反应,Illumina HiSeq 2000测序仪将文库加载到测序芯片Flowcell。测序策略PE150,测序深度为500 ×。
6 生物信息分析 对测序得到的原始数据进行质控,得到高质量数据;使用BWA程序将得到的高质量数据与每个HPV参考基因组匹配分析,并使用GATK软件包重新校准。若一对读码的一端是唯一映射到一个人类染色体和HPV参考基因组的,则这对读码被确定为不一致的读码对。如一个特定的位置有3个以上的不一致的读码对,其将被认为是一个潜在的HPV整合位点,整合位点的断点使用Break Dancer程序进行识别。整合位点的注释依据人类基因组hg19和HPV基因组注释信息。如一个配对端读码不能匹配到人类基因组,但能匹配到HPV基因组,其将被标记为HPV DNA信号,供后续分析。根据这些数据计算HPV基因组的覆盖范围、深度和匹配度。当平均测序深度大于10,且超过50%病毒基因组总长度至少覆盖4倍时,该样本被认为是HPV DNA阳性。
7 统计学方法 运用SPSS24.0统计软件进行分析,计数资料的组间比较采用Fisher精确检验,P<0.05为差异有统计学意义。
结 果
1 扁桃体癌患者的临床资料 32例扁桃体癌患者中,男性28例,女性4例,年龄43~78岁,中位年龄57岁;1例为临床Ⅱ期,8例临床Ⅲ期,23例临床Ⅳ期。
2 HPV捕获类型 捕获的所有DNA样品主要有5种HPV类型(HPV16、18、33、53、67)。在这32例样本中,有22例样本HPV16 DNA表达阳性,见图1。除了HPV16,在这32例样本中还检测出HPV18、33、53、67,分别检测出1次。此外分别在3例样本中检出两种类型以上的HPV,在T22中包含HPV33和HPV16,在T24中包含HPV53、HPV58和HPV18,在T26中包含HPV16和HPV31。但在T22中,HPV33的测序深度比HPV16大152倍;在T24中,HPV53的测序深度比HPV58大52倍,比HPV18大35倍;在T26中,HPV16的测序深度比HPV31大26倍。因此,在随后的分析中仅分析了T22中的HPV33、T24中的HPV53和T26中的HPV16。

图1 HPV亚型在32例扁桃体癌样本中的分布Fig.1 Distribution of HPV subtypes in 32 samples of tonsil carcinoma
3 HPV整合位点 在26例HPV DNA阳性病例中,共发现218个潜在的HPV整合位点,其中包括20例HPV16,1例HPV18,1例HPV53,1例HPV67。HPV16 DNA整合率为91%(20/22)。此外,在2例HPV16和1例HPV33 DNA阳性样本中未检测到HPV整合。对于这218个潜在的HPV整合位点,根据其在HPV基因组和人染色体上所处的位置,对其进行筛选,剔除重复的整合位点,共获得173个整合位点。其中HPV16中有155个整合位点,HPV67中有12个整合位点,HPV18和HPV53中各有3个整合位点。
4 HPV整合位点在病毒基因组上的位置 HPV16整合阳性的20例样本中155个整合位点广泛分布于整个HPV基因组中,具有独特的分布特征,包 括E1(n=41)、E2(n=13)、E2/E4(n=6)、E5(n=2)、E6(n=4)、E6/E7/E1(n=2)、L1(n=49)、L2(n=26)、L2/E2/E4/E5(n=2)、L2/L1(n=7)、LCR(n=3),见图2A。整合位点出现频率最高的区域是E1和L1,其次是E2和L2,最稀疏的是LCR和E5。此外,HPV16整合位点在每个样本出现的频率范围为1~43,在75%(16/20)的HPV16 DNA整合阳性样本中发现2个及2个以上的整合位点,见图2B。
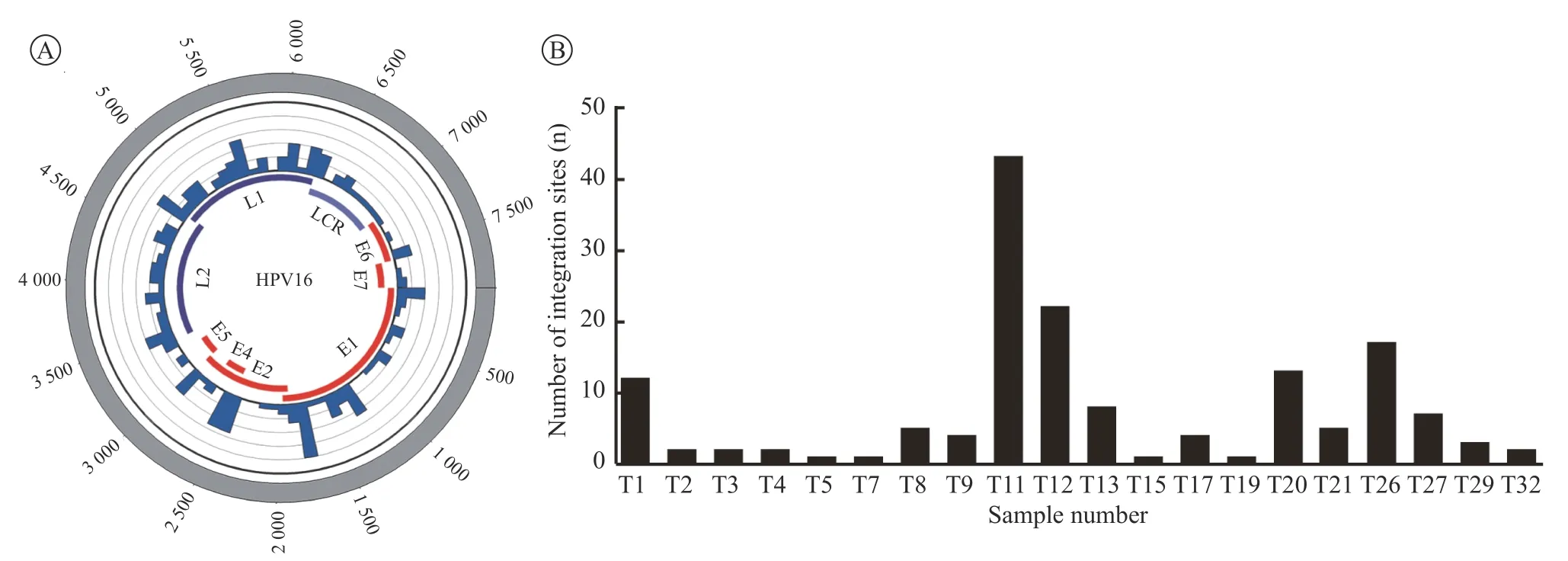
图2 整合位点的分布,根据HPV基因组中的位置,A显示了在20个HPV16整合阳性病例中确定的153个整合断点,B显示了20个HPV16整合阳性扁桃体癌样本中155个整合位点的频率Fig.2 Distribution of integration sites. According to the position in the HPV genome, 153 integration breakpoints were identified among the 20 HPV16 integration positive cases (A); The frequency of 155 integration sites in 20 HPV16 integration positive tonsil carcinoma samples (B)
5 HPV整合位点在染色体上的位置 将HPV整合位点定位到染色体,发现整合位点几乎位于除Y染色体之外的所有染色体上(图3)。此外,我们还发现几个整合位点聚集在某些染色体区域中,如17q12(0.26 M,CDK12),14q32.32(0.05 M,EXOC 3L4),Xp11.3(0.12 M,KDM6A),2p11.2(0.005 M,LOC101927050),14q32.2(0.11 M,LINC01550),1q21.3(0.27 M,HRNR),14q13.3(0.15 M,MIPOL1)和3q28(0.02 M,TP63)。将处在同一基因片段上的3个或3个以上的HPV整合位点定义为“簇”,其跨度介于0.005 ~ 0.27 Mb。通过分析这些簇的详细特征,将它们分为三组。在第一组中,每个样本在同一个基因带存在3个或3个以上的HPV整合位点,并且有可能将它们整合在一个串联的阵列中,这与Akagi等[12]提出的“环”模型一致。如HPV整合簇在T12(n=5)中映射为17q12,在T20(n=10)中映射为14q32.32,在T6(n=3)中映射为14q32.2,在T30(n=12)中映射为1q21.3。在第二组中,HPV整合簇至少在3个样本中出现,这可能代表真实的热点,例T12(n=1)中的14q13.3,该整合位点同样也在T13(n=2)、T14(n=2)和T17(n=2)中出现。在最后一组中,HPV整合簇同时具有上述两组特性,如T12中的17q12(n=1)、T14(n=1)和T19(n=3)。见图3。
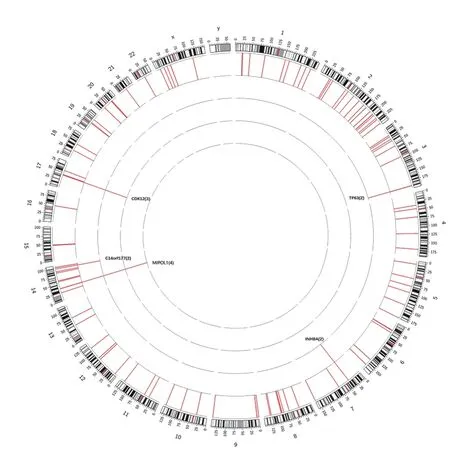
图3 23例中173个HPV整合位点的染色体定位Fig.3 Chromosomal location of 173 HPV integration sites in 23 cases
6 HPV16阳性且整合数大于1组与HPV16阴性或无HPV整合组比较 将32例患者分为HPV16阳性且整合数大于1组与HPV16阴性或无HPV整合组,分别对性别、年龄、临床分期、有无淋巴结转移和病理分化程度进行Fisher精确检验,发现两组间除有无淋巴结转移有统计学差异(P=0.002),其他临床资料均无统计学差异。见表1。

表1 32例扁桃体癌患者的临床资料(n)Tab. 1 Clinical data about 32 patients with tonsil carcinoma (n)
讨 论
目前在检测人类基因组中HPV整合位点的研究中,大多数采用PCR的方法[13-15],这些检测方法的敏感度可能会受到HPV状态(游离或整合)、病毒的拷贝数以及整合形式(单拷贝或串联形式)的影响[16]。本研究将HPV捕获与二代测序相结合,能够以高特异性和高敏感度在单次运行中检测出不同分型的病毒,还具有能区分多种背景的能力,主要是附加型或串联型,整合形式的数量,并进一步确定病毒和细胞连接之间的序列。
本研究采用17种HPV全基因组探针捕获HPV目的基因,同时检测32例扁桃体癌标本的HPV亚型和HPV DNA整合位点,其中HPV DNA阳性占81.3%(26/32),包括HPV16(22/32,68.8%)、HPV18(1/32,3.1%)、HPV33(1/32,3.1%)、HPV53(1/32,3.1%)和HPV67(1/32,3.1%)。这与国际上报道的数据基本一致[17-18]。通过这种检测方法,获得了153个HPV整合位点。在22例HPV16 DNA阳性扁桃体癌样本中,91%(20/22)存在HPV整合位点,表明HPV16阳性的扁桃体癌中存在大量整合病毒基因组。这与HPV16阳性子宫颈癌中存在大量整合的病毒基因组的报道类似,可能是扁桃体癌发生的机制之一。
在本研究中,有多个HPV整合位点在样本中重复出现,包括MIPOL1、CDK12、EXOC3L4、TP53、LINC01550、KDM6A等基因。其中MIPOL1和CDK12分别在4例样本和3例样本中出现,极有可能是肿瘤发生的热点基因。MIPOL1是Laurin-Sandrow综合征的致病基因,Laurin-Sandrow综合征是一种先天性多指畸形[19]。但MIPOL1在癌症发展中的作用尚不明确。有研究报道MIPOL基因是一种抑癌基因,在抑制鼻咽癌的迁移、侵袭和转移方面起关键作用[20]。HPV整合位点的插入可能导致该抑癌基因的失活,从而促进扁桃体癌的发生。CDK12是一种与转录相关的周期蛋白依赖性激酶,在肿瘤的发生中起重要作用。目前的研究发现,CDK12的mRNA和蛋白表达在宫颈癌患者中均显著上调。CDK12上调还与宫颈癌进展和预后不良密切相关[21]。HPV整合位点的插入可能导致该致癌基因表达上调,从而促进扁桃体癌的发生。总而言之,CDK12和MIPOL1是首次在扁桃体癌中发现的突变基因,可能与扁桃体癌的发生相关。
有研究报道HPV相关口咽癌患者通常为男性、较年轻,原发肿瘤常较小,容易出现颈部淋巴结转移,同时转移淋巴结常较大[7,22-23]。本研究发现HPV16整合的扁桃体癌均出现淋巴结转移,同时发现87.5%的患者为男性,与国际上的报道一致。由于本研究纳入的病例数较少,未发现HPV感染与年龄之间的相关性。
综上所述,本研究中扁桃体癌患者HPV的阳性率与国内外研究结果整体一致,HPV阳性的扁桃体癌大多具有HPV整合。本研究发现MIPOL1和CDK12两个热点基因可能与HPV相关扁桃体癌的发生有关,在后续的研究中可以针对这两个基因进行预后的判断和靶向治疗。此外HPV阳性与HPV阴性扁桃体癌的预后不同可能是由于致癌机制不同。由于基因捕获测序只能检测到HPV整合的情况,若无HPV感染,则检测不到HPV整合。因此在接下来的研究中,我们将分别对HPV阳性与HPV阴性的扁桃体癌组织进行全外显子测序,探索HPV阳性与HPV阴性扁桃体癌致癌机制不同之处,从而进一步剖析HPV相关扁桃体癌的致癌机制。
