机器人与腹腔镜根治术治疗SiewertⅡ/Ⅲ型食管胃结合部腺癌的疗效比较及预后影响因素分析
2021-07-09徐茂林滕志鹏邝衍绅刘洪一贾宝庆
柯 沐,徐茂林,刘 新,黄 埔,滕志鹏,邝衍绅,李 森,李 鹏,刘洪一,贾宝庆,
1 解放军医学院研究生院,北京 100853;2 解放军总医院第一医学中心 普通外科医学部,北京 100853
食管胃结合部腺癌(adenocarcinoma of esophagogastric junction,AEG)是一种位于特殊解剖部位的恶性肿瘤,具有与胃癌和食管癌不同的生物学行为,更容易发生血液和淋巴转移,多数患者确诊时已是进展期,预后较差。Kofoed等[1]的研究显示,食管胃结合部腺癌患者术后5年生存率为18%~50%。多项研究显示食管胃结合部腺癌发病率在全球范围内逐年上升,尤其是SiewertⅡ/Ⅲ型AEG[2–4]。目前关于SiewertⅠ型AEG的外科治疗方式已基本达成共识,其手术方式主要参考食管下端癌。而对于SiewertⅡ/Ⅲ型AEG的外科治疗仍存在争议,其中腹腔镜手术对SiewertⅡ/Ⅲ型AEG的治疗已被证明是安全有效的[5–8]。但有关机器人辅助治疗SiewertⅡ/Ⅲ型AEG的相关报道较少。本研究回顾性分析了解放军总医院第一医学中心普通外二科收治的111例SiewertⅡ/Ⅲ型AEG患者的临床病理资料,比较机器人与腹腔镜手术的近期和远期临床疗效,并分析与预后相关的临床因素。
资料和方法
1 临床资料 收集解放军总医院第一医学中心普通外二科2014年1月- 2019年8月收治的111例SiewertⅡ/Ⅲ型AEG患者的临床资料。纳入标准:1)术前或术后经病理证实为SiewertⅡ/Ⅲ型AEG;2)术前影像学检查未发现远处转移;3)行腹腔镜或机器人辅助下根治手术。排除标准:1)术前经过新辅助治疗;2)合并其他恶性肿瘤;3)术前存在心肺脑等部位严重疾病;4)术后复发行二次切除;5)急诊手术;6)资料不完整。本研究通过解放军总医院医学伦理委员会审批(S2020-326-01),患者及家属术前均签署知情同意书。
2 手术方法 两组分别采用达芬奇机器人手术系统和STORZ腹腔镜系统。两组均采用气管插管,全身麻醉,取仰卧体位。根据术中探查的具体情况分别行近端胃或全胃切除。机器人组Troca采用“W型”5孔法布局,安装好镜头、各机械臂、超声刀和无创抓钳。腹腔镜组则采用通用的5孔法布局。两组患者均按《日本胃癌处理规约》第13版行标准的胃癌根治术并清扫D2淋巴结。采用上腹部正中小切口手辅助重建消化道,近端胃大部切除采用食管残胃吻合,全胃切除采用Roux-en-Y吻合方式。
3 观察指标 1)临床资料:性别、年龄、体质量指数(body mass index,BMI)、美国麻醉师协会(American Society of Anesthesiologists,ASA)评分、既往史、个人史、肿瘤直径、肿瘤病理学TNM分期(参考第8版美国癌症联合委员会胃癌TNM分期法)和分化程度(G1 ~ G2,G3 ~ G4)等。2)围术期指标:手术时间、术中失血量、术中输血率、中转开腹率、肿瘤远端距切缘距离、切缘阳性率、清扫淋巴结数目、术后住院时间、术后胃肠功能恢复时间和胃管拔除时间等。3)术后并发症:肺部感染、胸腔积液、胰瘘、肠梗阻、吻合口瘘及切口感染等。4)术后随访:死亡时间、复发或转移时间及1年、2年、3年总生存率。Siewert Ⅱ/Ⅲ型AEG患者行根治术后预后影响因素分析。
4 随访 主要通过电话、短信及门诊复查进行随访。随访内容包括患者存活情况、肿瘤复发或转移情况。总生存时间为手术当天至随访截止日或患者死亡时间,随访截止日为2020年12月25日。
5 统计学分析 使用SPSS26.0统计软件进行分析。符合正态分布的计量资料以表示,两组间比较采用两独立样本t检验。非正态分布的计量资料用中位数(四分位间距)表示,两组间比较用秩和检验。计数资料用例数(%)表示,两组间比较用χ2检验或Fisher’s精确概率检验。生存分析采用Kaplan-Meier法和log-rank检验,Cox回归模型分析与生存独立关联的因素。P<0.05为差异有统计学意义。
结 果
1 两组患者临床资料比较 经过筛选,共纳入111例患者,其中男性94例,女性17例;中位年龄63(41 ~ 82)岁;机器人组50例,腹腔镜组61例。两组患者Siewert分型、年龄、性别、手术切除范围、BMI、ASA评分和既往史等一般资料差异无统计学意义(P>0.05),肿瘤临床分期、肿瘤直径大小和肿瘤病理分级差异亦无统计学意义(P>0.05)。见表1。

表1 两组食管胃结合部肿瘤患者的临床资料比较Tab. 1 Comparison of clinical data about patients with AEG between the two groups
2 两组围术期指标比较 两组患者均未出现围术期死亡,其中有1例腹腔镜患者手术中转开腹。两组术中失血量、术中输血率、切缘阳性率差异无统计学意义(P>0.05),但机器人组手术时间更长[(231.7 ± 43.2) min vs (192.1 ± 44.0) min,P<0.001]。两组清扫淋巴结数目、肿瘤离上切缘距离差异无统计学意义(P>0.05)。两组的术后消化道功能恢复时间和术后住院时间差异亦无统计学意义(P>0.05),但机器人组术后拔除胃管时间更短[(7.1 ± 1.4) d vs (8.5 ± 2.9) d,P=0.001]。机器人组术后出现吻合口瘘1例,多器官功能障碍综合征1例,肺部感染1例;腹腔镜组术后出现胰瘘1例,肠梗阻1例,吻合口瘘1例,胸腔积液2例,切口感染1例。出现以上并发症的患者均积极治疗后好转出院。两组术后并发症发生率差异无统计学意义(9.8% vs 6.0%,P>0.05)。见表2。

表2 两组围术期指标比较Tab. 2 Comparison of perioperative variables between the two groups
3 两组术后复发及生存情况比较 111例患者中有5例患者失访(机器人组4例,腹腔镜组1例),106例患者获得术后随访,随访时间2~83个月,中位随访时间29个月。机器人组和腹腔镜组的术后复发转移比例(21.7% vs 36.7%)和肿瘤相关死亡率(21.7% vs 33.3%)差异无统计学意义(P>0.05)。Kaplan-Meier曲线显示机器人组和腹腔镜组的1年、2年、3年无瘤生存率分别为87.0%、82.1%、74.1%和81.6%、72.1%、65.4%,1年、2年、3年总生存率分别为93.5%、82.2%、79.5%和85.0%、78.1%、73.0%。两组的无病生存曲线(P=0.117)和总生存曲线(P=0.216)差异无统计学意义。见表3、图1、图2。
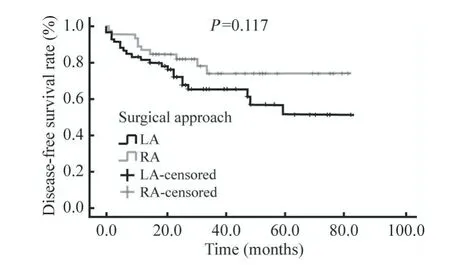
图1 两组患者的无病生存曲线Fig.1 Disease-free survival curve of patients in the two groups

图2 两组患者的总生存曲线Fig.2 Overall survival curves of patients in the two groups

表3 两组术后复发及生存情况比较Tab. 3 Comparison of postoperative recurrence and survival between the two groups
4 预后关联因素分析 106例患者单因素分析结果显示,肿瘤的Siewert分型、手术切除范围、TNM分期、T分期、N分期、手术切缘、脉管癌栓和肿瘤大小与患者术后无病生存相关(P<0.05);年龄、肿瘤的Siewert分型、手术切除范围、TNM分期、T分期、N分期、手术切缘、脉管癌栓和肿瘤大小与术后总生存相关(P<0.05)。多因素分析结果显示:肿瘤的Siewert分型、T分期、N分期和手术切缘与术后无病生存率相关(P<0.05)。年龄、TNM分期和肿瘤大小与患者术后总生存率相关(P<0.05)。见表4、表5。

表4 OS和DFS回归分析的自变量赋值Tab. 4 Variable assignment for univariale and multivariale Cox analysis of OS and DFS

表5 总生存期和无病生存期的单因素和多因素分析(n=106)Tab. 5 Univariable and multivariable Cox analysis of OS and DFS (n=106)
讨 论
目前,多项研究显示AEG每年的发病人数不断上升[2–4]。外科根治性切除术在AEG的治疗中扮演着重要角色。腹腔镜手术已被证明拥有较开放手术更好的近期疗效,和相似的远期疗效[5–8]。虽然3D腹腔镜具有较传统腹腔镜更好的立体视野和纵深感,但仍存在一些不足,如操作器械活动自由度相对较低,杠杆效应容易放大手部震颤,术者长时间的操作导致体位不适(特别在进行复杂手术时)等。机器人手术系统的出现改善了这些不足。目前机器人手术系统已广泛应用于普通外科、泌尿外科、妇科及心血管外科等领域,取得了令人满意的临床效果[9–13]。机器人与腹腔镜在临床近期和远期疗效的差异,也是外科医生关注的重点。
术中失血量和手术时间反映了手术方式的安全性。一项Meta分析纳入5 953例胃癌患者,比较机器人与腹腔镜的疗效差异,研究结果显示机器人组手术时间更长,术中失血量更少,术后进食时间更早[14]。本研究显示,两组术中失血量无统计学差异,机器人组手术时间更长。在术中失血量方面,可能因为两组术中均未对血管造成大的损伤,所以未见明显差异。机器人组手术耗时更长的主要原因是机器人相比腹腔镜多出了机械臂的安装和调试过程。有研究表明,机器人与腹腔镜胃肿瘤切除实际操作时间差异无统计学意义(P>0.05)[15]。随着手术团队配合得越来越默契,机械臂的安装时间通常会缩短为15~20 min。达芬奇机器人手术系统还能通过降低复杂解剖部位的操作难度,以及减少对血管的损伤而缩短手术时间。术后恢复指标同样是评估手术安全性的重要依据。本研究结果显示,与腹腔镜组相比,机器人组拔除胃管时间更短(P<0.05),而在术后胃肠功能恢复时间、术后住院时间和术后并发症发生率方面,两组差异均无统计学意义(P>0.05),这与国内外相关报道相似[14-15]。
AEG较其他部位的胃癌更容易出现淋巴结转移,获取足够的淋巴结可为肿瘤分期后的治疗方案提供依据,肿瘤与近端切缘的距离可以评估肿瘤是否被完整切除。多项研究报道,机器人组能更彻底地清扫淋巴结,尤其对于一些BMI较高的患者[16–19]。胰腺上区淋巴结的清扫对D2根治术很重要,Suda等[20]和Kim等[18]认为机器人系统的机械臂有更高的自由度,在清扫胰腺上区淋巴结时能更加轻松地保护好胰腺和血管,减少出血和胰瘘。脾门淋巴结的清扫往往是难点,脾门血管的分支和变异较多,清扫淋巴结时容易损伤脾门血管和脾。有研究表明,机器人手术系统在完成保脾清扫脾门淋巴结时,可获得更多的脾门淋巴结。我国的一项研究指出,膈下和下纵隔淋巴结的清扫,机器人组要优于腹腔镜[15]。我们的研究结果显示,两组患者的淋巴结清扫数目和近端切缘长度差异均无统计学意义(P>0.05),这说明机器人和腹腔镜均都能达到肿瘤根治性切除的预期结果。
本研究两组患者术后随访2~83个月(中位随访29个月)。结果显示,机器人组的术后复发转移率(21.7%)和肿瘤相关死亡率(21.7%)均低于腹腔镜组(36.7%,33.3%),但差异无统计学意义(P>0.05)。机器人组的3年无瘤生存率(74.1%)高于腹腔镜组(65.4%),但两组的无瘤生存曲线差异无统计学意义(P>0.05);机器人组的3年总生存率(79.5%)高于腹腔镜组(73.0%),两组的总生存曲线差异亦无统计学意义(P>0.05)。这表明机器人辅助AEG根治术的远期预后不比腹腔镜手术差。本研究还对影响Siewert Ⅱ/Ⅲ型AEG患者预后的影响因素进行了单因素和多因素分析,结果发现Siewert分型、T分期、N分期和手术切缘是影响患者术后无病生存期的独立影响因素;年龄、TNM分期和肿瘤大小是影响患者术后总生存期的独立影响因素。本研究说明了早发现、早诊断和早治疗对改善Siewert Ⅱ/Ⅲ型AEG患者预后的重要性,且行根治性手术时一定要获得足够的切缘长度,保证切缘无残留肿瘤细胞。
本研究为回顾性研究,无法完全排除一些偏倚,因此还需开展多中心前瞻性随机对照研究来进一步验证达芬奇机器人手术系统对Siewert Ⅱ/Ⅲ型AEG患者的近期和远期疗效。
达芬奇机器人手术系统具有3D镜头和10~15倍的高清视野,7个自由度的机械臂,可过滤手部震颤[20-21],能帮助术者轻松、精准地解剖一些操作困难的部位,而且学习曲线较腹腔镜更短[22]。达芬奇机器人手术系统的不足为缺少触觉反馈系统,且医疗费用昂贵。如今Senhance机器人手术系统的出现解决了以往机器人缺少触觉反馈系统的问题。我们有理由相信随着科技的进步以及国家对国产机器人的鼓励政策,机器人手术系统的不足在未来均能得到改善。医疗机器人还将搭配越来越多的新技术,如5G、AR、人工智能和医信融合等,配合医生更好地完成手术[23]。
本研究显示,对于治疗Siewert Ⅱ/Ⅲ型AEG患者,达芬奇机器人与腹腔镜具有相似的近期和远期疗效。Siewert分型、T分期、N分期和手术切缘是患者术后复发的影响因素;年龄、TNM分期和肿瘤大小是患者术后死亡的影响因素。对于Siewert Ⅱ/Ⅲ型AEG患者,应该早发现、早诊断,根据患者的具体情况,多学科联合制订治疗方案,以改善患者的预后。
