缩窄性心包炎1 例并文献复习
2021-07-09张金国
曲 越,张金国
(1.济宁医学院,山东济宁 272006;2.济宁医学院附属医院心血管内科,山东济宁 272029)
1 病例资料
患者男,54 岁,因“心慌、胸闷10 余天,加重10 d”2018-02-09 于济宁医学院附属医院心内科住院。既往有“脑梗死”、“尘肺”病史。自诉受凉后出现胸闷、憋喘、气短,伴咳嗽、咳痰,咳白色黏痰,不易咳出,步行不足50 m即可出现上述不适,休息数分钟后可缓解。入院查体:颈静脉充盈,未出现奇脉及Kussmul 征。其余体格检查未见明显异常。心电图(ECG):异位心律、心房扑动、ST-T改变。超声心动图(UCG):检查过程中患者心律不齐,即时心率约143 次/min,仅发现双房扩大。彩色多普勒检查:舒张期二尖瓣前向血流频谱呈单峰,左心室射血分数为57%。胸片提示双肺下野、心包区条状高密度影,心影增大(图1)。心脏冠状动脉计算机断层扫描(computed tomogra⁃phy,CT)成像(图2):(1)右冠优势型冠状动脉;(2)冠状动脉未见明显粥样硬化性改变;(3)左前降支中段心肌桥(表浅型);(4)纵隔及双肺门多发略大淋巴结;(5)右侧胸腔内团块影并多发钙化,心包钙化考虑为结核性胸膜炎钙化、结核性心包炎钙化;左肺散在炎症请结合胸部检查。初步诊断为心律失常、心房扑动、冠状动脉粥样硬化性心脏病(冠心病)、尘肺、支气管肺炎、陈旧性脑梗死。

图1 患者胸部正侧位片X 线图像[可明显看到心包区高密度影(箭头)]
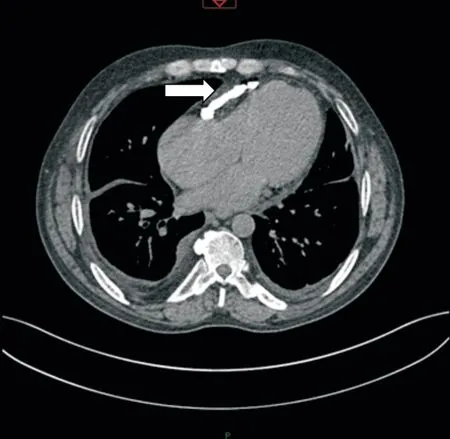
图2 患者胸部非增强CT 图像[可看到心包钙化(箭头)]
患者行影像学检查后明确诊断为“缩窄性心包炎”、“心包钙化”后,转入心外科于2019-02-25 行手术治疗。麻醉过程顺利,行完全性心包剥脱术,术中见心包钙化(图3)。游离心包后由左心室流出道开始剥脱,依次到右心室流出道、左心室流入道及右心室流入道。范围到左右隔神经,上下到心包反折及隔面(图4)。术中患者生命体征平稳,术后返回监护室继续监测生命体征。
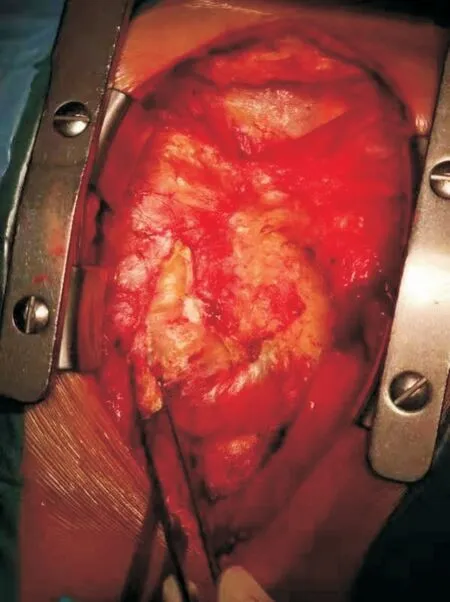
图3 患者术中视野图像(可见到黏连、钙化的心包)
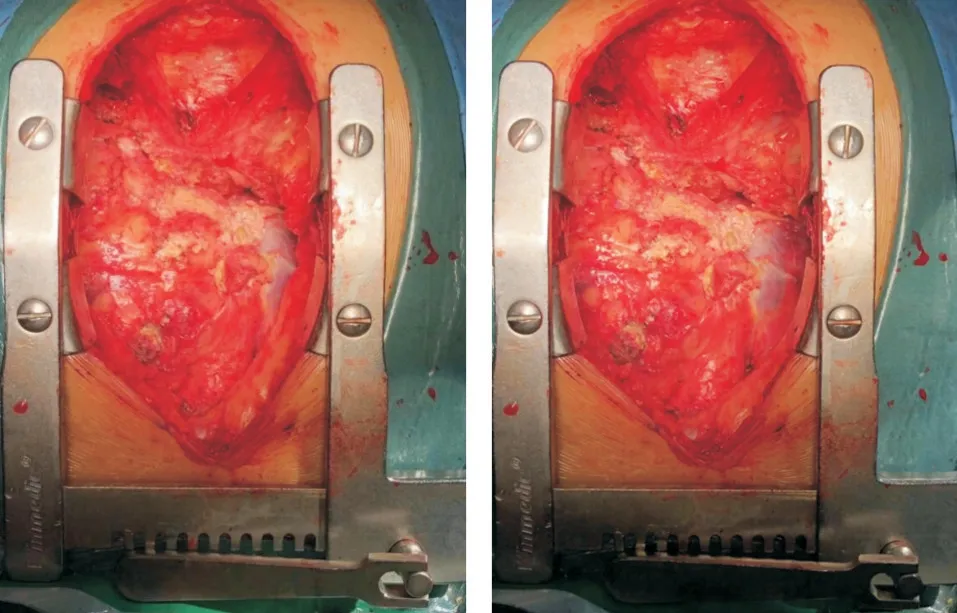
图4 患者术后视野图像(行心包切除术后可见到心肌,因全部切除困难,仍然可见到无法完全切除的部分心包)
近年结核所致缩窄性心包炎而行心包剥脱术的患者少见,倘若未行相关辅助检查,首次入院难以以缩窄性心包炎作为第一诊断,就症状而言,难与冠心病、心包积液、心肌病、心力衰竭等相鉴别。目前超声心动图是缩窄性心包炎首选的检查手段,但该患者超声心动图未见明显的缩窄性心包炎征象,为了明确病因,相继完善胸片、胸部CT 检查,胸片提示心包钙化、胸膜钙化,胸部CT 确诊心包钙化及肺部陈旧性结核灶,陈旧性肺结核所致缩窄性心包炎可考虑。
结核是发生缩窄性心包炎的主要病因并且也是最常见的病因之一,该患者胸片提示缩窄性心包炎与结核感染强烈相关。患者首先于心内科住院,有心力衰竭征象,初步诊断为心房扑动和冠心病,立即给予强心苷等药物增强心肌收缩力并控制心室率,琥珀酸美托洛尔缓释片控制心率,阿托伐他汀钙片调脂,阿司匹林肠溶片抗血小板聚集等治疗。患者行冠状动脉CT 检查提示心包钙化,经外科评估后转入心外科行心包剥脱术治疗。
心包剥脱术是目前根治缩窄性心包炎的手术方式,通过该手术可缓解心包对心脏的压迫,缓解症状,术后于监护室内行麻醉复苏,呼吸机辅助呼吸,多巴胺改善心功能,呋塞米利尿减轻心脏前负荷,硝酸甘油泵入扩冠状动脉,头孢呋辛钠预防感染,地塞米松减轻炎症介质反应等治疗。
2 讨论
Richard Lower 在1669 年首次认识到缩窄性心包炎的典型特征。缩窄性心包炎最终可导致舒张型心力衰竭,是由于心包慢性炎症所导致心包增厚、黏连甚至钙化,使心脏舒张、收缩功能受限,导致全身血液循环障碍的疾病。
2.1 导致缩窄性心包炎的病因
心包疾病的病因包括感染性病因和非感染性病因[1-4]。在发达国家,病毒通常是心包炎的最常见病原体[2],而在发展中国家尤其是在东南亚,心包炎的最常见原因是结核(tuberculosis,TB)[5]。Demin 和Drobysheva 的实验证明,在200 例心包炎患者中,有7%的患者是由TB 造成的,另外结核的并发症之一就是缩窄性心包炎,发生的概率是30%~50%。缩窄性心包炎在发展中国家其实也比较罕见,其发病率和患病率均未知[6]。近年来由于西方国家心脏手术量的增加,术后心包炎目前是西方国家缩窄性心包炎最常见的病因[7-8]。特发性缩窄性心包炎在发达国家亦常见,约占80%,也在总体上反映了特发性心包疾病的发生率[9]。其他病因包括放射性心包炎、肿瘤性心包炎、化疗性心包炎、感染性(尤其是结核病和化脓性感染)心包炎、手术后心包炎和石棉沉滞症性心包炎等[9-10]。其他导致的缩窄性心包炎的病因还包括急性心包炎发生后的缩窄性心包炎,患病率仅有1.8%[11]。
2.2 缩窄性心包炎的病理生理
心脏的外面由心包的脏层和壁层包裹,正常情况下心包的两层之间有少量的液体起润滑作用。缩窄性心包炎是由慢性炎症、瘢痕形成或两者共同存在而引起的心包疾病,病程中出现心包纤维化,并与心肌黏附,心室充盈受损,静脉压力增加,产生的不可逆性损伤的心包钙化是慢性缩窄性心包炎的特征[5]。临床上,缩窄性心包炎会导致充血性右心衰竭,是患者发病和死亡的重要原因[12]。通常很多患者会出现腹水(右心衰竭症状),且缩窄性心包炎造成的腹水出现较下肢水肿更早,但没有特异性,这提醒我们遇到出现腹水患者需考虑到缩窄性心包炎的可能性。
缩窄性心包炎的病理生理学特征是丧失心包顺应性,这会使得胸内压和心内压随着呼吸节律出现分离的现象。正常情况下,胸内压的变化会传递到肺静脉及心室腔中,胸内压和心内压之间存在一个恒定的压力梯度。当发生缩窄性心包炎后,心包失去了顺应性,心室被隔离,上述恒定压力梯度消失。因此,吸气时肺静脉和左心室间的压力梯度会缩小,左心室出现充盈障碍。僵硬的心包也会使得左、右心室压力随着呼吸运动相互影响。吸气时,左心室充盈减弱,右心室充盈增加,室间隔左移。吸气时,则出现了完全相反的生理效应。这被称为心室相互作用。呼吸节律与心内压和胸内压分离及心室的相互作用是缩窄性心包炎独有的两大病理生理特征。
心脏纤维化的心包限制了心房心室的舒张充盈,导致舒张末期压力升高。心室舒张受严重限制,提高心率成为提高心排血量的有效手段。适当升高的心率可以提高缩窄性心包炎患者的心排血量。
对不同原因造成的缩窄性心包炎也有不同的病理生理表现,如放疗后缩窄性心包炎主要表现为脏层心包坚韧地附着于心肌,而由胸部创伤引起的收缩性心包炎可出现从房室沟区域环型钙化,原因可能是由于创伤使心房折叠进入心室所致[13]。
2.3 缩窄性心包炎的临床表现
缩窄性心包炎大多起病隐匿,由于钙化的心包导致心室舒张充盈受损,临床特征表现为典型的右心衰竭的体征和症状,逐渐出现乏力,水肿,劳力性呼吸困难和腹胀。在一项研究中,几乎所有缩窄性心包炎患者的肺或胸腔内淋巴结也受累,但是在大多数情况下,淋巴结受累可能性小,不能成为诊断的基础。在许多晚期患者出现心肌纤维化,并出现心脏收缩功能障碍,心脏收缩功能障碍可进一步加重患者的血流动力学损害。另外,有研究表明心内膜炎被认为是肺外结核的一种表现。
全面的体格检查,特别是颈静脉体格检查对诊断缩窄性心包炎是十分重要的。缩窄性心包炎患者静脉压明显升高,颈静脉明显怒张,吸气时怒张更明显,特征性表现为Kussmaul 征,出现该症状即可高度怀疑该病。心脏听诊可以听到心包叩击音,或额外心音,其发生机制可能是心室充盈突然停止而产生,但敏感性较差。缩窄性心包炎终末期可以出现恶病质。
2.4 辅助检查
缩窄性心包炎表现无特异性,认识到这种疾病的诊断需要仔细询问患者病史及体格检查。更多时候我们仍需借助心脏成像方面的辅助检查做出更准确的诊断。
心电图:心电图表现常无特异性,有些患者仅表现为肢体导联低电压,20%~40%的患者会发生心房颤动[9]。
胸片:胸部X 射线检测出心包钙化的概率仅为27%[9],具体表现是在心包轮廓高密度影,特别是胸部侧位片更加明显,但有时仅能发现胸腔积液及肺充血。当发现心包钙化的时候结合患者病史可直接诊断缩窄性心包炎。
超声心动图:缩窄性心包炎典型的超声心动图表现为心包增厚,以房室环为显著,可伴钙化、室间隔异常运动,但并非所有的缩窄性心包炎均可表现为心包增厚[11]。梅奥诊所对超声心动图诊断缩窄性心包炎有以下3 个标准:(1)呼吸相关的室间隔移位(吸气时室间隔向左移动,呼气时室间隔向右移动);(2)二尖瓣e’峰速度保留或增加;(3)明显的肝静脉舒张期血流逆转(呼气时右心充盈减少)[9]。(1)和(2)或(3)联合诊断缩窄性心包炎的特异度和灵敏度分别为91%和87%[14]。目前超声心动图是诊断心包疾病的一线影像学检查,不仅能准确判定心包积液和心脏压塞,还能判定以及由于心肌受累而导致的心室功能障碍[15-16]。研究表明,与胸部CT 相比,超声心动图发现,中心静脉压升高时更能早期诊断缩窄性心包炎[17]。超声心动图亦可以排除急性胸痛患者与冠状动脉血流分布相一致的室壁运动异常,从而有助于将急性心包炎与心肌缺血区分开。目前散斑应变成像心脏超声心动图已经成为缩窄性及其他限制性心肌病的重要检查手段[11]。
CT:CT正常的心包厚度应小于2 mm,当心包厚度>4 mm时支持缩窄性心包炎的诊断,但在手术证实为心包狭窄的患者中,仍有20%的患者心包厚度正常[18]。CT 可以通过显示心包缺损引起的心脏结构移位,有助于诊断先天性心包缺如。在某些缩窄性心包炎患者,对于需要准确描述心包钙化范围和对有心胸外科手术史患者的术前检查而言,CT 必不可少[19]。对缩窄性心包炎患者的胸部CT 的回顾性研究显示,胸部CT发现缩窄性心包炎患者的概率为68%,而胸部X线检查发现缩窄性心包炎患者的概率仅为49%[19]。
心脏磁共振(CMR):心脏磁共振成像是评价心包疾病的常用工具。心脏磁共振成像能很好地显示心脏结构,并能评估心包增厚、水肿和积液严重程度。心脏磁共振成像已从多年前的形态学成像模式转变为全面的成像模式,可以对心包疾病患者的心包(和心脏)进行可视化,借此评估心包异常对心功能和心室充盈能力的影响[20-21]。心脏磁共振成像可以发现心包增厚和心包与心肌黏附。磁共振成像中缩窄性心包炎患者心包增厚>4 mm 是该病的典型表现[22]。实时影像也可以发现呼吸相关的室间隔移位。因此,评估心包疾病的最佳影像学方式仍然首选心脏磁共振成像[19,23]。心脏磁共振成像可能会识别出最初的缩窄性心包炎的形式,此时缩窄性心包炎是可逆的,此时可以进行抗炎药物治疗,从而减少不必要的手术[12,23]。这样外科医生便能够识别出可逆性缩窄性心包炎的患者来决定根治性心包切除术的最佳时机。
正电子发射层析成像(PET):对心脏磁共振成像有禁忌症的患者更适合做正电子发射层析成像-CT[12]。在某些癌症患者中,正电子发射层析成像-CT 使用的18F-氟脱氧葡萄糖示踪剂在心包摄取明显,表明心包受累,进一步提供了对某些疾病的的诊断、分期和评估的某些新信息(包括治疗后)[24]。不过对区别良、恶性心包疾病,以及心脏对18F-氟脱氧葡萄糖示踪剂是生理性摄取还是病理性摄取的区别较为困难。
当无创辅助检查仍无法诊断时,则需进行侵入性心导管检查,这是诊断缩窄性心包炎的“金标准”[18]。缩窄性心包炎血流动力学的经典特征包括中心静脉压升高;左右心脏充盈压接近平衡;右心室收缩压适度升高(<50 mmHg;1 mmHg=0.133 kPa);右心室舒张末期压力至少为右心室收缩压的三分之一。但这些特征也可能在限制性心肌病中出现,因此不能据此诊断缩窄性心包炎[11]。收缩面积指数增加预测缩窄性心包炎准确性达100%,敏感性达97%。心肌内膜活检:在许多情况下心肌疾病和心包疾病鉴别困难,此时通常可以选择心肌内膜活检或手术探查[9]。所有实验室检查中,结核阴性均不能排除缩窄性心包炎,诊断的关键是细胞学和形态学诊断。对疑似缩窄性心包炎的患者,有创血流动力学检测诊断的准确性更高[25]。
2.5 鉴别诊断
缩窄性心包炎仅靠体格检查易误诊,需主要鉴别的疾病是限制性心肌病,其余鉴别诊断还包括心肌梗死、严重的肺动脉高压及严重的三尖瓣关闭不全。
2.6 治疗方法
在少数情况下,缩窄性心包炎可能是由于炎症引起的,采用抗炎治疗可以自发消退。而大多数缩窄性心包炎患者可能是特发性的,或由于感染、创伤、恶性肿瘤所致。心脏磁共振成像提示心包延迟强化,提示具有潜在的可逆过程。
慢性缩窄性心包炎与舒张型心力衰竭极为相似,但两者的治疗方式截然不同。所有造成慢性缩窄性心包炎的病因中,除结核性缩窄性心包炎抗结核治疗有效外,其余病因引起的缩窄性心包炎无特效治疗办法,其治疗包括药物保守治疗和外科手术治疗。
药物治疗:慢性心包疾病主要治疗方法是外科手术,但药物治疗在以下3 种情况下有作用。首先,针对病因(尤其是结核性心包炎)药物治疗有助于防止病情进展到舒张型心力衰竭。抗结核药物将罹患缩窄性心包炎的风险从80%降至10%[26-27]。其次,大约10%~20%的缩窄性心包炎患者在几个月内可出现短暂的可逆性收缩(多指心包炎症消退过程中暂时出现的一种现象),可以进行口服药物治疗(一般以抗炎药物为基础)[28,29]。通过CT 或增强心脏磁共振成像、C 反应蛋白浓度升高或心包炎症的影像学证据,有助于鉴别出现短暂的可逆性收缩的患者,此时应使用经验性抗炎治疗而尽量避免行心包切除术。第三,药物治疗是支持治疗,目的是控制晚期患者以及具有手术禁忌患者的充血症状。手术治疗仍然是首选,药物治疗决不能使手术推迟,否则病死率更高,预后也更差[28]。
手术治疗:完整的心包切除术仍然是慢性缩窄性心包炎唯一有效的治疗办法。历史上第一次行心包切除术来试图缓解心脏舒张受限是Brauer 的心脏手术,该手术中一些肋骨、软骨和左心脏附近的胸骨的一部分被切除。但由于人们对该种疾病认识不全,手术中没有切除心包,因此治疗效果欠佳,此后开始行心包切除术。德国外科医生Ludwig Rehn 于1913 年首次成功进行了心包切除术[30],对于患有明显心力衰竭症状(纽约心脏协会心功能III 级或IV 级)的慢性收缩性心包炎患者,完全性心包切除术是唯一的治疗手段。许多大数据中心已经公布了心包切除术的围术期病死率为6.0%~7.1%[9]。选择心包切除术主要目的是为了避免心包持续钙化,术式包括完全性心包切除术和不完全性心包切除术。完全性心包切除术被定义为心包隔面的切除,从大动脉向上至隔肌表面下方,而不符合这些标准的其他类型的心包切除术都被归为部分心包切除术[31]。临床上患者往往心包钙化、黏连严重,通常不能行完全性心包剥脱术,需综合考虑患者状况选择最佳手术方式。患者术中无需使用体外循环机,因为已有临床试验证明术中使用体外循环机的30 d 内病死率与不使用体外循环机的情况相比更高[32]。因此,在行心包剥脱术时不常规使用体外循环机。
心包切除术后5 年和10 年的长期生存率分别为64%~88%和49%~52%[33]。特发性缩窄性心包炎患者的预后最好,5~7 年的生存率≥80%,有胸部放射史的缩窄性心包炎患者行心包切除术的预后很差,可能是电离辐射对除心包外的其他脏器造成的损害有关,他们的5~10 年的存活率从0%到30%不等[7,34-36]。根据对超声心动图数据的统计,约40%的患者左心室舒张功能在心包切除术后早期恢复到正常,近60%的患者左心室舒张功能在心包切除术后晚期恢复到正常[37]。同时心、肝、肾功能差的患者术后预后也很差。对于做过开胸手术的患者,术后常出现各种并发症,包括心包术后综合征[38]、各种心律失常(心房扑动)等等。
综上所述,对特发性缩窄性心包炎,应积极手术治疗,其他原因引起的缩窄性心包炎应尽量根据个体具体情况选择最佳治疗方案。
