脂联素通过A20/NLRP3/caspase-1途径抑制脂多糖诱导的小胶质细胞炎症反应
2021-07-09李海波张占琴
王 辉,陈 强,李海波,张占琴
(西安交通大学第一附属医院:1.疼痛科;2.心血管外科;3.心血管内科;4.麻醉手术部&脑科学中心,陕西西安 710061)
小胶质细胞是中枢神经系统主要的免疫效应细胞之一,占脑细胞的10%~15%,在CNS稳态中发挥关键作用[1]。小胶质细胞激活及其介导的神经炎症反应在缺血性脑损伤、脓毒症脑损伤以及神经退行性病变等多种中枢神经系统损伤及疾病的病理过程中发挥重要作用[2]。核因子-κB调节蛋白3(tumor necrosis factor α-induced protein 3, TNFAIP3/A20)能够调控小胶质细胞的活性,小胶质细胞A20缺陷后放大脂多糖(lipopolysaccharide, LPS)诱导的细胞损伤以及NLRP3炎症体激活,加重神经炎症反应[3]。脂联素(adiponectin, APN)是良好的胰岛素增敏剂、抗炎调节剂和抗动脉粥样硬化分子。最近研究证实,APN作为关键调节因子,不仅在代谢性疾病中发挥抗炎作用[4],而且在中枢神经系统疾病中对炎症反应同样具有抑制作用[5]。本研究探讨了APN是否通过A20/NLRP3/胱冬肽酶-1(caspase-1)途径抑制LPS诱导的小胶质细胞炎症反应,为APN治疗中枢神经系统炎症性疾病提供理论依据。
1 材料与方法
1.1 实验动物及试剂SD孕鼠购自西安交通大学实验动物中心,所有动物实验均遵循国家制定的有关实验动物保护和使用指南,并通过西安交通大学实验动物伦理委员会批准。DMEM培养基、Neurobasal培养基、胰蛋白酶和胎牛血清(美国Gibco公司),二甲基亚砜(DMSO)和LPS(来源于Escherichia Coli O55:B5)(美国Sigma公司),APN(以色列ProSpec公司),TNF-α和IL-1β酶联免疫吸附(ELISA)试剂盒(欣博盛生物科技有限公司),BCA蛋白浓度测定试剂盒及ECL发光试剂盒(美国Thermo公司),A20抗体(美国Santa Cruz公司),Cd11b、NeuN、NLRP3和caspase-1抗体(美国Abcam公司),β-actin抗体(武汉三鹰生物技术有限公司)。
1.2 原代大鼠小胶质细胞和神经元的分离培养和鉴定取新生SD大鼠大脑皮层,胰酶消化及细胞筛过滤后种植于培养瓶中。①加入完全培养基培养10~14 d后,分离纯化小胶质细胞,用小胶质细胞特异性抗体Cd11b鉴定细胞纯度,当纯度>95%时,可分组干预;②加入含有2% B27的Neurobasal培养基,待细胞贴壁后加入阿糖胞苷抑制非神经细胞生长,培养7~10 d,用神经元特异性抗体NeuN鉴定细胞纯度。
1.3 siRNA实验原代大鼠小胶质细胞纯化培养24 h后,使用control(sc-37007)或A20(sc-37656)siRNA 转染试剂进行处理。6~8 μg A20或者control siRNA加入无血清DMEM培养基37 ℃孵育细胞5 h后,换成DMEM完全培养基继续培养72 h待用。
1.4 分组与处理原代培养大鼠小胶质细胞,纯化培养24 h后,根据实验目的分为两部分:①Control组、LPS组、APN组和LPS+APN组。Control组加入等体积的PBS溶剂,LPS组LPS(100 ng/mL)[6]处理24 h,APN组在处理前(无LPS处理)1 h加入APN(10 μg/mL)[7],LPS+APN组在LPS处理前1 h加入APN。②Control siRNA组、A20 siRNA组、Control siRNA+LPS组和A20 siRNA+LPS组。所有组别在LPS或者对照溶剂处理前1 h加入APN。Control siRNA组使用control siRNA 转染细胞,A20 siRNA组使用A20 siRNA转染细胞,control siRNA+LPS组在control siRNA转染细胞后LPS处理24 h,A20 siRNA+LPS组在A20 siRNA转染细胞后LPS处理24 h。
1.5 实时定量PCR(q-PCR)法检测各组细胞TNF-α和IL-1β的mRNA转录水平将原代小胶质细胞分为4组(control、APN、LPS和LPS+APN组)种植于6孔板,给予相应的处理后,Trizol提取细胞总RNA,按照q-PCR试剂盒说明书进行逆转录和q-PCR分析,检测细胞TNF-α和IL-1β mRNA的表达。所采用的引物序列见表1。反应条件:95 ℃ 5 min,预热变性;95 ℃ 10 s,变性;60 ℃ 30 s,退火;72 ℃,延伸1 min,共40个循环。基因的相对表达量用2-ΔΔCT法进行计算,结果以目的基因与β-actin mRNA表达值的比值表示。

表1 各组细胞中TNF-α和IL-1β的mRNA转录水平
1.6 酶联免疫吸附(ELISA)法检测各组细胞TNF-α和IL-1β的分泌情况LPS干预24 h后收取各组细胞上清,测定各组细胞中TNF-α和IL-1β的分泌量,每个样本设3个复孔,操作步骤严格按照试剂盒说明书进行。
1.7 四甲基偶氮唑盐(MTT)法检测小胶质细胞对神经元活力的影响原代培养大鼠小胶质细胞和神经元,LPS刺激小胶质细胞24 h建立小胶质细胞炎症模型,应用Transwell小室共培养原代小胶质细胞和神经元(1∶2.5),上室接种小胶质细胞,下室接种神经元,共培养48 h。按照试剂盒说明书,通过MTT法检测神经元的存活率,每组设5个复孔。用酶标仪490 nm吸光度值计算细胞相对存活率,细胞相对存活率=(给药-空白)/(阴性对照-空白)×100%。
1.8 免疫印迹法检测A20、NLRP3和caspase-1的表达将原代小胶质细胞分为4组(Control、APN、LPS和LPS+APN组)种植于6孔板,给予相应的处理后RIPA裂解液提取细胞总蛋白。SDS-PAGE凝胶电泳及转膜后,室温封闭1 h。抗A20(1∶200)、抗NLRP3(1∶1 000)、抗caspase-1(1∶1 000)或抗β-actin(1∶1 000)抗体4 ℃孵育过夜。二抗室温孵育1 h及洗膜后,采用Bio-Rad凝胶成像系统采集图像并进行灰度值分析,相对蛋白表达量以目的蛋白灰度值/内参灰度值表示。

2 结 果
2.1 APN对LPS诱导小胶质细胞内TNF-α和IL-1β的mRNA转录水平的影响与Control组相比,APN组小胶质细胞炎症因子TNF-α和IL-1β的mRNA转录水平无明显改变,LPS组小胶质细胞TNF-α和IL-1β的mRNA转录水平升高(P<0.01);LPS+APN组小胶质细胞TNF-α(P<0.05)和IL-1β(P<0.01)的mRNA转录水平较LPS组明显降低(图1)。
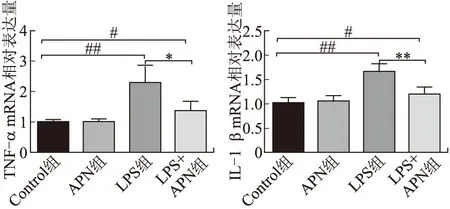
图1 各组细胞中TNF-α和IL-1β mRNA的表达
2.2 APN对LPS诱导小胶质细胞TNF-α和IL-1β分泌量的影响与Control组相比,APN组小胶质细胞炎症因子TNF-α和IL-1β的分泌量无明显改变,LPS组小胶质细胞TNF-α和IL-1β的mRNA分泌量升高(P<0.01);LPS+APN组小胶质细胞TNF-α和IL-1β的分泌量较LPS组明显降低(P<0.01,图2)。

图2 各组细胞中TNF-α和IL-1β的分泌量
2.3 APN处理LPS诱导的小胶质细胞对神经元活力的影响LPS刺激小胶质细胞24 h建立小胶质细胞炎症模型,应用Transwell小室共培养原代小胶质细胞和神经元,观察各组小胶质细胞对神经元活力的影响(图3A)。Control组、APN组、LPS组和LPS+APN组神经元相对存活率分别为(98.63±1.42)%、(98.86±1.01)%、(54.32±7.16)%、(71.74±10.03)%,组间比较差异有统计学意义(P<0.01,图3B)。
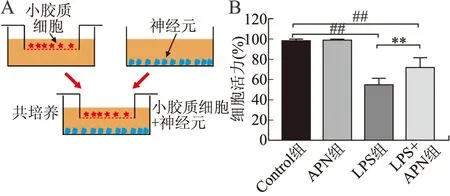
图3 APN处理小胶质细胞对神经元活力的影响
2.4 APN对LPS诱导小胶质细胞A20、NLRP3和caspase-1蛋白表达的影响与control组相比,APN组小胶质细胞A20、NLRP3和caspase-1蛋白表达无明显改变,LPS组小胶质细胞A20、NLRP3和caspase-1蛋白表达增加(P<0.01);而与LPS组相比,LPS+APN组小胶质细胞A20蛋白表达明显增加,NLRP3和caspase-1蛋白表达降低(P<0.01,图4)。

图4 Western blotting法检测A20、NLRP3和caspase-1蛋白表达
2.5 APN通过A20抑制小胶质细胞NLRP3和caspase-1蛋白表达与control siRNA组相比,A20 siRNA组A20表达明显降低、NLRP3和caspase-1蛋白表达无明显改变,control siRNA+LPS组小胶质细胞A20、NLRP3和caspase-1蛋白表达增加(P<0.01);而与control siRNA + LPS组相比,A20 siRNA+LPS组小胶质细胞A20蛋白表达降低、NLRP3和caspase-1蛋白表达增高(P<0.01,图5)。
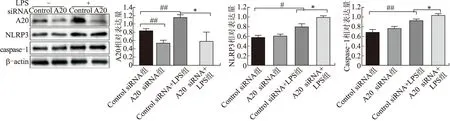
图5 Western blotting法检测A20、NLRP3和caspase-1蛋白表达
3 讨 论
小胶质细胞激活及其释放的细胞因子(TNF-α、IL-6和IL-1β等)可通过改变神经系统的兴奋性和降低神经细胞活力促进中枢神经系统炎症性疾病的发生发展[8],抑制小胶质细胞活化以及炎症因子释放是治疗中枢神经系统炎症性疾病的重点。新近研究发现,APN能促进抗炎细胞因子含量增加,减少炎性细胞因子的数量,发挥抗炎作用,从而避免过度免疫反应[9-11]。本课题组的前期研究发现,APN通过调控海马线粒体氧化应激和凋亡抑制脓毒症引起的脑损伤[12],但其机制尚不明确。
A20是相对分子质量约80 000的胞内锌指蛋白,同时又是重要的负性炎症调节因子,相较于其他神经细胞,A20蛋白在小胶质细胞高表达[3],A20缺失导致NF-κB蛋白表达显著增高[13]。TNF-α和IL-1β是与中枢神经系统炎症性疾病有关的主要细胞因子,在炎症早期主要由小胶质细胞分泌并启动细胞因子瀑布,而NF-κB在细胞因子瀑布的调节中起重要作用,它能够调节TNF-α和IL-1β的表达及分泌[14]。本研究中,APN能抑制这两种细胞因子的分泌,提示APN可能通过抑制小胶质细胞分泌TNF-α和IL-1β来调控中枢神经系统炎症性疾病。在本研究中,体外LPS刺激小胶质细胞后A20表达增加,这与以往的研究相似。APN干预后明显增加LPS诱导的A20蛋白表达,而细胞内TNF-α和IL-1β的mRNA和细胞分泌量则明显降低,表明APN通过上调A20蛋白表达抑制小胶质细胞分泌TNF-α和IL-1β。
炎性小体的过度激活可导致感染、自身免疫病和神经退行性病变等,但对于抑制炎性小体活性的机制研究仍然欠缺。之前的研究发现,A20是NF-κB的抑制因子,同时还是一种泛素化修饰酶,它不仅调控脑脊髓炎模型小胶质细胞炎症小体激活和中枢神经系统炎症[3],而且删除A20可引起巨噬细胞NF-κB依赖的NLRP3炎症小体激活和神经炎症[15]。NLRP3是炎症体家族成员之一,通过活化caspase-1来间接调控IL-1β和IL-18的成熟和分泌[16]。Caspase-1又称IL-1β转化酶,是caspase家族中与炎症密切相关的主要成员之一,通过激活炎症因子IL-1β并促进其释放参与调控蛋白酶级联反应、炎症反应和细胞凋亡等,从而放大炎症反应,加重神经退行性疾病的进展[17]。有研究表明,APN与调节NLRP3炎性小体介导炎症有关[18-19],但其确切的保护机制尚不清楚。本研究结果显示,使用APN预先干预,在明显降低小胶质细胞TNF-α和IL-1β的mRNA转录水平和分泌量的同时降低A20 、NLRP3及caspase-1蛋白含量,提示APN对小胶质细胞炎性反应的调控可能与降低TNF-α和IL-1β含量以及抑制NLRP3炎性小体活性有关,但其具体机制有待进一步探讨。本研究的创新之处在于,探索了APN抑制小胶质细胞炎症反应的相关分子机制,揭示其作用可能是通过诱导A20表达抑制NLRP3炎性小体激活来实现的。
综上所述,本研究采用APN干预上调小胶质细胞A20蛋白的表达,从而阻断LPS诱导的炎症因子表达和NLRP3炎性小体激活,揭示了APN抑制LPS诱导的小胶质细胞炎症反应与A20/NLRP3/caspase-1信号通路有关。但作为一种新型的中枢神经系统炎症抑制因子,APN抑制小胶质细胞炎症反应的机制仍不完善,值得进一步研究。
