缺氧环境下YAP1的表达对子痫前期胎盘血管形成的影响及作用机制
2021-07-09潘怡霞王慰敏
潘怡霞,刘 睿,卫 婵,马 强,王慰敏
(1. 西安交通大学第一附属医院妇产科,陕西西安 710061;2. 浙江大学医学院附属妇产科医院,浙江杭州 310012;3. 西安市长安区妇幼保健计划生育服务中心,陕西西安 710100;4. 西安交通大学第一附属医院周围血管科,陕西西安 710061)
妊娠期高血压疾病是妊娠期与高血压并存的一组疾病,发生率为5%~12%,其中之一的子痫前期为孕产妇最常见的并发症,发病率为2%~8%,严重影响母婴健康,每年可致大约70 000孕产妇和500 000围产儿死亡[1]。特别在我国“二孩”政策开放后,随着高龄孕产妇数量的增加,子痫前期的发病率亦有上升趋势[2]。子痫前期的病因和发病机制至今仍未阐明,其中“两阶段”学说目前被广为接受,氧化应激反应介导的血管内皮细胞功能损伤是子痫前期的基本病理变化之一[3]。Hippo信号通路是在果蝇体内发现的高度保守信号通路,主要通过一系列激酶级联磷酸化反应来抑制细胞增殖和促凋亡。Yes-相关蛋白(Yes-associated protein, YAP)是Hippo信号通路上最核心的一种转录共激活因子,YAP1已被证实在多种实体肿瘤组织和肿瘤细胞株(肝脏、胃、结直肠、卵巢、膀胱等)中过表达,参与肿瘤细胞增殖及抗凋亡。有研究提示,YAP1在乳腺癌中发挥抑癌基因的作用[4]。最新的研究指出,Hippo-YAP1通路在正常妊娠和妊娠并发症中发挥着独特作用,如着床失败、子痫前期和习惯性流产[5],然而,YAP1在子痫前期发生发展中的具体作用鲜有报道。本课题组的前期研究发现,YAP1参与的Hippo信号通路通过调控滋养细胞的侵袭和增殖,可能在重度子痫前期的发病机制中发挥重要作用[6]。前期研究主要从组织学角度证实了YAP1的表达与子痫前期发病的相关性。为了进一步研究YAP1与子痫前期发病的相关性,本研究拟在本课题组前期研究基础上,利用缺氧环境模拟妊娠初期胎盘形成时的生理性低氧状态,使用YAP1抑制剂维替泊芬(verteporfin, VP),探究缺氧环境下抑制YAP1基因表达对人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC)凋亡、迁移、侵袭及血管形成能力的影响及参与子痫前期发生的可能机制。
1 材料与方法
1.1 细胞系及培养条件细胞复苏与培养:培养细胞系采用HUVEC系。将HUVEC从液氮中取出复苏后,培养于含100 mL/L胎牛血清的RPMI 1640培养基中(Gibco C11875500BT),置于含50 mL/L CO2、37 ℃恒温细胞培养箱中孵育。将复苏成功的细胞培养传至2代后开始实验。缺氧处理条件参考杨晓涛等[7]探索的最佳模拟PE体外细胞模型条件,即10 mL/L O2培养。后续实验细胞在常氧或缺氧环境下(10 mL/L O2+940 mL/L N2+50 mL/L CO2)培养,缺氧组使用的细胞培养基提前缺氧处理12 h。
1.2 MTT法确定维替泊芬实验药物浓度选择处于对数生长期的HUVEC,胰酶消化重悬后按105/mL细胞密度接种于96孔板,每孔100 μL,共分5组药物浓度,每组设8个复孔,共10板。细胞贴壁后在缺氧环境孵箱中培养24 h后,各组分别加入0、4、8、12、16 μg/mL的维替泊芬[VP,溶解于二甲基亚砜(DMSO)],缺氧环境下继续孵育12、24 h后分别吸弃培养液,加入100 μL完全培养基,并加入10 μL MTT。继续避光复氧孵育4 h后,吸弃培养基,每孔加入150 μL DMSO,震荡10 min后,酶标仪测定各孔490 nm波长处吸光度(A)值。以各孔A值与空白对照A值的比值作为细胞活性值。实验重复3次。根据MTT结果计算维替泊芬的IC50值,根据所得IC50值后续实验选用16 μg/mL的维替泊芬进行。
1.3 流式细胞术检测细胞凋亡情况实验分为缺氧对照组和缺氧实验组(即缺氧VP组,使用维替泊芬16 μg/mL)。收集HUVEC,用胰蛋白酶消化并重悬细胞,接种于6孔板中,每孔5×105个。待细胞贴壁后,实验组加入维替泊芬使其终质量浓度为16 μg/mL,对照组加入等量DMSO。各组在缺氧环境下分别孵育细胞 12、24 h。收集细胞原培养基至对应标号的15 mL离心管,PBS洗涤2次,胰酶消化后用完全培养基吹打使细胞完全分散,移至对应离心管后离心弃上清。使用PBS洗涤2次,加结合缓冲液重悬,调整细胞密度为1×106/mL;取100 μL重悬的细胞至流式管,加入5 μL的Annexin V-FITC和5 μL的PI,轻轻混匀,室温(20~25 ℃)避光孵育15 min。每管加入400 μL结合缓冲液,用300目(孔径40~50 μm)尼龙网过滤,1 h内上机检测细胞凋亡情况并计算凋亡率。
1.4 细胞划痕实验检测细胞迁徙能力实验分组同前。收集HUVEC,用胰蛋白酶消化并重悬细胞,接种于6孔板中。待细胞汇合度约90%后,用100 μL微量移液器枪头在6孔板内垂直划痕,PBS漂洗3次,去除脱落细胞,每孔加入2 mL无血清RPMI 1640培养基,于倒置光学显微镜下拍照,记为0 h划痕宽度。各实验组加入维替泊芬使其终质量浓度为16 μg/mL,对照组加入等量DMSO。各组在缺氧环境下分别孵育细胞12、24 h后,分别在相同位置拍照测量划痕宽度,并计算划痕愈合率,以此反映细胞的迁移能力。划痕愈合率(%)=(0 h划痕宽度-12 h或24 h划痕宽度)/0 h划痕宽度×100%。
1.5 Transwell小室检测细胞侵袭能力实验分组同前。用无血清培养基按体积比1∶7稀释Matrigel,将Transwell小室放入24孔板中,加入50 μL稀释后的Matrigel于上室中,于37 ℃恒温无菌培养箱中孵育30 min,吸出Matrigel表面的液体。收集细胞,用胰蛋白酶消化并重悬细胞,调整细胞密度为2×105/mL。上室加入200 μL细胞悬液,下室加入500 μL含100 mL/L FBS的RPMI 1640培养液。向各组上室中分别加入终质量浓度为16 μg/mL的维替泊芬和等量DMSO,于37 ℃缺氧环境培养箱中分别培养12、24 h。取出小室,用棉签擦去小室内未侵袭的细胞,40 g/L多聚甲醛固定10 min,晾干后加入结晶紫染色10 min,PBS漂洗3次,晾干后在高倍显微镜下随机选择5个视野,计数穿膜细胞数,并计算平均值。
1.6 小管形成实验检测血管生成能力实验分组同前。将基质胶置于4 ℃冰箱融化,同时将96孔板和枪头在4 ℃冰箱预冷。在96孔板中铺32 μL基质胶,实验操作在冰上进行,37 ℃孵育30 min,等待基质胶完全凝固。收集HUVEC,用胰蛋白酶消化并重悬细胞,PBS洗涤2次后使用无血清的RPMI 1640培养基重悬细胞,调整细胞密度为2×105/mL。分别取1 mL加入EP管中,按照实验分组情况加入相对应的药物,取100 μL各组细胞悬液,缺氧环境培养12 h后在倒置显微镜下随机选取5个视野拍照观察成血管情况。使用ImageJ软件对结果进行分析。
1.7 Western blotting检测YAP、TEAD1蛋白表达实验分为常氧对照组、常氧VP组(维替泊芬16 μg/mL)、缺氧对照组和缺氧VP组(维替泊芬16 μg/mL)。按照实验分组在常氧或缺氧环境下孵育细胞,培养12 h及24 h后分别收集样本。提取各组HUVEC中的总蛋白。用含PMSF的裂解液在冰上裂解30 min,用BCA(Bicinchoninic acid)蛋白定量试剂盒对提取的蛋白进行定量后分装,-80 ℃冻存备用。各组取30 μg总蛋白上样,SDS-PAGE凝胶电泳分离后电转移至PVDF膜。封闭后加入相应一抗及二抗。PVDF膜采用化学发光法显色,以β-actin为内参照计算各目的蛋白的相对表达量。

2 结 果
2.1 维替泊芬在缺氧环境下对HUVEC增殖、凋亡的影响用不同浓度的维替泊芬处理HUVEC,在缺氧环境下分别培养12 h及24 h,通过MTT法测定A值,计算细胞存活率。结果证实,在缺氧环境下,维替泊芬可抑制HUVEC增殖,除最低药物浓度4 μg/mL除外,在相同作用时间下,随着药物浓度的增加,细胞存活率呈下降趋势;且在同浓度药物处理时,随着作用时间延长,细胞存活率降低。通过GraphPad Prism 8.0计算出缺氧环境下维替泊芬处理HUVEC 12、24 h的IC50值分别为13.26、16.74 μg/mL,后续均选择维替泊芬16 μg/mL进行实验。流式细胞术检测结果显示,在缺氧环境下,维替泊芬处理细胞12、24 h后细胞凋亡率均高于对照组[12 h:(9.75±1.56)%vs.(41.61±4.54)%;24 h:(10.11±1.86)%vs.(50.18±4.78)%],差异具有统计学意义(t=11.51、13.55,P<0.01,图1)。

图1 维替泊芬在缺氧环境下对HUVEC增殖、凋亡的影响
2.2 维替泊芬对缺氧环境下HUVEC迁移、侵袭能力的影响细胞划痕实验结果显示,缺氧环境下,维替泊芬(后续实验VP浓度均为16 μg/mL)处理12、24 h后细胞迁徙能力均低于对照组[12 h:(20.51±2.16)%vs.(12.75±2.03)%;24 h:(30.10±2.96)%vs.(17.52±2.75)%],差异均有统计学意义(t=4.54、5.41,P<0.05,图2A、图2B)。Transwell小室实验结果显示,在缺氧环境下,维替泊芬处理12、24 h后细胞侵袭能力均低于对照组[12 h:(48.60±2.61)vs.(20.80±2.86);24 h:(61.00±2.74)vs.(29.60±1.52)],差异均有统计学意义(t=16.05、22.43,P<0.01,图2C、图2D)。结果表明,在缺氧环境下,维替泊芬能够抑制HUVEC的迁移、侵袭能力。

图2 维替泊芬在缺氧环境下对HUVEC细胞迁移、侵袭能力的影响
2.3 维替泊芬对缺氧环境下HUVEC血管生成能力的影响血管生成实验结果显示,维替泊芬(16 μg/mL)处理HUVEC 12 h后细胞分支数低于对照组,差异有统计学意义(t=7.38,P<0.001,图3A、图3B)。结果表明,在缺氧环境下,维替泊芬可以抑制HUVEC的血管生成能力。
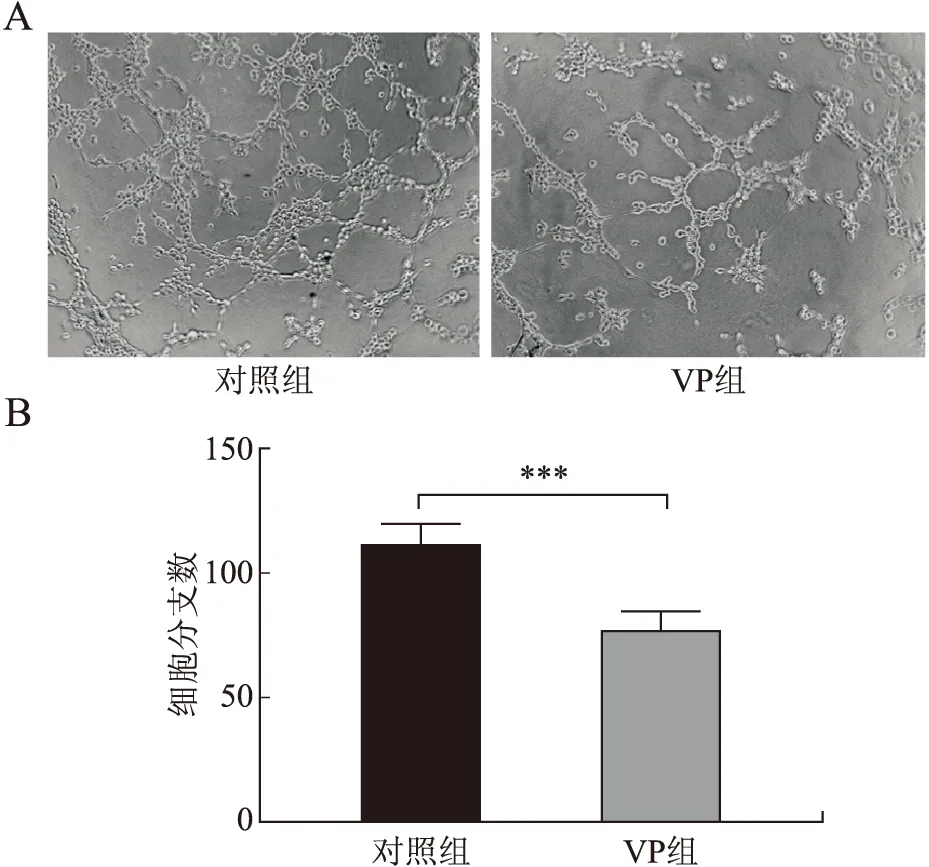
图3 维替泊芬在缺氧环境下对HUVEC细胞血管生成能力的影响
2.4 维替泊芬对YAP1及其下游信号通路的影响Western blotting结果显示,在常氧环境下,维替泊芬(16 μg/mL)处理HUVEC 12 h后YAP1及其下游TEAD1蛋白表达均低于对照组(t=13.94、19.04,P<0.001,图4A-4C);处理24 h后,YAP1及其下游TEAD1蛋白表达均低于对照组(t=14.42、5.62,P<0.01,图4A-4C)。在缺氧环境下,维替泊芬处理HUVEC 12 h后YAP1蛋白表达均低于对照组,差异有统计学意义(t=12.26,P<0.001,图4D、图4E),但TEAD1培养12 h后两组表达变化不明显(P=0.127,图4D、图4F);在维替泊芬处理24 h后,HUVEC中YAP1和TEAD1蛋白表达低于对照组,差异有统计学意义(t=14.09、9.39,P<0.01,图4D-4F)。结果表明,无论在常氧或缺氧环境下,不同作用时间的维替泊芬均能抑制YAP1蛋白的表达,增加药物作用时间后,其下游转录因子TEAD1表达也发生降低。

图4 维替泊芬对YAP1及TEAD1蛋白表达的影响
3 讨 论
子痫前期是一种与妊娠相关的多系统疾病,严重威胁母婴健康。子痫前期的病因和发病机制有很多学说,目前认为多种因素、机制及通路均参与子痫前期的发病[8]。有学者认为,子痫前期与胎盘浅着床及缺血再灌注诱发的氧化应激有关[9],导致终端绒毛体积/面积减少、促炎细胞因子升高、炎症反应过度及血管生成失衡[10]。这些改变引起了内皮细胞功能障碍和炎症,最终导致母胎不良结局。近年来研究表明,Hippo信号通路通过调控细胞增殖与凋亡参与器官发育、干细胞全能性维持等过程,并被证实在肿瘤发生进展及转移过程中发挥了重要作用。YAP1基因是Hippo信号通路中最核心的转录共激活因子,非磷酸化的YAP1/TAZ转运入细胞核内,作为辅激活因子与转录因子相结合调控目的基因的表达。TEAD1-4作为主要的转录因子介导了YAP1/TAZ绝大部分的转录激活效应[11]。其中TEAD1与YAP1具有高水平的表达相关性,二者形成YAP-TEAD复合物,共同调节下游原癌基因c-myc、Axl和血管生成因子等表达,调控细胞增殖和存活[12]。YAP-TEAD复合物参与的生物学过程主要包括细胞黏附、血管新生、DNA转录及转录调控和细胞转移等。本课题组前期的研究证实,与正常妊娠胎盘组织相比,重度子痫前期患者胎盘中YAP1、TAZ的mRNA及蛋白表达水平下降,而其上游的蛋白激酶MST1/2表达明显上升。另外,本课题组前期的研究还证明,在滋养细胞系HTR-8/SVneo中,抑制YAP1表达组细胞的侵袭能力明显减弱,过表达YAP1组细胞则侵袭能力明显增强[6]。
综上所述,Hippo-YAP1信号通路通过调控滋养细胞的侵袭和增殖,可能在重度子痫前期的发病机制中发挥重要作用。
既往的研究表明,缺氧状态能够促进毛细血管生成及内皮细胞迁移[13]。在妊娠初期,由于胚胎及胎盘抗氧化能力尚未建立,子宫内处于生理性低氧状态,以保护胚胎及胎盘免受氧化损伤。低氧促进血管内皮细胞增殖、迁移及毛细血管管状形成,是保持绒毛内血管生成的重要因素。GENBACEV等[14]研究表明,细胞滋养层细胞及绒毛组织在2%氧浓度下,细胞有丝分裂增加、增殖活跃;DUNWOODIE等[13]研究表明,妊娠早期低氧通过调节绒毛膜滋养细胞分泌的血管内皮生成因子(VEGF)及其受体表达,促进绒毛小叶中血管生成,而氧浓度过大则会抑制血管的生成。这些研究都提示,低氧对胎盘的正常形成起到至关重要的作用。
结合本课题组前期研究结果,我们推测Hippo-YAP1信号通路的激活可能影响低氧环境下胎盘血管生成及功能,从而促进子痫前期的发生。目前子痫前期胎盘中YAP1蛋白表达的下降是否影响胎盘血管的生成尚未见报道。维替泊芬是一种光学增强剂,它可以阻断YAP-TEAD 复合物的形成并阻断下游因子的表达,抑制细胞增殖,影响血管生成[15]。本研究应用维替泊芬下调HUVEC中YAP1蛋白表达,以检测缺氧环境下下调YAP1是否影响HUVEC的活性及功能。结果显示,在缺氧环境下使用低浓度维替泊芬(4 μg/mL)时,HUVEC增殖增加,这可能与低氧环境刺激促进血管内皮细胞增殖有关,但随着药物浓度的增加,缺氧环境下维替泊芬能够抑制HUVEC增殖、促进细胞凋亡,并且能够降低其迁移、侵袭能力和血管生成能力。说明在缺氧环境下,YAP1蛋白的表达降低可能通过降低血管内皮细胞迁移、侵袭能力,促使细胞过度凋亡而影响胎盘血管生成,导致多器官功能紊乱,参与子痫前期发生。蛋白免疫印迹的结果说明,无论在常氧或缺氧环境下,维替泊芬均能有效抑制YAP1蛋白的表达。TEAD1作为YAP1的下游转录因子,随着抑制时间的延长,其蛋白表达水平也出现了下降。
综上所述,本研究表明,在缺氧环境下维替泊芬通过抑制YAP1及其下游TEAD1的表达,能够抑制HUVEC增殖,促进细胞凋亡,并显著降低其迁移、侵袭能力和血管生成能力,进一步证实了Hippo-YAP1信号通路可能通过调控血管内皮细胞增殖和侵袭,影响子痫前期胎盘血管形成,参与子痫前期的发生。但本研究仅为体外细胞学实验,其具体参与机制还需进一步探索和确证。
