褪黑素上调SIRT1改善高糖诱导原代心肌细胞损伤的机制研究
2021-06-18艾永飞苏菲菲杨竞霄尚福军
艾永飞,刘 静,苏菲菲,杨竞霄,尚福军
(空军军医大学第二附属医院心血管内科,西安 710038;*通讯作者,E-mail:434979751@qq.com)
糖尿病是严重威胁人类健康的重要疾病之一,2019年国际糖尿病联盟(IDF)(http://www.diabetesatlas.org/)最新数据显示,2019年全球约有4.63亿糖尿病患者,预计到2045年全球将有7亿糖尿病患者。由于糖尿病是心血管疾病的重要危险因素之一[1],糖尿病引起的心血管疾病发病率和死亡率的增加已经成为全球健康防治领域的重要难题。糖尿病所造成的心脏结构和功能的改变主要表现为心肌肥厚、心肌舒张功能不全、心肌间质纤维化和心肌细胞凋亡[1],但其具体发生机制尚不明确,并缺少有效的防治措施。研究表明,高血糖能够直接引起心肌细胞损伤和凋亡[2],而心肌细胞作为终末端分化细胞,其再生与增殖极弱,因此心肌细胞的损伤与凋亡被认为是高血糖引发心血管疾病发生发展的关键原因。
褪黑素是由哺乳动物松果体分泌在全身多个脏器均发挥调节作用的一种胺类激素,其分泌具有昼夜节律性,夜间合成较多,白天分泌较少[3]。研究显示,褪黑素在心血管领域具有减轻心肌缺血损伤和心肌肥厚,防治心衰等疾病的作用。最新研究也显示:褪黑素能够改善睡眠,治疗2型糖尿病[3,4]。然而,褪黑素在糖尿病心肌病中的生物学作用及其机制尚未明确,本研究拟从细胞水平探讨褪黑素在高糖诱导的原代心肌细胞损伤的作用以及机制,为糖尿病心肌病的治疗提供新的实验依据和理论依据。
1 材料与方法
1.1 实验动物与试剂
C57BL/6乳鼠,出生1-3 d,购自第四军医大学实验动物中心;褪黑素、胶原酶Ⅱ购自美国Sigma公司、沉默信息调节因子2相关酶1(sirtuin1,SIRT1)、Beclin1和自噬相关5同源物(autophagy related 5 homolog,Atg5)购自美国CST公司;cleaved Caspase-3、Bcl-2-associated X的蛋白质(Bcl-2-associated X,Bax)和B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)购于美国Abcam公司;GAPDH购自美国Santa Cruz公司,TUNEL细胞凋亡检测试剂盒、BCA蛋白定量试剂盒、RIPA强裂解液及5×loadding buffer购自上海碧云天生物有限公司;PVDF膜及ECL发光液购于美国Millipore公司;EX527购自美国Selleck Chemicals公司;First Strand cDNA Synthesis Kit和SYBR Premix Ex Taq TM Ⅱ购自日本Takara公司;Cell Counting Kit-8(CCK-8)、丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒购自南京建成科技有限公司;高糖DMEM、低糖DMEM培养基、胎牛血清购自美国Hyclone公司。
1.2 实验方法
1.2.1 原代心肌细胞培养与实验分组 取新生3 d内的C57BL/6小鼠,3%异氟烷深度麻醉后,脱颈处死。750 ml/L乙醇消毒,打开胸腔,摘取心脏,去心房,并用预冷的DPBS漂洗3次。将心室肌剪为<1 mm3的组织块,静置吸弃DPBS,加入5 ml的0.5 mg/ml的胶原酶Ⅱ,37 ℃振摇消化20 min;加入含有10% FBS的培养基终止消化,吸取上层混悬液,下层组织再次加入消化液进行消化,直至组织块完全消化。将收集的上层混悬液经200目滤网过滤,收集滤液至离心管,800 r/min离心5 min,收集细胞,然后加入含有10%FBS的培养基,按照5×105个/皿的细胞密度进行接种,然后在37 ℃、5% CO2的细胞培养箱中培养24 h。为了检测高糖对心肌细胞的损伤,我们将原代心肌细胞分别用5.5,11,22,33 mmol/L D-葡萄糖刺激处理时间为24 h。
为了阐明褪黑素上调SIRT1改善高糖诱导的原代心肌细胞损伤的作用机制,我们将原代心肌细胞分为对照组(Con组)、褪黑素对照组(Con+Mel组)、高糖对照组(HG组)、高糖+褪黑素组(HG+Mel组)、SIRT1抑制剂组(HG+Mel+EX527组)。Con组为5.5 mmol/L D-葡萄糖处理24 h;褪黑素对照组(Con+Mel组):在添加5.5 mmol/L D-葡萄糖培养基同时添加褪黑素,使其终浓度为100 μmol/L;高糖对照组(HG组):33 mmol/L D-葡萄糖;高糖+褪黑素组(HG+Mel组):在添加33 mmol/L葡萄糖培养基同时添加褪黑素,使褪黑素终浓度为100 μmol/L,处理24 h。SIRT1抑制剂组(HG+Mel+EX527组):在添加33 mmol/L葡萄糖培养基同时添加褪黑素和EX527,使褪黑素终浓度为100 μmol/L,EX527终浓度为10 μmol/L,处理24 h。
1.2.2 CCK-8检测原代心肌细胞活力 按照每孔接种约4×103个细胞将原代乳鼠心肌细胞接种于96孔培养皿中,然后按照方法1.2.1中分组进行干预处理24 h,干预结束后弃掉培养基,PBS洗涤,然后加入200 μl高糖DMEM培养基(无血清)和20 μl CCK-8溶液于96孔板中,在37 ℃,50 ml/L CO2培养箱中培养40 min,然后使用酶标仪检测各孔在450 nm处的吸光度值。
1.2.3 SOD和MDA检测 细胞内氧化应激水平通过细胞内MDA和SOD含量进行评价,具体实验方法参照MDA和SOD试剂盒说明书进行,MDA于532 nm处测定吸光度值,SOD于波长450 nm处测定吸光度值。
1.2.4 实时定量RT-PCR检测SIRT1基因表达 提取细胞总RNA,按照反转录试剂盒(First Strand cDNA Synthesis Kit)说明书步骤,以20 μl体系进行反转录RCR,合成cDNA。引物序列见表1。之后参照定量检测试剂盒(SYBR Premix Ex Taq TM Ⅱ)进行反应,使用GAPDH作为内参,用2-ΔΔCt法计算基因的相对表达量。

表1 引物序列
1.2.5 免疫印迹(Western blot)检测SIRT、Beclin1、Atg5、Bax和Bcl-2表达 按照方法1.2.1中分组在各组细胞干预处理结束后,将其置于冰上,PBS漂洗多次,强RIPA裂解液(100 μl/106细胞)裂解20 min,细胞刮轻轻将刮取细胞转移到离心管中,4 ℃、12 000 r/min离心15 min,收集上清。上清液取出10 μl进行BCA蛋白定量,具体方法参照CA蛋白定量试剂盒说明书。剩余上清液加入1/4体积的5×loading buffer,沸水浴10 min,然后放置室温5 min,之后将其放入-80 ℃保存。SDS-PEGE配置电泳用于蛋白的分离,上样量50 μg/孔道,120 V,90 min电泳。300 mA,180 min转膜,脱脂奶粉(50 g/L)室温封闭2 h,然后在4℃下进行一抗(SIRT、Beclin1、Atg5、Bax和Bcl-2稀释比1 ∶1 000)孵育,过夜。然后TBST漂洗,加入二抗(1 ∶6 000),室温孵育2 h,TBST漂洗,进行ECL发光。
1.2.6 TUNEL法检测细胞凋亡 按照方法1.2.1中分组原代心肌细胞干预处理24 h后,弃掉原细胞培养基,PBS多次漂洗,20 μg/μl的蛋白酶K室温孵育20 min,然后进行TUNEL染色,倒置荧光显微镜采集图像,Image plus软件进行图像分析。其中染色具体步骤参照据TUNEL细胞凋亡检测试剂盒说明书。
1.3 统计学分析

2 结果
2.1 褪黑素对高糖所致原代心肌细胞活力下降和细胞损伤起到保护作用
CCK-8细胞活力检测结果显示:22,33 mmol/L D-葡萄糖刺激24 h后均造成原代乳鼠心肌细胞活力减低,且随D-葡萄糖浓度的增加,细胞相对活性下降程度递增(见图1)。与5.5 mmol/L D-葡萄糖相比,33 mmol/L D-葡萄糖造成细胞相对活性降低30%以上,差异有统计学意义(P<0.05),因此在后续我们选择33 mmol/L D-葡萄糖为高糖组模型建立的实验浓度。给予褪黑素干预后,HG+Mel组原代心肌细胞活力较HG组上升(P<0.05),但Con+Mel组细胞活力与Con组相比无显著性差异(P>0.05,见图1)。
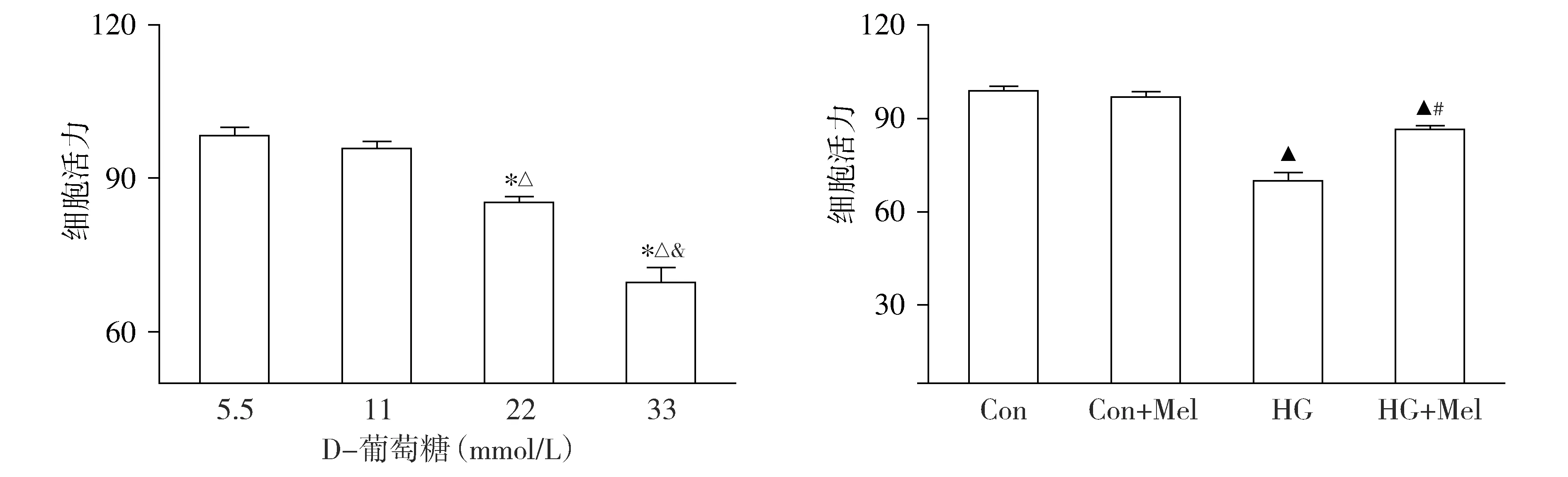
与5.5mmol/L D-葡萄糖相比,*P<0.05;与11 mmol/L D-葡萄糖组相比,△P<0.05;与22 mmol/L D-葡萄糖组相比,&P<0.05;与Con组相比,▲P<0.05;与HG组相比,#P<0.05图1 褪黑素对高糖诱导的原代心肌细胞活力的影响 (n=6)Figure 1 Effects of melatonin on cell viability of primary cardiomyocytes exposed to HG (n=6)
2.2 褪黑素减轻高糖引起的原代心肌细胞氧化应激和凋亡
与Con组相比,HG组原代心肌细胞MDA水平增加(P<0.05),而抗氧化物SOD活性下降(P<0.05)。给予褪黑素干预后,与HG组相比,HG+Mel组MDA水平降低,SOD活性增加(P<0.05);但与Con组相比,Con+Mel组MDA水平和SOD无差异(见图2)。
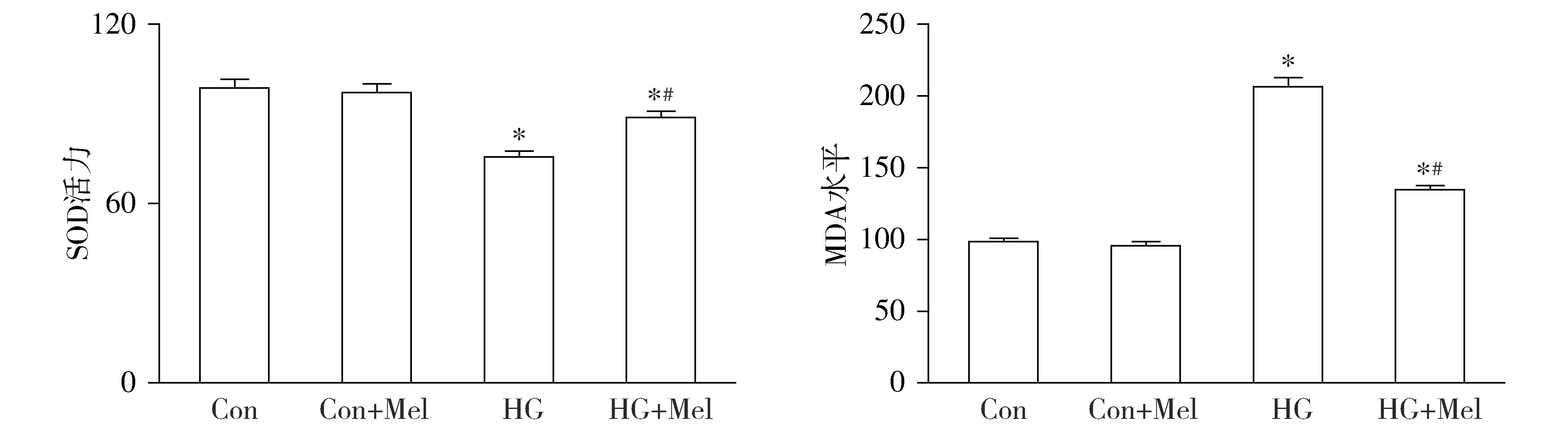
与Con组相比,*P<0.05;与HG组相比,#P<0.05图2 褪黑素对高糖引起的原代心肌细胞氧化应激的影响 (n=6)Figure 2 Effect of melatonin on oxidative stress of primary cardiomyocytes induced by high glucose (n=6)
2.3 褪黑素减轻高糖引起的原代心肌细胞凋亡
蛋白免疫迹实验显示:相比于Con组,HG组心肌细胞凋亡蛋白cleaved Caspase-3和Bax升高,抗凋亡蛋白Bcl-2下降(均P<0.05)。但相比于HG组,HG+Mel组凋亡蛋白cleaved Caspase-3和Bax的表达量降低,抗凋亡蛋白Bcl-2表达量上升(均P<0.05);同时结果也显示:相比于Con组,Con+Mel组cleaved Caspase-3和Bax表达无显著差异,但Bcl-2表达量增加(见图3)。
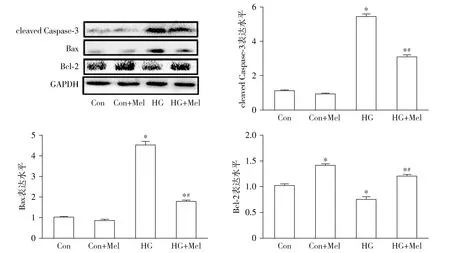
与Con组相比,*P<0.05;与HG组相比,#P<0.05图3 Western blotting检测褪黑素对高糖引起的原代心肌细胞凋亡蛋白的影响 (n=6)Figure 3 Effect of melatonin on apoptosis-related proteins in high glucose-induced primary cardiomyocytes by Western blotting (n=6)
2.4 褪黑素对高糖导致的原代心肌细胞自噬活动抑制的影响
蛋白免疫印迹实验结果显示:HG组原代心肌细胞自噬相关蛋白Beclin1,Atg5表达较Con组降低(P<0.05)。褪黑素干预后,HG+Mel组Beclin1、Atg5表达量高于HG组(P<0.05)。而且,值得注意的是Con+Mel组Beclin1,Atg5表达量也较Con组增加(P<0.05,见图4)。
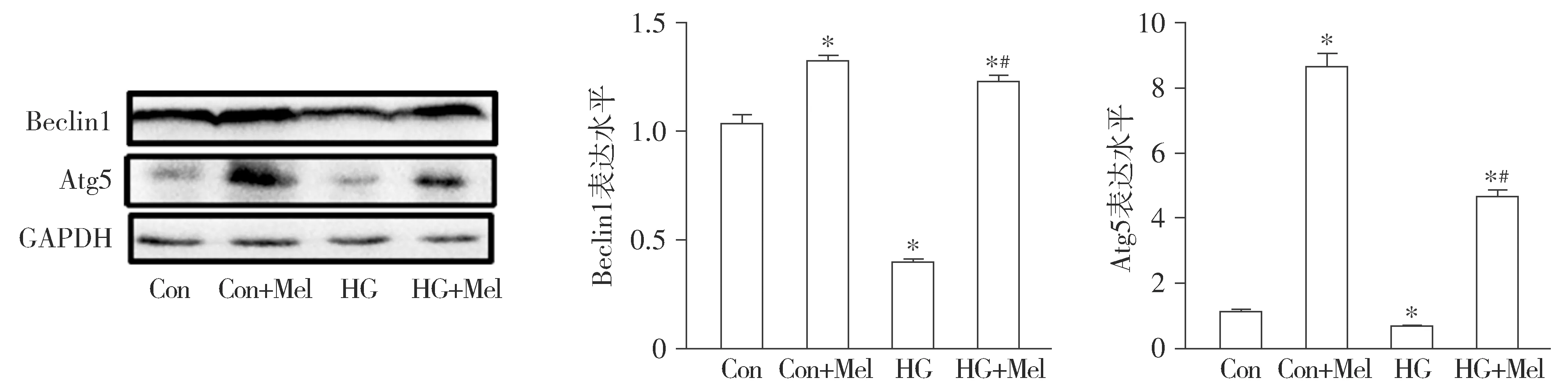
与Con组相比,*P<0.05;与HG组相比,#P<0.05图4 Western blotting检测褪黑素对高糖引起的心肌细胞自噬相关蛋白表达的影响 (n=6)Figure 4 Effect of melatonin on the autophagy-related protein expression in primary cardiomyocytes under HG conditions by Western blotting (n=6)
2.5 褪黑素在转录和翻译水平提高新生乳鼠心肌细胞中SIRT1表达
实时定量RT-PCR结果显示:相比于Con组,HG组心肌细胞SIRT1 mRNA水平下调(P<0.05);给以褪黑素处理后,Con+Mel组SIRT1表达相比于Con组增加,HG+Mel组SIRT1表达也相比于HG组增加(P<0.05)。SIRT1蛋白水平表达显示出同基因水平相似的结果,相比于Con组,HG组SIRT1蛋白表达降低。给予褪黑素处理后,Con+Mel组SIRT1蛋白表达相比于Con组上升。HG+Mel组SIRT1蛋白表达相比于HG组增加(P<0.05,见图5)。
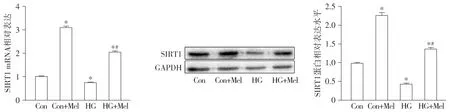
与Con组相比,*P<0.05;与HG组相比,#P<0.05图5 实时定量RT-PCR和Western blot检测褪黑素对原代心肌细胞SIRT1表达的影响 (n=6)Figure 5 Effect of melatonin on Sirt1 mRNA and protein expression in primary cardiomyocytes by RT-PCR and Western blot (n=6)
2.6 褪黑素对心肌细胞自噬的影响与SIRT1有关
本实验通过添加SIRT1的特异性小分子抑制剂EX527干预SIRT1,来研究褪黑素与SIRT1关系。与前面结果一致,与Con组相比,HG组自噬相关蛋白Beclin1和Atg5表达降低(P<0.05)。但褪黑素干预后,HG+Mel组Beclin1和Atg5表达较HG组增加(P<0.05)。添加EX527特异性抑制SIRT1活性后,HG+Mel+EX527组Beclin1、Atg5表达量相比于HG+Mel组减少(P<0.05,见图6)。

与HG组相比,#P<0.05;与HG+Mel组相比,*P<0.05图6 褪黑素通过SIRT1上调原代心肌细胞自噬 (n=5)Figure 6 Melatonin increased autophagic activities in primary cardiomyocytes under HG conditions by SIRT1 pathway (n=5)
2.7 褪黑素通过SIRT1途径减轻高糖引起的原代心肌细胞凋亡
蛋白免疫印迹结果显示:相对于HG+Mel组,添加EX527特异性抑制SIRT1活性后,HG+Mel+EX527组cleaved Caspase-3和Bax表达量增高(P<0.05),抗凋亡蛋白Bcl-2表达量下降(P<0.05,见图7)。

与HG组相比,#P<0.05;与HG+Mel组相比,*P<0.05图7 蛋白免疫印迹检测心肌细胞凋亡 (n=5)Figure 7 Apoptosis level in primary cardiomyocytes detected by western blot (n=5)
除此之外,我们通过TUNEL染色检测细胞的凋亡比率,结果显示,HG组原代心肌细胞凋亡比例高于Con组(P<0.05);给予褪黑素预处理后,HG+Mel组原代心肌细胞凋亡比例低于HG组(P<0.05);Con+Mel组原代心肌细胞凋亡与Con组相比无差异(P>0.05);添加EX527特异性抑制SIRT1活性后,HG+Mel+EX527组原代心肌细胞凋亡比例高于HG+Mel组(P<0.05,见图8)。

与Con组相比,*P<0.05;与HG组相比,#P<0.05;与HG+Mel组相比,△P<0.05图8 TUNEL染色检测原代心肌细胞凋亡 (×20)Figure 8 The apoptosis level in primary cardiomyocytes by TUNEL staining (×20)
3 讨论
糖尿病是排除年龄、高血压、肥胖和冠心病后的心血管疾病的独立危险因素,它能够造成心脏结构上的改变,如心肌肥大、纤维化、细胞坏死和凋亡等,进而导致心脏功能减退,最终导致心力衰竭[5]。尽管目前对于糖尿病引发的心血管疾病发生的机制尚不明确,但是高糖直接诱导的心肌细胞的损伤和凋亡被认为是糖尿病引发心血管疾病发生病理改变的关键因素。因此,深入研究高糖诱导的心肌细胞损伤和凋亡的发生机制及其防治措施对糖尿病心血管疾病的防治具有重要意义。
研究表明,高糖导致的心肌细胞凋亡增多可能与氧化应激的失调密切有关[6]。在正常生理情况下,细胞内产生的活性氧可被SOD抗氧化物有效清除,但在病理条件下抗氧化物活性减低,活性氧难以被消除,活性氧在细胞累积过多,进而造成细胞内容物被氧化,细胞凋亡发生。本研究发现与文献报道一致[7],高糖导致细胞内活性氧生成增多和清除能力的下降,细胞凋亡增加,具体表现:HG组较Con组心肌细胞MDA表达增高,SOD活性下降,心肌细胞凋亡比率上升、凋亡蛋白cleaved Caspase-3和Bax表达上升,抗凋亡蛋白Bcl-2表达量下降(P<0.05)。褪黑素作为一种胺类激素,具有高度的亲脂性,可以通过循环系统进入几乎全身各个组织细胞发挥抗炎和抗氧化应激等作用[3,4]。但褪黑素是否能够抑制高糖导致的心肌细胞凋亡,其机制如何,是否与抗氧化应激相关暂不清楚。我们的研究从细胞水平探讨褪黑素在高糖诱导的原代心肌细胞损伤和凋亡的作用和相关机制。我们发现,添加褪黑素可抑制高糖引起的MDA生成,并增加抗氧化物SOD活性,抑制高糖引起原代心肌细胞凋亡,抑制cleaved Caspase-3和Bax表达上调,促进Bcl-2的表达。而且有趣的是,我们结果也显示添加褪黑素不会引起正常对照组细胞氧化应激水平和凋亡水平的增加,但却促进了正常对照组细胞抗氧化物SOD活性的提高,增加了抗凋亡蛋白Bcl-2的表达。以上结果提示:褪黑素可能通过调控细胞凋亡和氧化应激而发挥抗高糖毒性的心肌保护作用。
沉默信息调节因子2相关酶1(sirtuin1,SIRT1)是一种NAD+依赖的组蛋白去乙酰化酶,它通过对包括组蛋白和转录因子在内的多种蛋白去乙酰化,进而在调节细胞分化、衰老、凋亡、应激应答以及衰老等方面发挥重要作用[8]。SIRT1由催化区域和催化区域外的N端区域和C端区域两个部分,共747个氨基酸组成。目前,研究发现SIRT1在包括大脑、心脏、肝脏、胰腺、骨骼肌、脾脏及脂肪组织等多个身体器官广泛表达,参与转录调节、染色质修饰、能量代谢和炎症反应等过程[9]。在心血管系统中,大量研究表明SIRT1活性增加可以抵御心肌细胞的损伤,发挥抗动脉粥样硬化、抗心肌衰老、减轻心肌肥大与纤维化、改善缺血再灌注损伤等多种作用[10]。目前对于SIRT1作用机制尽管仍有争议,但不容否认的是多数研究发现SIRT1是调控氧化应激和凋亡的关键信号分子[9-11]。此外,在心肌缺血模型中,褪黑素被证实能够通过激活SIRT1改善心肌缺血损伤[12]。但是褪黑素是否通过SIRT抑制高糖介导的心肌损伤,以及机制如何,尚不明确。本研究发现,高糖组原代心肌细胞SIRT1 mRNA和蛋白表达较对照组减低;而在存在或不存在高糖刺激的条件下,褪黑素均能增强SIRT1 mRNA和蛋白表达,降低氧化应激水平,抑制原代心肌细胞凋亡,部分对抗高糖引起的细胞损害。而为了进一步研究SIRT1在褪黑素对高糖诱导的原代心肌细胞损伤的保护作用,我们用EX527,一种SIRT1的特异性抑制剂,去阻断SIRT1信号,发现褪黑素拮抗高糖诱导的原代心肌细胞凋亡的作用被EX527剥夺,提示褪黑素的原代心肌细胞保护作用依赖于SIRT1的上调。
自噬是吞噬自身受损、变性和错误折叠等的蛋白质和细胞器并使其包被进入囊泡,并通过与溶酶体形成自噬溶酶体,降解其内容物的生理过程。自噬是细胞保持细胞器新陈代谢稳态,进而进一步保持细胞活性稳定的必要过程.[13]。以往研究发现,心脏中自噬维持是心脏正常运作的必要条件,心脏条件性敲除自噬相关基因则会引起心脏功能障碍[14]。目前已有研究表明,SIRT1通路对衰老、凋亡、糖尿病心肌病、缺血再灌注损伤等的保护作用,可能均与细胞自噬的激活相关[15]。但褪黑素通过SIRT1激活抵抗高糖诱导的原代心肌细胞凋亡,是否与SIRT1对细胞自噬的调控相关,仍不清楚。我们结果发现,高糖刺激心肌细胞,自噬相关蛋白Beclin1,Atg5表达量降低;褪黑素干预则在存在和不存在高糖刺激的条件下,均能提高原代心肌细胞Beclin1、Atg5表达量。而给予SIRT1抑制剂EX527抑制SIRT1活性后,相比于HG+Mel组,HG+Mel+EX527组Beclin1和Atg5表达量减少,心肌细胞凋亡增加。以上提示褪黑素抑制高糖诱导的原代心肌细胞凋亡作用与SIRT1对自噬的调节有关。
综上所述,本研究发现褪黑素抑制高糖诱导原代心肌细胞凋亡,其可能是通过激活SIRT1,增强细胞自噬,抑制氧化应激,进而减少细胞凋亡发挥其心肌保护作用。
