shRNA沉默AEG-1基因表达对裸鼠胶质瘤模型中血管拟态形成的影响
2021-07-09上官健李瑞春郭世文
梁 晨,上官健,李瑞春,郭世文
(西安交通大学第一附属医院神经外科,陕西西安 710061)
血管拟态(vasculogenic mimicry, VM)是胶质瘤逃避抗血管生成治疗的重要机制之一[1]。星形细胞上调基因-1(astrocyte elevated gene-1, AEG-1)能够通过激活多种信号转导通路调节胶质瘤的侵袭、增殖、血管生成及化疗抵抗等,是一种很重要的原癌基因[2-3]。前期研究表明,利用siRNA(small interfering RNA)下调AEG-1基因表达能够在体外显著抑制胶质瘤VM形成[4]。本研究在前期研究基础上,拟构建AEG-1 shRNA(short hairpin RNA)慢病毒表达载体并稳定转染U87胶质瘤细胞,通过构建裸鼠胶质瘤原位模型,研究下调AEG-1基因表达对在体胶质瘤VM形成的影响,旨在为胶质瘤抗VM治疗提供新的研究思路。
1 材料与方法
1.1 试剂及耗材DMEM培养基、胎牛血清(Gibco);pLVX-ShRNA2-puro、psPAX2以及pMD2.G质粒(湖南优宝生物);嘌呤霉素(Gibco);兔抗CD34多克隆抗体、免疫组化试剂盒、DAB显色试剂盒(博士德);PAS染色试剂盒(Solarbio);兔抗人AEG-1抗体(Abnova);兔抗人GAPDH抗体、兔抗人基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)抗体、兔抗人基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)抗体(Bioworld);兔抗人血管内皮生长因子(vascular endothelial growth factor, VEGF)抗体(Abcam);兔抗人血管内皮细胞钙粘连蛋白(vascular endothelial-cadherin, VE-cadherin)抗体、HRP标记山羊抗兔IgG二抗(Thermo);RNA fast200总RNA抽提试剂盒(上海飞捷);PrimeScript RT Master Mix kit逆转录试剂盒、SYBR Premix ExTaqⅡ实时定量荧光试剂盒、XhoⅠ、T4 DNA连接酶BamHⅠEcoRⅠ(TaKaRa);薄型琼脂糖凝胶DNA回收试剂盒、质粒小量制备试剂盒(GENEray);金牌超量无内毒素质粒大提试剂盒(康为世纪);lipofectamine 2000(Invitrogen)。
1.2 细胞培养及实验动物U87胶质瘤细胞株及HEK293T细胞株购于中科院上海生命科学研究院细胞资源中心,细胞于含100 mL/L FBS的DMEM培养、50 mL/L CO2、37 ℃恒温培养箱中常规培养,2 d换液1次,2~3 d传代。雄性Rowett裸鼠(Crl:NIH-Foxn1rnu)30只,体质量180~240 g,购于北京维通利华实验动物技术有限公司。裸鼠饲养于恒温、恒湿,12 h明暗交替循环的超净层流饲养室,动物饲料、饮水、垫料均经过灭菌处理。动物实验方案经西安交通大学医学部生物医学伦理委员会批准。
1.3 AEG-1 shRNA质粒构建
1.3.1合成AEG-1 shRNA片段 根据课题组前期研究结果选择干扰效率最高的AEG-1 siRNA序列用于构建AEG-1 shRNA质粒[4]。根据目的序列设计PCR引物,并引入EcoRⅠ、BamHⅠ及XhoⅠ酶切位点。引物序列如下:Forward 5′-GATCCGCCGTAATCAACCCTATATTTCAAGAGAATATAG-GGTTGATTACGGCTTTTTTCTCGAGG-3′;Reverse 5′-AATTCCTCGAGAAAAAAGCCGTAATCAACCCTATATTCTCTTGAAATATAGGGTT-GATTACGGCG-3′。上述引物与annealing buffer混合后,经94 ℃退火5 min,自然冷却至室温,取1 μL退火产物加H2O至100 μL。
1.3.2构建AEG-1 shRNA质粒 质粒pLVX-ShRNA2-Puro经BamHⅠ和EcoRⅠ酶切,10 g/L琼脂糖凝胶电泳回收大片段。以T4 DNA连接酶将稀释后的AEG-1 shRNA片段与线性化的pLVX-ShRNA2-Puro载体连接,取10 μL连接产物转化感受态细胞DH5α,涂布于含氨苄青霉素(ampicillin, Amp)的LB平板上,37 ℃恒温培养箱培养过夜。从培养皿上挑取单克隆菌落接种于5 mL Amp的LB培养液中,37 ℃恒温摇床培养过夜。按试剂盒说明书小量提取质粒,用XhoⅠ做酶切鉴定。挑选酶切正确的质粒进行测序,测序无误后按试剂盒说明书进行大规模提取AEG-1 shRNA质粒(pLVX-ShRNA2-Puro-AEG1)。以阴性对照(negative control, NC)序列代替AEG-1 siRNA序列构建pLVX-ShRNA2-Puro-control质粒作为阴性对照,构建方法同上。
1.4 AEG-1 shRNA慢病毒表达载体的构建将3 μg pLVX-ShRNA2-puro-AEG1(阴性对照组为pLVX-ShRNA2-Puro-control)、1.5 μg psPAX2、1.5 μg pMD2.G质粒加入含9 μL Lipofectamine 2000的500 μL无血清培养基中混合,加入HEK293T细胞培养基中。24 h时荧光显微镜下观察,48 h时收获含病毒上清液,命名为AEG-1 shRNA慢病毒(阴性对照组命名为sh-control 慢病毒)。用含有病毒的细胞上清液感染正常HEK293T细胞,48 h时荧光显微镜下观察GFP表达,检验病毒活力。
1.5 AEG-1 shRNA U87稳转细胞株的筛选
1.5.1确定嘌呤霉素最优筛选浓度 取对数生长期的U87细胞,胰酶消化,以每孔1×104个细胞接种于96孔培养板中,37 ℃培养箱中培养过夜;分别加入终质量浓度分别为0、1×10-4、2×10-4、4×10-4、6×10-4、8×10-4、1×10-3、1.5×10-3、2×10-3g/L的嘌呤霉素,每日检查细胞活力,筛选出最优质量浓度。
1.5.2慢病毒转染 将细胞接种于24孔细胞培养板至细胞汇合度达到60%;每孔加入0.5 mL含病毒上清液,37 ℃培养箱中培养24 h,更换新鲜培养基。
1.5.3筛选稳定转染细胞株 病毒转染48 h,检测GFP表达,更换新鲜培养基并加入最佳质量浓度嘌呤霉素;每2~3 d更换新鲜含嘌呤霉素的培养基,以替换含大量死细胞的培养基,直到抗性群落被识别出。阴性对照组以sh-control慢病毒转染U87细胞,稳转细胞株筛选方法同上。
1.6 AEG-1 shRNA稳转U87细胞中AEG-1表达的检测收获AEG-1 shRNA稳转细胞,提取总RNA及蛋白,Western blotting及Real-time PCR检测细胞中AEG-1 mRNA及蛋白表达,方法同参考文献[4]。
1.7 裸鼠胶质瘤原位模型的建立及实验分组裸鼠胶质瘤原位模型的建立按照文献方法[5]进行。30只裸鼠随机分为AEG-1 shRNA组、阴性对照组、空白对照组,每组10只。AEG-1 shRNA组颅内注射稳定转染AEG-1 shRNA慢病毒表达载体的U87细胞株;阴性对照组注射稳定转染sh-control慢病毒表达载体的U87细胞株;空白对照组注射普通U87细胞。
1.8 CD34-PAS双染检测裸鼠胶质瘤模型中VM的形成颅内注射肿瘤细胞21 d后,裸鼠经40 g/L多聚甲醛灌注固定后取脑组织制作石蜡切片。取部分石蜡切片常规脱蜡水化后,按免疫组化试剂盒说明书进行CD34免疫组织化学染色;部分切片按PAS染色试剂盒说明书进行PAS染色。所有切片用苏木素复染,脱水并固定,显微镜下观察评估CD34-/PAS+的管腔样结构形成情况。
1.9 免疫组织化学染色检测胶质瘤模型中VM形成相关基因的表达石蜡切片常规脱蜡水化后,按免疫组化试剂盒说明书进行MMP-2、MMP-9、VE-cadherin、VEGF免疫组织化学染色,IPP6.0软件分析平均吸光度(average absorbance, AA)评估蛋白相对表达水平。

2 结 果
2.1 AEG-1 shRNA慢病毒表达载体的构建质粒载体pLVX-ShRNA2-Puro原本含一个XhoⅠ的酶切位点,设计AEG-1 shRNA片段时人为引入了XhoⅠ的酶切位点。质粒载体pLVX-ShRNA2-Puro被XhoⅠ酶切出约1 400 bp的DNA条带(图1A),说明目的基因片段已成功插入。将3种质粒导入HEK293T细胞24 h的荧光显微镜下观察显示,转染效率达到60%以上(图1B)。将含有病毒的细胞上清液转染正常HEK293T细胞48 h,可检测到GFP的表达(图1C),证实病毒转染效果良好。

图1 AEG-1 shRNA慢病毒表达载体的构建
2.2 AEG-1 shRNA U87稳转细胞株的筛选经筛选实验确定嘌呤霉素最优质量浓度为1×10-3g/L。U87细胞经慢病毒转染48 h,可检测到GFP表达,经嘌呤霉素筛选出稳转细胞株(图2)。
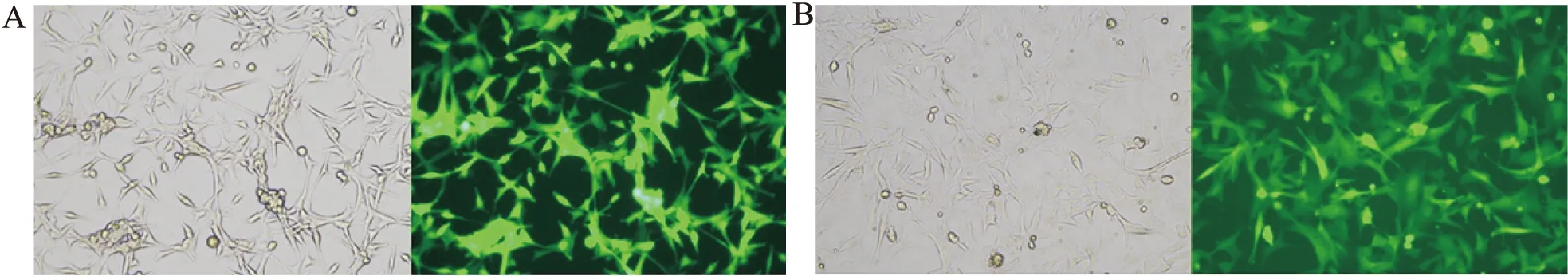
图2 经筛选后的U87稳转细胞株的GFP表达
2.3 AEG-1 shRNA对U87细胞中AEG-1 mRNA表达的影响与空白对照及阴性对照组比较,AEG-1 shRNA稳转细胞株中AEG-1 mRNA及蛋白表达显著下调,差异具有统计学意义(P<0.01,图3)。
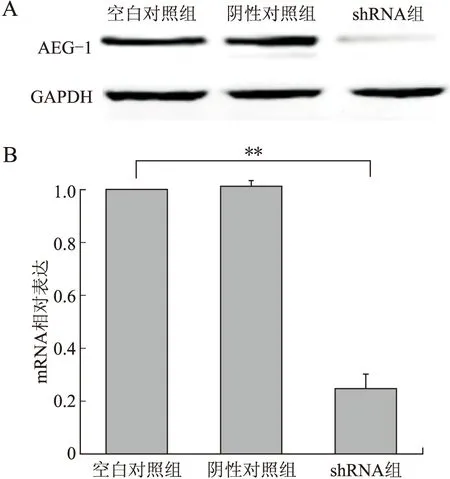
图3 AEG-1 shRNA对U87细胞AEG-1 mRNA表达的影响
2.4 shRNA沉默AEG-1基因对裸鼠胶质瘤模型中VM形成的影响AEG-1 shRNA组裸鼠原位模型中,VM数量较空白对照组显著降低,差异具有统计学意义(P<0.01),空白对照组与阴性对照组组间差异无统计学意义(P>0.05,图4)。
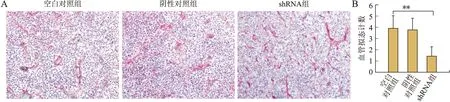
图4 shRNA沉默AEG-1基因对裸鼠胶质瘤模型中VM形成的影响
2.5 shRNA沉默AEG-1基因表达对裸鼠胶质瘤模型中VM形成相关基因的影响AEG-1 shRNA组裸鼠原位模型中,MMP-2、MMP-9、VEGF、VE-cadherin的表达较空白对照组显著降低,差异具有统计学意义(图5、图6,P<0.01)。
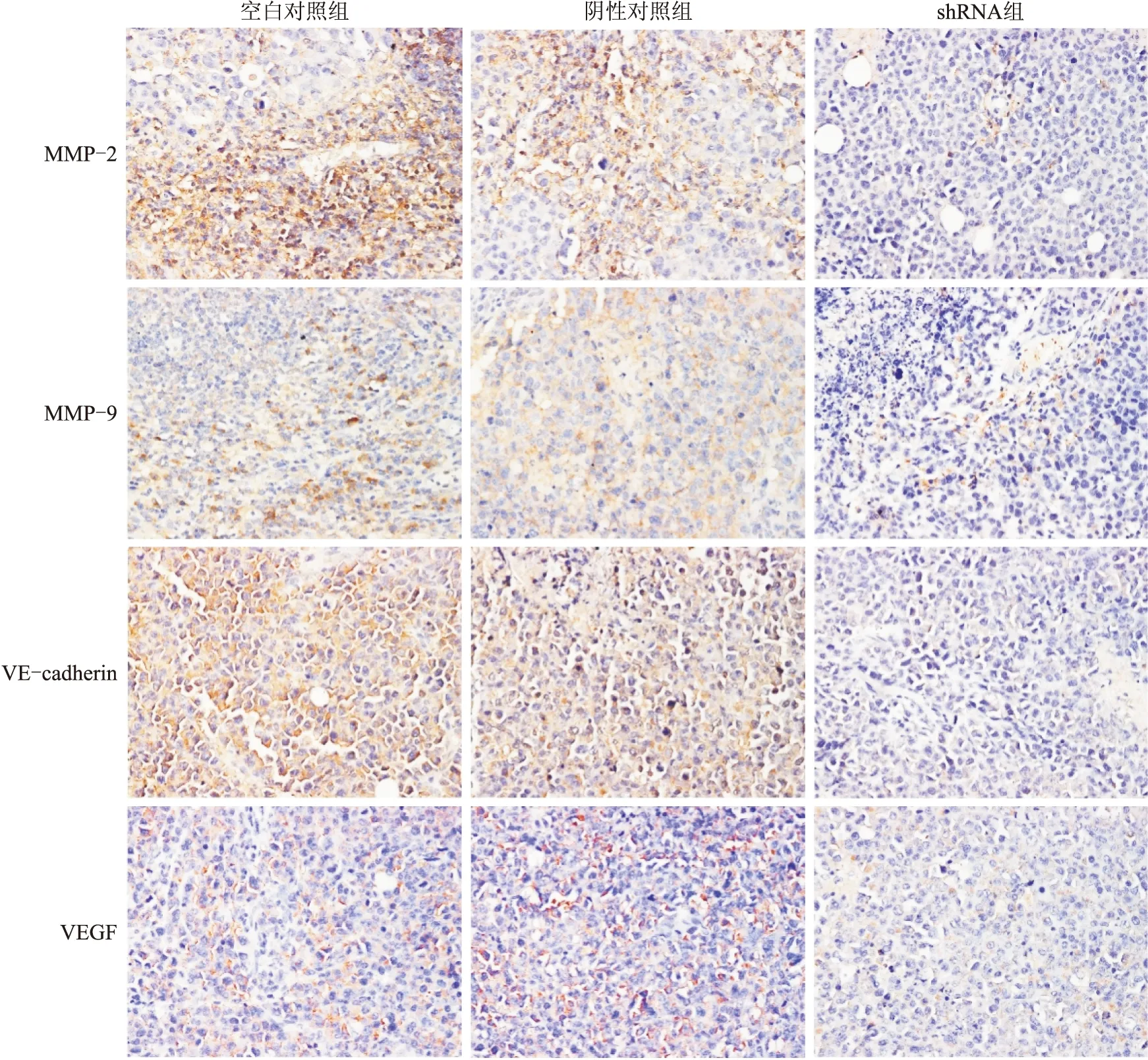
图5 免疫组织化学染色检测各组裸鼠胶质瘤模型中血管拟态形成相关蛋白表达(×100)

图6 各组裸鼠胶质瘤模型中血管拟态形成相关蛋白表达的比较
3 讨 论
AEG-1作为Ha-ras以及cyclin D1的下游基因,能够通过激活NF-κB、PI3K-Akt以及Wnt等信号通路,促进肿瘤侵袭、转移、血管生成以及化疗抵抗等[2-3]。胶质瘤中,AEG-1能够通过诱导保护性自噬、减少活性氧簇生成等多种途径促进胶质瘤进展及侵袭[3,6]。而AEG-1与胶质瘤VM形成之间的关系,目前少有报道。本课题组前期研究发现,利用siRNA下调AEG-1基因表达能够在体外显著抑制胶质瘤VM形成[4]。本研究进一步构建AEG-1 shRNA慢病毒表达载体及裸鼠原位胶质瘤模型,发现下调AEG-1基因表达在体内同样能够抑制胶质瘤VM形成,这一结果从动物模型在体实验证实了下调AEG-1基因对胶质瘤VM形成的抑制作用,是对前期研究更深入而有力的补充。
有关下调AEG-1表达对胶质瘤VM形成的调节机制,目前还不十分清楚。已经证实有多种不同的分子机制及信号通路参与肿瘤VM形成。研究者认为,在众多的分子中,MMP-2有至关重要的作用,其与皮脂腺癌、颅内血管外皮细胞瘤以及乳腺癌等多种肿瘤VM形成密切相关[7-9]。其促进VM形成的机制主要是参与细胞外基质(extracellular matrix, ECM)的重塑[10]。MMP-2的活化能够使层粘连蛋白-5γ2链分裂,这些分裂形成的碎片沉积在ECM中,参与ECM可塑性变化、肿瘤转移、侵袭及VM形成[11]。与MMP-2类似,MMP-9也是MMP家族的重要成员。MMP-9的过度表达与上皮间质转化(EMT)有关[12],后者已被证实参与VM的形成[13]。已证实FAK-ERK1/2在VM形成过程中调节MMP-2和MMP-9的表达和激活[14]。抑制MMP-2/MMP-9的表达可以显著抑制VM的形成[15-16]。
VE-cadherin是钙黏蛋白家族中的一种黏附分子,也是VM形成的关键分子之一。在黑色素瘤细胞中,缺乏VE-cadherin显著抑制VM形成[17]。VE-cadherin诱导EphA2重新定位到细胞膜上,随后使EphA2磷酸化[18]。活化的EphA2可使FAK磷酸化,从而激活ERK1/2,进而激活PI3K。活化的PI3K调节pro-MT1-MMP向MT-MMP和MMP-2转化。而MT1-MMP和MMP-2都能够促进VM的形成。
此外,研究证实VEGF在VM形成中也有重要作用。VEGF能够通过上调VE-cadherin、EphA2以及MMPs的表达参与ECM重塑及VM形成[19]。而ERK1/2通路以及PI3K/Akt通路在这一过程中发挥了关键作用[20-21]。下调VEGF表达同样能够抑制VM形成[21-22]。
本课题组研究前期发现,siRNA下调AEG-1表达能明显下调胶质瘤细胞中MMP-2及VEGF的表达[4]。本研究进一步证实抑制AEG-1表达能够显著下调胶质瘤原位模型中MMP-2、MMP-9、VEGF以及VE-cadherin的表达。考虑到上述基因对VM形成的促进作用,推测下调AEG-1抑制VM形成的作用机制可能部分是通过调节MMP-2、MMP-9、VEGF以及VE-cadherin表达而实现,其具体机制有待进一步研究。
综上所述,下调AEG-1表达能够在体内外抑制胶质瘤VM形成,这一结果或许能为针对VM进行胶质瘤靶向治疗提供新的思路。
