绵羊子宫内膜上皮细胞和基质细胞的分离与鉴定
2021-07-08凌芳郝科兴陈慧慧龙德智王静胡广东
凌芳,郝科兴,陈慧慧,龙德智,王静,胡广东
(石河子大学动物科技学院,新疆 石河子 832000)
胚胎附植是妊娠成功的关键步骤,在早期胚胎附植阶段,子宫内膜会经历一系列结构和功能的变化,从而建立最佳的子宫内环境允许胚胎植入[1]。此过程也称子宫内膜蜕膜化,子宫内膜蜕膜化的实质是子宫内膜上皮细胞和基质细胞的增殖和凋亡过程[2-3]。为了更好地研究这一过程中母体子宫内膜变化的相关机制,需要可靠的细胞模型,而在体外分离培养原代子宫内膜上皮细胞和基质细胞是解决此问题的有效手段。
近年来,子宫内膜上皮细胞和基质细胞体外分离培养方法建立的相关研究在不同动物上均获得成功,包括人[4]、小鼠[5]、家兔[6]、牛[7]、山羊[8]等,涉及细胞分离培养的方法有组织培养法和酶消化法。然而,在实际操作过程中,利用上述方法分离获得的细胞均为子宫内膜上皮细胞和基质细胞的混合细胞,难以完全分离纯化。因此,本研究采用组织块培养法获得原代绵羊子宫内膜上皮细胞和基质细胞,再通过胰酶差时消化法获得纯化的原代细胞,并分别对其进行免疫荧光鉴定,以期建立一种绵羊子宫内膜上皮细胞和基质细胞获取方法及分离纯化方法,为更好地研究绵羊胚胎附植过程提供可靠的细胞模型。
1 材料与方法
1.1 试验动物
绵羊子宫采自新疆石河子市牛羊定点屠宰场,动物经过严格的健康检疫流程,符合试验要求。
1.2 试剂
胎牛血清(FBS)、DMEM/F12 培养基、0.25%胰蛋白酶购自Gibco;20×PBS购自上海生工;青-链霉素购自HyClone;鼠抗角蛋白18(CK18)单克隆抗体购自Abcam;兔抗波形蛋白抗体购自博士德;DAPI购自碧云天生物技术公司;罗丹明标记山羊抗兔二抗购自中杉金桥;山羊抗鼠绿色荧光二抗购自赛默飞。
1.3 试验方法
1.3.1 组织块培养法获得原代细胞
用含5%双抗的PBS冲洗从屠宰场采得的绵羊子宫3~5遍,在无菌条件下剪取子宫角后2/3处置于一次性培养皿中,将子宫角纵向切开后展开,露出位于子宫腔面的子宫阜并用眼科剪剪下子宫阜。含5%双抗的PBS冲洗剪下的子宫阜3~5遍。将子宫阜用镊子夹入2 mL的EP管中,用剪刀将子宫阜剪碎成1 mm3小块,加1.5 mL PBS到管中,将组织吹打混匀后1 500 r/min离心5 min,弃PBS,重复3次。
用移液枪吸取500 μL剪碎的组织块接种于6孔板中,加入2 mL 完全培养基(DMEM/F12、10%FBS、1%双抗)置于37 ℃、5% CO2中培养箱中培养,以后每隔3 d换1次液。
1.3.2 差时消化法分离纯化细胞
原代细胞生长汇合达80%~90%时,移弃培养液,PBS洗2次,向6孔板中每孔加入0.25%胰蛋白酶溶液1 mL,消化90 s,然后将6孔板置于倒置显微镜下观察,待多数基质细胞变圆,脱落成游离细胞时,立即弃胰酶,加入2 mL完全培养基,终止消化。用枪头轻轻吹打板底部细胞后将细胞悬液移入2 mL EP管,1 500 r/min离心5 min收集基质细胞,加入1 mL PBS吹打洗涤,1 500 r/min离心5 min后收集细胞,再加2 mL完全培养基吹打混匀后接种到另一6孔板中。然后加2 mL完全培养基冲洗2次未脱落的上皮细胞混匀后继续培养,培养约2 d,期间每隔24 h于倒置显微镜下观察一次细胞形态,若还有梭形成束的基质细胞,则再重复一次胰酶差时消化,重复1~2次即可得到较纯的子宫内膜上皮细胞。
1.3.3 免疫荧光法鉴定细胞
将6孔板中培养的细胞消化后计数,以每孔1×104个的密度接种于24孔板中,待细胞贴壁后,用PBS洗涤,然后每孔加500 μL 4%多聚甲醛固定,室温固定10 min,弃多聚甲醛,用PBS冲洗3次,每次5 min。加200 μL 0.5% TritonX-100通透15 min,PBS 冲洗3次,每次5 min。每孔加200 μL 1% BSA封闭液,室温下孵育 30 min。弃上清,PBS洗3次,上皮细胞和基质细胞分别滴加鼠抗CK18一抗(1/100稀释)和兔抗波形蛋白一抗(1/30稀释),并分别滴加PBS(做阴性对照)覆盖细胞标本,4 ℃过夜。一抗孵育完成后用 PBS 冲洗3次,每次5 min,滴加与一抗相对应的稀释后的二抗工作液,37 ℃避光温育30 min。然后用PBS冲洗3次,每次5 min,5 μg/mL DAPI核染3 min,PBS清洗3次,然后在荧光倒置显微镜下观察,拍照。
2 结果
2.1 组织块培养获得原代细胞
显微镜下观察发现,组织块培养第3天开始有细胞从组织块爬出(图1a),5~6 d时单层细胞铺开,呈梭形细胞和铺路石状,2种细胞交织在一起(图1b)。7~8 d时细胞长至90%,适合传代(图1c),若不传代,细胞会重叠生长导致部分细胞空泡化从而死亡悬浮。
2.2 差时消化分离纯化绵羊子宫内膜上皮细胞和基质细胞
组织块培养法获得的原代细胞包括呈梭形的基质细胞与铺路石状上皮细胞,且表现混合生长态势,经2~3次0.25%胰蛋白酶差时消化(图 2a、2b),获得较纯的绵羊子宫内膜上皮细胞和基质细胞(图 2c、2d)。

a. 组织块培养第3天有细胞爬出;b. 第6天组织块间上皮细胞和基质细胞交汇生长;c. 第8天细胞长满培养板开始出现细胞空泡化
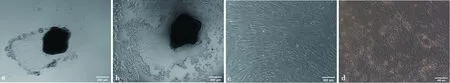
a,b. 胰蛋白酶消化中,细胞变圆脱落过程;c. 纯化后得到的基质细胞;d. 2~3次差时消化得到的上皮细胞
2.3 免疫荧光鉴定
免疫荧光结果显示,绵羊子宫内膜上皮细胞呈角蛋白染色阳性(图3a、3b、3c),波形蛋白染色阴性(图3d、3e、3f),阳性率大于95%;阳性细胞胞质染为绿色荧光,核蓝染,阴性对照细胞不着色。基质细胞呈波形蛋白染色阳性(图4a、4b、4c),角蛋白染色阴性(图4d、4e、4f),阳性率大于95%;阳性细胞胞质染为红色荧光,核蓝染,阴性对照细胞不着色。

a.上皮细胞核染;b. 上皮细胞角蛋白鉴定;c. 上皮细胞核染和角蛋白合成图;d. 上皮细胞核染;e.上皮细胞波形蛋白对照;f. 上皮细胞核染和波形蛋白对照合成图
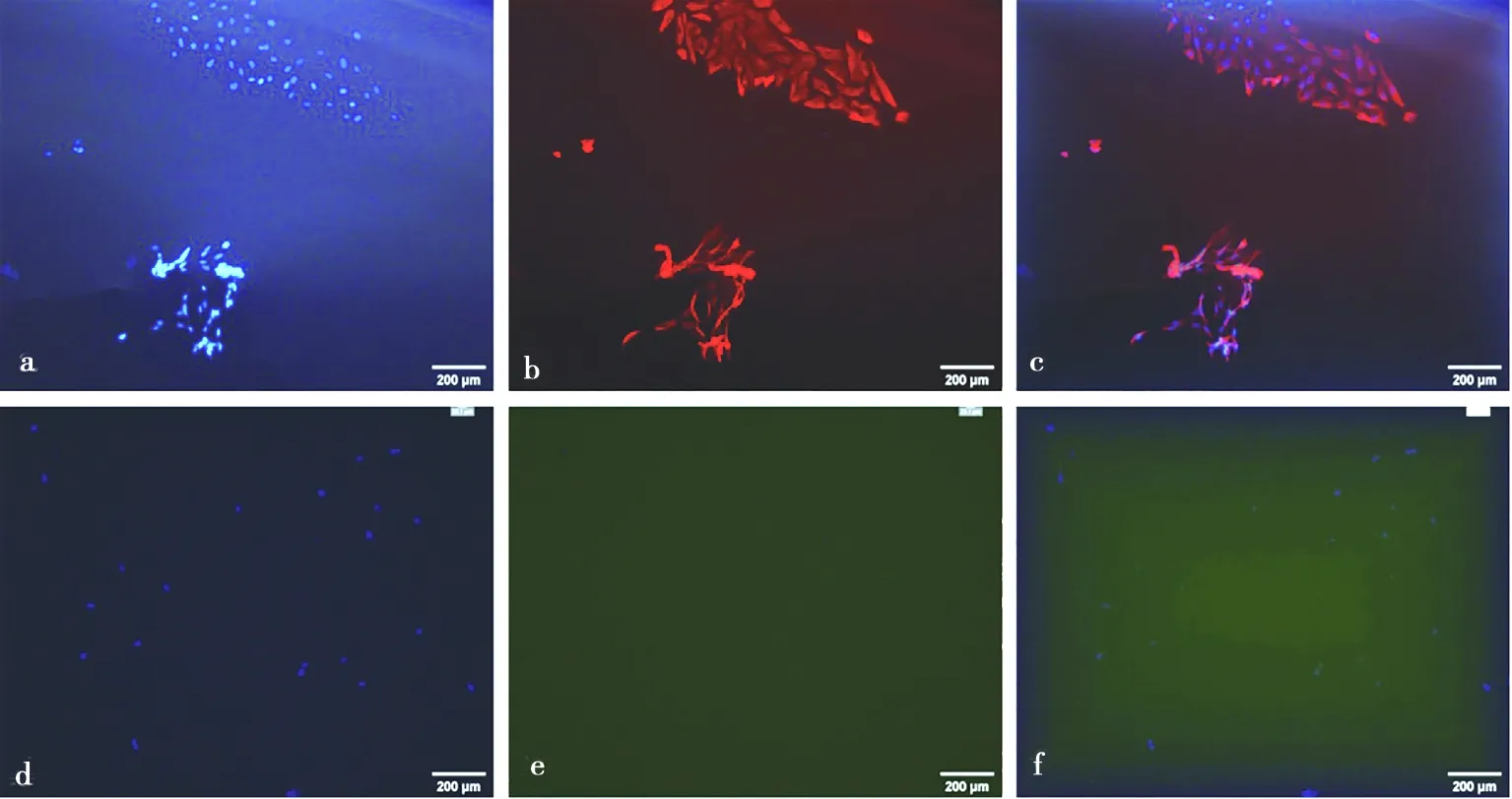
a.基质细胞核染;b. 基质细胞波形蛋白鉴定;c. 基质细胞核染和波形蛋白合成图;d. 基质细胞核染;e. 基质细胞角蛋白对照;f. 基质细胞核染和角蛋白对照合成图
3 讨论
子宫内膜上皮细胞和基质细胞是在体外研究胚胎附植所必需的细胞模型,分离和纯化生物功能完整的原代细胞是开展相关研究的前提条件。本研究利用组织块培养法结合胰酶差时消化法成功获得了纯度较高的绵羊子宫内膜上皮细胞和基质细胞。
常用的原代子宫内膜细胞分离培养的方法包括组织块培养法和酶消化法,不同动物子宫内膜组织存在差异,为分离活性较高的原代细胞,需对细胞分离培养方法进行优化[9-14]。有研究发现胶原酶消化作用温和,但由于消化时间过长且胶原酶价格昂贵[15-16],导致其使用成本较高。与胶原酶消化法相比,组织块培养法操作简便,细胞分离效率较高,成本较低,是原代细胞分离培养的首选方式。常用的组织块培养法在操作过程中以手术镊子和剪刀剥离子宫外层和脂肪,获得薄膜状子宫内膜功能层,然后取子宫角,纵向剪开后去除外层脂肪、肌肉等组织,取最内层半透明状膜上皮分离细胞[17-18],此过程较为繁琐,不易推广。因此,本研究对原有程序进行优化,选择将子宫角纵向剪开后剪下子宫阜,再将子宫阜剪碎后分离细胞,获得大量活性较好的绵羊子宫内膜上皮细胞和基质细胞。
为研究子宫内膜上皮细胞和基质细胞在胚胎附植过程中的不同作用,需对2种细胞分别进行纯化。常用纯化方法包括筛网过滤及贴壁纯化法、差时消化法和差速贴壁法。有研究采用细胞过滤网的方式成功得到纯化的上皮细胞和基质细胞[19],但此方法操作过程中,由于消化液黏性大而使过筛网过度损耗导致细胞纯化率不高,且易发生细胞污染。因此,本研究根据上皮细胞和基质细胞对胰蛋白酶的耐受程度不同[20],而采用胰酶差时消化法对细胞进行纯化。奶牛子宫内膜细胞纯化过程中,胰酶消化1 min时基质细胞开始变圆,10 min后全部脱落,此时上皮细胞开始变圆[21]。而本研究发现,胰酶消化时,绵羊子宫内膜基质细胞约90 s开始变圆,2 min后全部脱落,而上皮细胞则需要6 min开始变圆,这可能是由于动物品种不同造成的差异。纯化的子宫内膜上皮细胞和基质细胞,分别利用2种细胞特异性表达蛋白角蛋白18和波形蛋白抗体进行免疫荧光鉴定,结果呈阳性,且纯度在95%以上,表明利用胰酶差时消化法可有效获得纯度较高的绵羊子宫内膜上皮细胞和基质细胞。
综上,本研究成功分离并纯化了绵羊子宫内膜上皮细胞和基质细胞,为绵羊早期胚胎附植机理的研究提供了体外细胞模型。
