3株不同血清型沙门菌感染ICR小鼠模型的建立
2021-07-08左庚亮马喆
左庚亮,马喆
(南京农业大学动物医学院,江苏 南京 210095)
沙门菌是一类重要的食源性病原微生物,该病原血清型众多,能够导致肠热、食物中毒及急性败血症等多种疾病,给公共卫生和养殖业发展造成重大危害[1]。欧盟最新研究报告指出,有1/5的食源性疾病由沙门菌感染引起,将近一半的成员国仍饱受沙门菌的困扰[2]。我国畜禽养殖环境中沙门菌的污染情况严重,在“限抗令”背景下,愈发成为危害餐桌和养殖产业的重大隐患,迫切需要开发针对不同血清型沙门菌的疫苗和非抗生素类药物等产品,为沙门菌的防控和净化工作助力,而建立可用于评价抗沙门菌疫苗和药物效果的动物模型是实验室产品试制阶段的关键性基础工作。
不同血清型的沙门菌对宿主的适应性有所不同,适宜的动物模型是研究沙门菌生理功能、发病机制和病理损伤的关键。研究人员已经建立了包括小鼠、雏鸡、果蝇和斑马鱼等多种模型[3-6]。其中小鼠由于与人类基因同源性较高、适应性强、繁殖率高和遗传性状稳定等优势,被广泛用于沙门菌致病机制的相关研究[7]。小鼠肠道感染模型确立的过程中受到诸多因素如小鼠品系、细菌的血清型、菌株毒力和攻毒途径等影响,直观体现在小鼠对细菌感染剂量响应上的差异[8]。以6周龄BALB/c小鼠为实验模型,鼠伤寒沙门菌ATCC14028灌胃攻毒后,测得半数致死量为1.4×105CFU[9]。然而以昆明鼠为实验模型,口腔灌胃鼠伤寒沙门菌STM50115,半数致死量为4×108CFU;相同品系小鼠下,以鼠伤寒沙门菌SL1344进行口腔攻毒,测得半数致死剂量为2.3×104CFU[10-11]。由此可见,已建立的小鼠模型仅适用于特定血清型的沙门菌,在研究沙门菌感染机制时应结合实际情况,建立满足自身实验需求的小鼠感染模型。
本研究旨在分别用临床分离的动物源鸡白痢沙门菌、肠炎沙门菌和鼠伤寒沙门菌腹腔感染ICR小鼠,根据不同剂量感染下小鼠的存活曲线,组织细菌载量和组织病理学变化来评价沙门菌对小鼠的致病性,以便建立我国临床常见的畜禽源不同血清型沙门菌株感染ICR小鼠模型,为研究沙门菌发病机制和沙门菌疫苗及药物的开发提供动物模型基础数据。
1 材料与方法
1.1 试验材料
鸡白痢沙门菌CVCC1800购自中国兽医药品监察所,鼠伤寒沙门菌CVCC542和肠炎沙门菌ATCC19585购自中国兽医微生物菌种保藏管理中心,SPF级4~6周龄ICR雌鼠购自南京青龙山动物繁殖场。
1.2 沙门菌最适感染剂量的确定
3株不同血清型的沙门菌平板划线后置于温箱中过夜培养。次日用接种环刮取平板上的全部菌落,分别接种到含有50 mL新鲜LB液体培养基中,37 ℃、180 r/min振荡培养至OD600值约为0.6。菌体离心后用无菌的PBS洗涤重悬3次,根据表1的试验方案将菌液调整至合适的稀释度。将4~6周龄ICR雌鼠随机分组,每组3只。攻毒后给予充足的水和饲料,每天观察小鼠的生存状况并绘制存活曲线。

表1 3株不同血清型沙门菌的小鼠攻毒模型确立方案
1.3 沙门菌感染小鼠后脏器的细菌载量检测
小鼠感染沙门菌20 h后全部处死。剖检后摘除脾脏、肝脏、空肠、回肠和盲肠部位以检测细菌载量。肠道部分的摘取如图1所示。

图1 小鼠肠道部分摘取
向2 mL的灭菌匀浆管(含钢珠)中加入1 mL的PBS缓冲液,拧好盖子后称重,记作管的初始重量。将摘取的小鼠脏器置于匀浆管中,拧好盖子再次称重。2次称重的数值相减,即为待检组织的重量。将匀浆管放入组织匀浆仪中,匀浆结束后置于4 ℃冰箱中备用。
96孔板每孔中加入180 μL的PBS缓冲液,取出匀浆管在涡旋仪上振荡10 s后,拧开盖子吸取20 μL进行10倍比稀释,稀释度依次记为10-1~10-6,并进行菌落计数。
1.4 沙门菌感染小鼠后脏器的组织病理学变化
分别用不同血清型的沙门菌对小鼠进行攻毒,攻毒20 h后处死。摘取脾脏、肝脏、空肠和回肠等部位,浸泡于10%的福尔马林中固定。样品由武汉赛维尔生物科技有限公司制作病理学组织切片。
2 结果
2.1 沙门菌最适感染剂量的确定
攻毒后每隔12 h观察小鼠状态及存活情况(图2)。各组小鼠均表现出不同程度的精神萎靡、被毛粗乱等临床症状。对于鸡白痢沙门菌,当攻毒剂量为5.6×108CFU及以上时,组内所有小鼠在48 h内陆续死亡;当攻毒剂量为5.6×107CFU时,2只小鼠在108 h内陆续死亡,剩余1只小鼠耐过后康复;当攻毒剂量低于5.6×107CFU时,组内小鼠无死亡现象。对于肠炎沙门菌,当攻毒剂量为3.2×108CFU及以上时,组内小鼠在24 h内陆续全部死亡;当攻毒剂量为3.2×107CFU时,组内小鼠在156 h内陆续死亡;当攻毒剂量低于3.2×107CFU时,组内小鼠无死亡现象。对于鼠伤寒沙门菌,当攻毒剂量为2.5×106CFU时,组内小鼠在72 h内陆续全部死亡;当攻毒剂量为2.5×105CFU时,组内小鼠在96 h内陆续死亡;当攻毒剂量为2.5×104CFU时,组内小鼠无死亡。由此可知,鸡白痢沙门菌CVCC1800、肠炎沙门菌ATCC19585和鼠伤寒沙门菌CVCC542对小鼠的最适感染剂量分别为5.6×108、3.2×107和2.5×106CFU。在最适感染剂量下,小鼠无急性死亡的情况发生,有充足的时间观察小鼠的状态,适合疫苗和药物的临床效果评估。
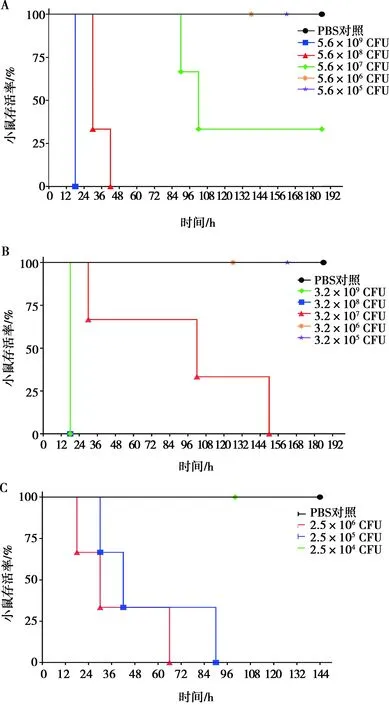
A、B、C对应的沙门菌血清型依次为鸡白痢沙门菌、肠炎沙门菌、鼠伤寒沙门菌
2.2 沙门菌感染小鼠后脏器的细菌载量检测
3株沙门菌感染小鼠的部位及感染量略有差异(图3)。鸡白痢沙门菌主要感染小鼠的肠道部分,空肠的细菌载量约为2.7×108CFU/g,回肠细菌载量约为6.7×108CFU/g,显著高于脾脏和肝脏的细菌载量约104CFU/g。肠炎沙门菌感染小鼠的部位较为广泛,脾脏载量高于其他脏器,约为7.4×107CFU/g。肝脏细菌载量约为4.9×106CFU/g,肠道部位的细菌载量区间在106~107CFU/g。鼠伤寒沙门菌在小鼠的各脏器均有分布,但细菌载量差异不显著。
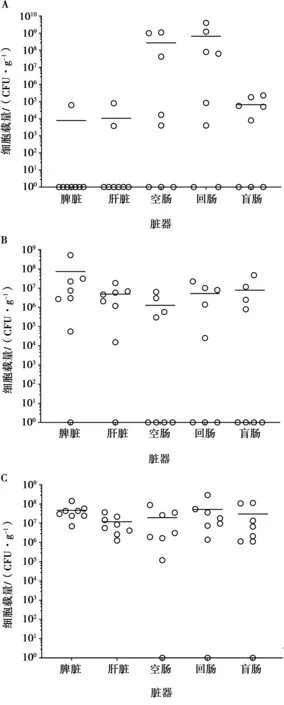
A、B、C对应的沙门菌血清型依次为鸡白痢沙门菌、肠炎沙门菌、鼠伤寒沙门菌
2.3 沙门菌感染小鼠后脏器的组织病理学变化
鸡白痢沙门菌CVCC1800感染小鼠后,空肠黏膜层结构轻微受损,部分肠绒毛断裂(图4A);回肠受损严重,黏膜层细胞大量坏死脱落,无法辨别正常结构(图4B)。肠炎沙门菌ATCC19585感染小鼠后,脾脏出现炎性细胞浸润(图4C),肝脏组织出现大量空泡病变(图4D)。鼠伤寒沙门菌CVCC542感染小鼠后,脾脏也出现炎性细胞浸润的现象(图4E),肝脏组织中部分肝细胞固缩,且肝索走向不明显(图4F)。
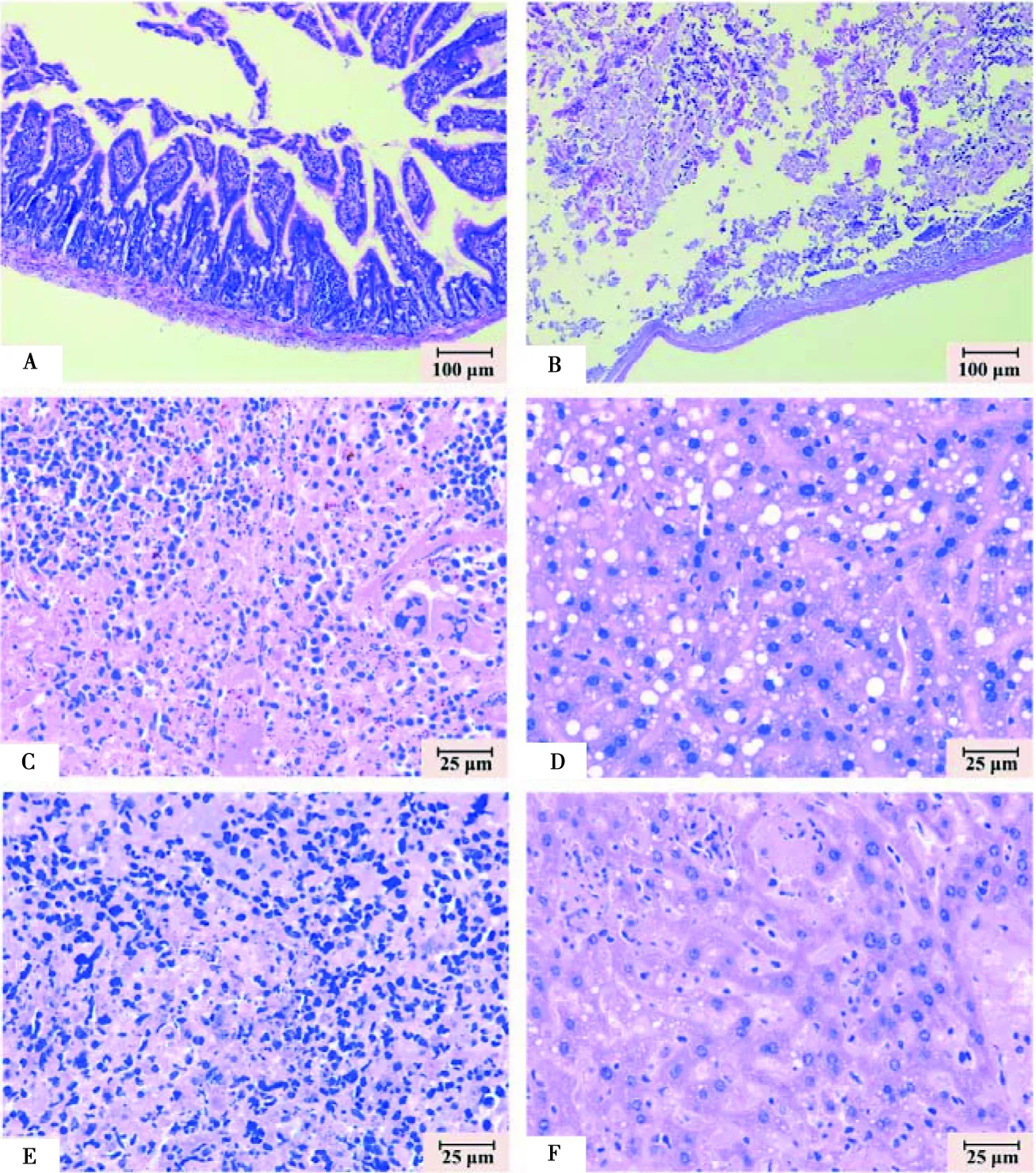
A和B分别为小鼠感染鸡白痢沙门菌CVCC1800的空肠和回肠组织病变(100×);C和D分别为小鼠感染肠炎沙门菌ATCC19585的脾脏和肝脏组织病变(400×);E和F分别为小鼠感染鼠伤寒沙门菌CVCC542的脾脏和肝脏组织病变(400×)
3 讨论
小鼠由于遗传背景清晰及成本低廉而被广泛用于沙门菌的相关研究。针对不同来源沙门菌,根据研究的对象和目的不同,应该重新评判小鼠模型在评价沙门菌感染情况时的适用性。王伟等[8]将不同剂量的肠炎沙门菌标准菌株SE50336通过口腔灌注的方式感染6周龄ICR雌鼠,最终测定半数致死量LD50为1×104.67CFU;姚营等[12]以昆明小鼠为模型,用鼠伤寒沙门菌灌胃攻毒,通过观察攻毒后小鼠的肠道组织病变,小肠上皮细胞超微结构变化和肠道淋巴细胞增殖状况,初步探索了鼠伤寒沙门菌引发肠炎的发病机制和病理生理。而本研究将肠炎沙门菌ATCC19585和鼠伤寒沙门菌CVCC542腹腔接种到ICR雌鼠体内,测得其最适感染剂量分别为3.2×107CFU和2.5×106CFU,感染后小鼠出现精神萎靡、采食减少及不愿活动等症状,脾脏出现炎性细胞浸润,肝脏组织出现大量空泡病变。这与上述动物模型感染剂量和病理变化上略有差异,差异可能与小鼠品系和菌株毒力有关。
鸡白痢沙门菌具有高度的宿主专嗜性,主要感染鸡和火鸡。因此特定品系的SPF鸡如白来航鸡(White Leghorns)、罗德岛红鸡(Rhode Island Red)和温多特鸡(White Wyandottes)等来被用于鸡白痢沙门菌的研究[13-14]。本研究用鸡白痢沙门菌标准株CVCC1800腹腔感染小鼠,测得最适感染剂量为5.6×108CFU,这也是将ICR小鼠作为鸡白痢沙门菌的模式动物的首次尝试。相较于肠炎沙门菌和鼠伤寒沙门菌引起的鸡局部感染或肠炎症状,鸡白痢沙门菌可引起全身性感染[15]。但从本试验获得的细菌载量上看,鸡白痢沙门菌主要感染小鼠的空肠和回肠,其次为盲肠。脾脏和肝脏中细菌载量较低,与感染剂量相比,细菌在小鼠肝脏脾脏中的定殖效果并不理想。
本研究建立了鸡白痢沙门菌、肠炎沙门菌和鼠伤寒沙门菌的ICR小鼠腹腔感染模型,其中肠炎沙门菌和鼠伤寒沙门菌小鼠感染模型效果较好,鸡白痢沙门菌由于宿主嗜性差异,在小鼠脏器中的定殖效果并不理想。本研究建立的小鼠模型为探究这3株不同血清型畜禽源分离沙门菌的致病机制提供模型参考,并为抗沙门菌疫苗和药物的评价奠定基础。
