1株鸭源污染棒状杆菌的分离鉴定与致病性分析
2021-07-08李超张若楠李海宾冯政王希玉仲艳秦涛陈素娟彭大新
李超,张若楠,李海宾,冯政,王希玉,仲艳,秦涛,3,陈素娟,3,彭大新,3,4*
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3.江苏省家禽疫病防控工程技术研究中心,江苏 扬州 225009;4.江苏省人兽共患病学重点实验室,江苏 扬州 225009)
棒状杆菌是革兰阳性菌,多为人类皮肤和黏膜的正常菌群,一般无致病性,只有当它转移至非正常寄居部位或机体抵抗力下降、外伤经伤口感染时才引起机体感染[1]。但近年来,对于棒状杆菌的感染报道越来越多,逐渐引起重视,如可从人的关节[2]、生殖道[2]、火鸡的尾脂腺、牛和啮齿类动物[3-5]中分离到致病性棒状杆菌。某些棒状杆菌可以造成羊、牛等动物的淋巴结肿大以及内脏的出血和化脓症状[6-7]。禽类中也有少量报道,如路振香等[8]和王振忠等[9]分别从鸡和鸭中分离到棒状杆菌,但致病性未知。
棒状杆菌生物学分型包含假白喉棒状杆菌、白喉棒状杆菌、假结核棒状杆菌、干燥棒状杆菌、微小棒状杆菌、类酵母棒状杆菌及纹带棒状杆菌等[9]。污染棒状杆菌(Corynebacteriumpollutisoli)是由Vivek等[10]于2016年从印度某垃圾场采集的土壤样本中首先分离到。最近有报道,污染棒状杆菌在碱性发酵及污水处理方面的潜在应用价值[11-13]。但到目前为止,尚未在动物体中分离到污染棒状杆菌。本研究从1例皮肤损伤的肉鸭中分离鉴定出污染棒状杆菌,并对其致病性进行初步分析,为临床诊断提供理论依据。
1 材料与方法
1.1 病例背景
2020年4月,江苏某樱桃谷肉鸭屠宰加工场屠宰38~42日龄肉鸭发现皮肤损伤的比例偏高,低的约为3%~5%,高的可达70%~80%。收集原养殖场中有皮肤损伤的鸭进行病原分离。
1.2 材料
绵羊血琼脂培养基和LB培养基自行配制;细菌生化管和药敏纸片购自杭州天和微生物试剂有限公司,批号分别为20190125和S1028;2日龄的健康雏鸭,购自泰兴丽佳农牧股份有限公司。
1.3 病原的分离鉴定
将病死鸭进行剖检、观察,拍照记录。无菌采集脏器,对鸭常见病毒病的病原如细小病毒[14]、圆环病毒[15]进行PCR检测和黄病毒[16]进行RT-PCR检测;对肝脏进行表面消毒后,无菌接种环沾取病料,三区划线接种于无菌脱纤维绵羊血琼脂培养基,于37 ℃恒温培养箱中静置培养16 h,挑取疑似菌落纯化培养。
1.4 革兰染色和镜检
挑取纯化培养后的单个疑似菌落,进行革兰染色、镜检,观察细菌形态及染色特性。
1.5 细菌鉴定
将细菌煮沸裂解,制备其 DNA 模板,参照 16S rDNA Bacterial Identification PCR Kit 方法进行 PCR扩增,然后经过琼脂糖凝胶电泳进行鉴定,将 PCR扩增产物胶回收后送南京金斯瑞生物科技有限公司进行测序。PCR所用棒状杆菌属保守rpoB基因[11]的引物序列见表1。

表1 PCR引物
PCR反应体系为25 μL:2×TaqMix 12.5 μL,上下游引物各1 μL,DNA模板1 μL,ddH2O补至25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性45 s;55 ℃退火45 s;72 ℃延伸1 min,共30个循环;72 ℃延伸10 min,4 ℃保存。rpoB基因扩增的退火温度为60 ℃,其他条件同上。
1.6 生化试验
无菌操作将纯化的细菌接种于细菌微量生化鉴定管,放入恒温培养箱中,37 ℃培养24~48 h,观察结果。
1.7 药敏试验
将细菌接种至LB琼脂培养基,按美国临床实验室标准委员会2005年推荐的 K-B 纸片法的要求进行药敏试验并对结果进行判定[17]。
1.8 致病性试验
将分离到的菌株接种于血琼脂,37 ℃培养10 h。用麦氏比浊法测定菌液浓度,将 36只2日龄雏鸭,随机分为 9组,每组4只,1、2两组为腹腔接种, 3、4两组为皮下接种,5、6两组为划痕接种,接种量分别为1.1×108和1.1×109CFU/mL细菌悬液 0.5 mL,同时设健康对照组,注射同等剂量的15%甘油PBS。连续观察14 d,并记录感染鸭发病死亡情况。如出现死亡则立即解剖,未死亡鸭扑杀后解剖,无菌采集肝脏、肺等组织,分离病原,进一步鉴定。
2 结果
2.1 剖检病变
剖检病鸭,肉眼可观察到肺边缘有散在的出血点;肝脏土黄色,坏死肿大;胰腺肿大;皮肤局部有红点或融合成疹块(图1)。
2.2 分离培养
组织样品接种培养基37 ℃培养16 h后,挑取单个菌落纯化,再培养16 h观察菌落形态,血平板表面可见淡黄色透明光滑菌落,不溶血;LB琼脂培养基上可见淡黄色透明光滑菌落。组织样品中未检测到细小病毒、黄病毒、圆环病毒。
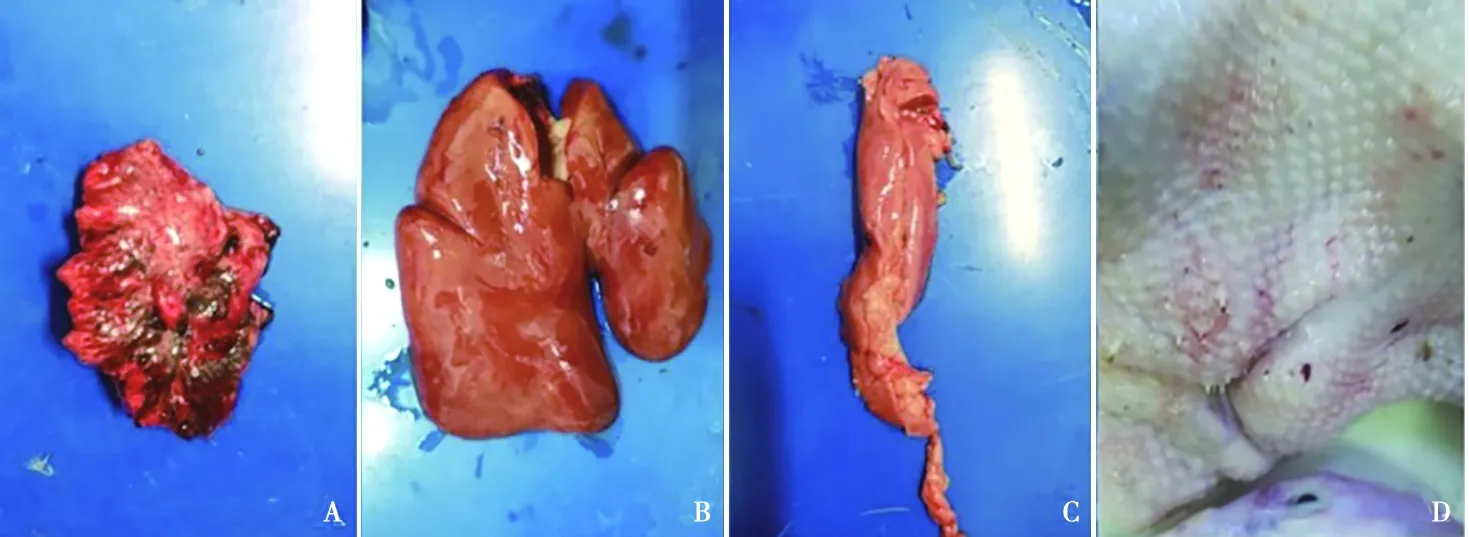
A.肺脏上有出血点;B.肝脏肿大,呈土黄色;C.胰腺肿大;D.皮肤损伤
2.3 革兰染色镜检
细菌革兰染色结果显示,分离菌为革兰阳性菌,可见一端或两端膨大,大多为杆状,部分成“八字形”。
2.4 生化鉴定
该菌能发酵葡萄糖,不能发酵山梨醇、棉子糖、木糖、蔗糖;葡磷胨水(MR、VP)试验、硫化氢、鸟氨酸脱羧酶、苯丙氨酸、靛基质、枸橼酸钠为阴性。参照《常见细菌系统鉴定手册》可知,该菌与棒状杆菌属部分细菌的生化特性相似。
2.5 16S rDNA 基因扩增及序列分析
16S rDNA基因扩增电泳结果显示,在1 500 bp左右有一明显条带(图2) 。将测定的16S rDNA基因序列结果在NCBI网站(http://www.ncbi.nlm.gov/BLAST)进行BLAST搜索比对,与棒状杆菌属的成员相似性最高。与26株棒状杆菌属细菌的16S rDNA 基因序列的同源性在94%~100%之间(图3),其中与棒状杆菌(Corynebacteriumpollutisoli)VDS11TNR_151947.1的同源性为100%。分离株命名为污染棒状杆菌JS01。
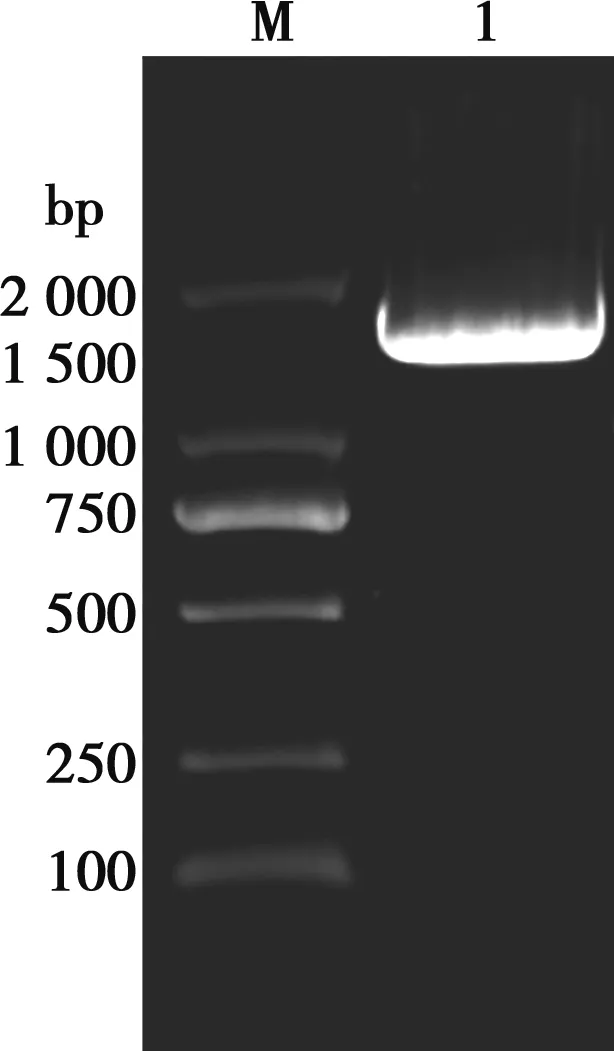
M. 2000 bp Marker;1. 分离菌

图3 16S rDNA基因序列同源性分析
2.6 药敏试验
在测定的19种常见药物中,JS01分离株对头孢氨苄、庆大霉素、阿米卡星等5种药物敏感,对青霉素、羧苄青霉素、诺氟沙星等13种耐药,多重耐药率为87.5%,耐药情况严重。具体结果见表2 。
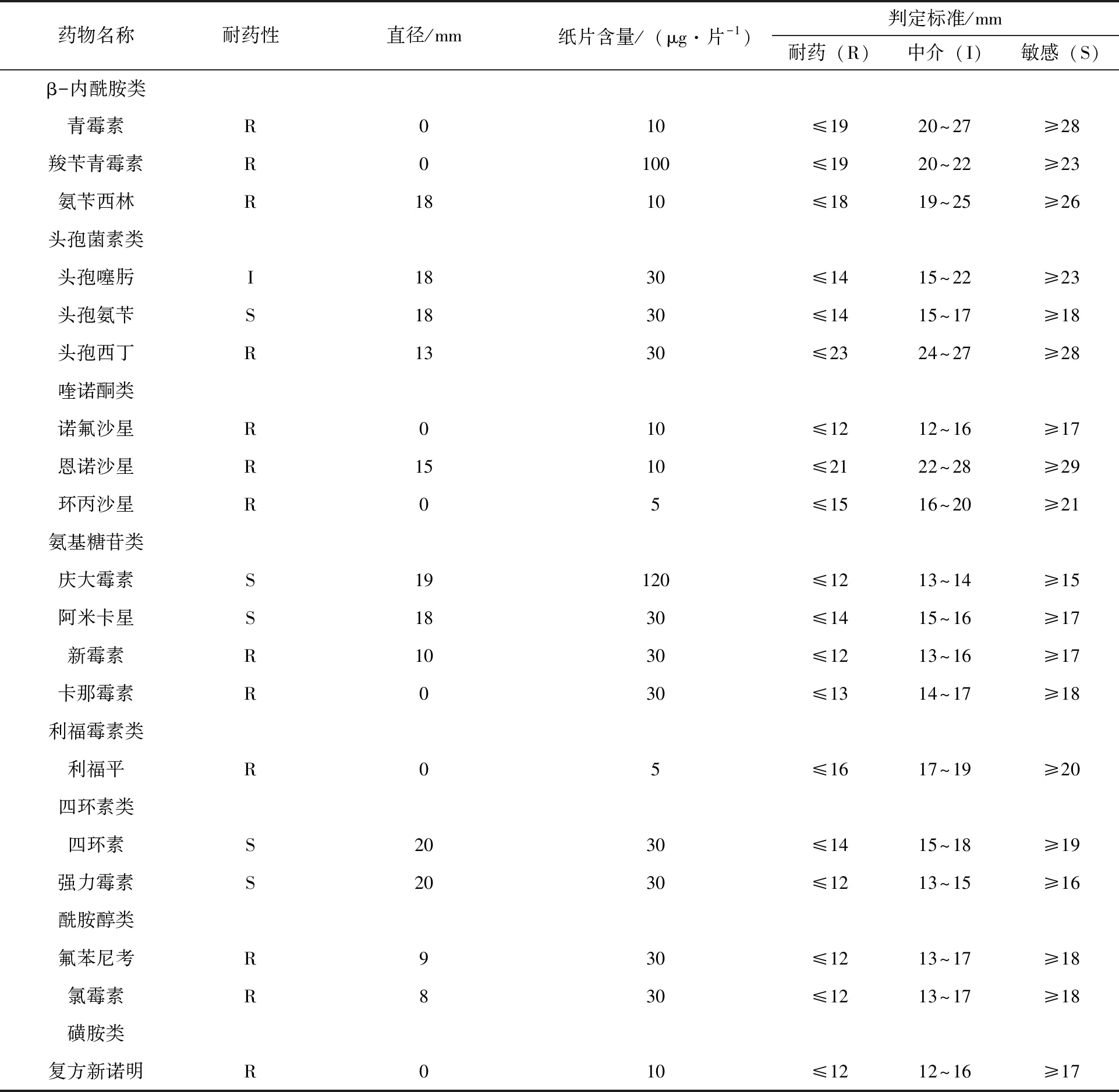
表2 JS01分离菌的耐药性测定
2.7 致病性试验
JS01株5.5×108CFU剂量腹腔接种组雏鸭于攻菌后第2、4、5天各死亡1只,5.5×107CFU剂量组第4天死亡1只,对照组在2周内未见发病。剖检死亡雏鸭发现,肝脏明显肿大、肺脏出血、其他脏器病变不明显。从死亡雏鸭的肝脏和肺脏再次分离病原并经PCR鉴定为污染棒状杆菌(图4)。JS01株皮下接种雏鸭未见发病。划痕接种5.5×108CFU剂量组在攻菌后第2、3天各2只雏鸭出现皮肤损伤,5.5×107CFU剂量组第3、7、14天各1只雏鸭出现皮肤损伤,但未见死亡;14 d后剖检攻菌组雏鸭发现肝脏、肺脏出血,其他脏器病变不明显,从雏鸭的肝脏和肺脏和损伤皮肤中再次分离病原并经PCR鉴定为污染棒状杆菌(图4)。对照组2周内未见发病。JS01株感染雏鸭后的死亡率见表3。

表3 JS01株感染雏鸭的致死情况
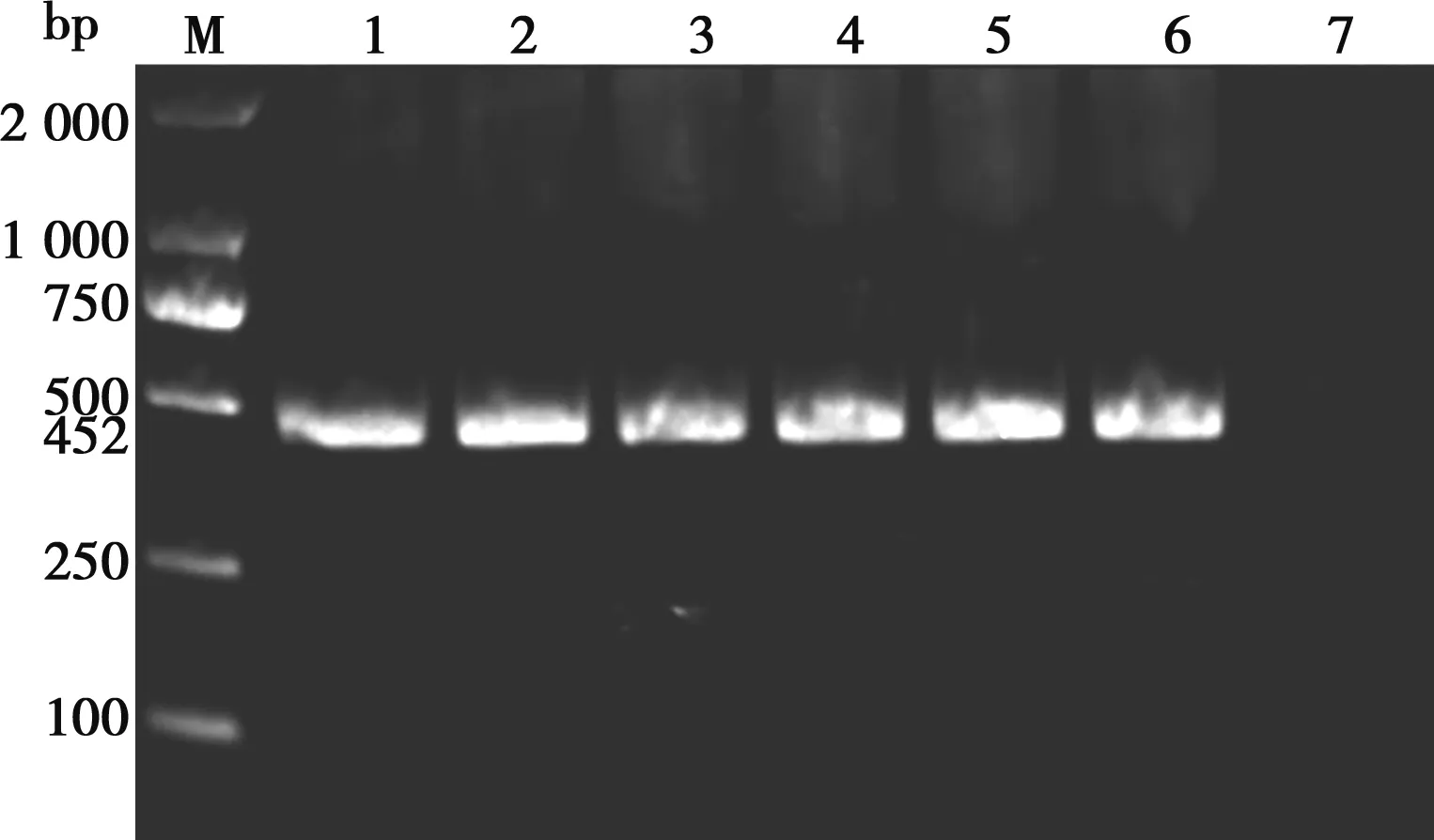
M. 2000bp Marker;1.腹腔接种鸭肝脏;2.腹腔接种鸭肺脏;3.划痕接种鸭肝脏;4.划痕接种鸭肺脏;5.划痕接种鸭皮肤;6.阳性对照;7.阴性对照
3 讨论
棒状杆菌为需氧、无芽孢、有特殊排列规则的革兰阳性杆菌,多数是人类皮肤和黏膜的正常菌群,一般被视为条件致病菌。但近年来,已经成为一个世界性公共卫生问题[18]。随着人群老龄化、器官移植的开展、免疫抑制剂的大量使用,以及各种社会因素的影响,从上呼吸道感染、肺部感染、血液中棒状杆菌的分离率逐渐升高[19],尤以纹带棒状杆菌的分离率最高[20-22]。
本研究从皮肤损伤的肉鸭体内分离到了污染棒状杆菌,通过细菌形态观察及生化试验结果显示,该菌在血琼脂培养基上呈现淡黄色光滑菌落,革兰染色阳性的呈球状、球杆状或棒状杆菌,与王斌等[23]分离的伪结核棒状杆菌结果一致。本研究感染试验中,分离菌5.5×108CFU经腹腔接种2日龄健康雏鸭可致75%雏鸭死亡,而田雪等[24]分离的棒状杆菌以最高剂量1.0×109CFU攻毒7日龄肉鸭,对肉鸭没有致病作用,与我们的结果有所差异,分析可能与不同血清型菌株的致病能力以及所选攻毒动物的日龄有关。致死雏鸭剖检结果显示其肝脏肿大呈土黄色、肺脏出血,这与王振忠等[9]和黄丽丽等[25]所分离棒状杆菌动物的病理图片大致一致。本研究发现,划痕接种5.5×108CFU剂量组100%出现皮肤损伤,5.5×107CFU剂量组雏75%出现皮肤损伤。药敏试验结果表明该菌具有多重耐药性,多重耐药率高达87.5%,可能与该养殖场抗生素的使用有关,滥用抗生素会导致各类细菌的耐药性增加。
本文首次报道了棒状杆菌感染动物的病例。究其原因,与养殖场的饲养环境不佳有关,可导致鸭的非特异性抵抗力下降;再加上该病原广泛存在于自然界中,这也是鸭体感染的可能原因之一。
综上,本研究从病死的鸭体内成功分离到1株污染棒状杆菌;该菌对大多数抗生素药物耐药,耐药谱广。该菌感染既可造成雏鸭死亡,也可导致皮肤损伤。
