241例腹壁子宫内膜异位症临床分析*
2021-07-05师少乐李春艳李明江
李 瑞,师少乐,张 辉,李春艳,李明江
(山东大学附属省立医院妇科,济南 250021)
子宫内膜异位症(Endometriosis,EMs)是指子宫内膜腺体和间质组织位于正常子宫内膜位置外[1-6],影响着6%~10%的育龄妇女[7],异位的子宫内膜组织主要见于腹膜表面、卵巢及直肠阴道隔[8],盆腔外Ems很少见,腹壁是盆腔外EMs最常见部位[1]。腹壁子宫内膜异位症(abdominal wall endometriosis,AWE)是指异位子宫内膜组织出现在皮下脂肪层和(或)腹壁肌肉中[9-10],通常发生于手术瘢痕内或瘢痕周围,是由盆腔手术如剖宫产术或子宫切除术引起[11]。目前全世界剖宫产手术的使用率越来越多,手术后EMs的亚群也相应增加[12]。然而,AWE的临床表现、发生时间和位置的高度可变性,使得诊断变得更加困难。临床上AWE常被误诊为血肿、脂肪瘤、肉芽肿、疝、脓肿、纤维瘤病、肉瘤或其他恶性肿瘤[13-15],错误的诊断和不及时的治疗常给患者及其家庭造成巨大的损害。目前国内外关于AWE的相关临床病例研究报道较少,本文回顾分析了241例AWE患者的临床资料,旨在探讨AWE的临床分型、临床特点、治疗方法及预后情况。
1 资料与方法
1.1 资料来源 2010年1月1日至2019年12月31日于山东大学附属省立医院妇产科诊治的EMs患者共3555例,其中AWE患者241例,占6.8%,5例因个人原因出院,其余236例均行手术治疗。术后4例因不明确原因未做病理检测,其余232例术后均行病理证实为AWE。13例患者因外院AWE术后复发就诊于我院。术后随访至2020年8月。回顾分析患者的发病年龄、首发症状、潜伏期、剖宫产次数、CA125数值、分型、治疗、复发率等。
1.2 分组及基本概念 根据术中探查内异症病灶底部侵及深度分为3型:(1)皮下型,病灶底部侵及皮下脂肪层,未达腹直肌前鞘;(2)鞘膜型,病灶底部侵及腹直肌鞘(前层及后层)或腹直肌,未达腹膜;(3)腹膜型,病灶底部侵及腹膜或达腹腔。根据病灶数分为单发型和多发型(包块≥2个)。根据是否同时合并盆腔EMs分为单纯型(AWE)及复杂型(AWE合并盆腔EMs)。根据是否复发分为复发组及未复发组。发病潜伏期指末次开腹手术(剖宫产或妇科手术)时间至出现症状。病程指出现症状到手术治疗时间。总病程指潜伏期与病程时间的总和。
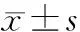
2 结 果
2.1 一般情况 241例AWE患者的平均发病年龄(30.6±4.6)岁(21~45)岁,其中238例(98.8%)既往有剖宫产手术史,2次剖宫产史占15.5%(37/238),2例仅有子宫肌瘤挖除术史,1例仅有左侧卵巢子宫内膜异位囊肿剥除术史。平均初潮年龄(13.9±1.4)岁,月经规律228例,占94.6%。
2.2 症状和体征 225例(93.4%)患者因触及明显腹壁包块就诊。228例(94.6%)患者因刀口处或周围疼痛就诊,其中189例(82.9%)患者的疼痛与月经周期有明显相关性。11例患者主要因卵巢囊肿或子宫腺肌症就诊,术中才发现腹壁内异症包块。患者病程中位数为15.0月(6.0~36.0月),发病潜伏期中位数为33.0月(15.0~52.5月),其中最长1例潜伏期为21年。
2.3 辅助检查 208例(86.7%)AWE患者术前行超声检查,超声多表现为低回声实性或囊性包块或结节,边界欠清,形态不规则,内回声不均。其中95例(45.7%)病灶内部或其周边可探及明显点状或点条状血流信号,皮下型、鞘膜型和腹膜型各组间超声提示有无血流信号的病例数相比,差异无统计学意义(P>0.05)。病灶直径中位数为2.4cm(1.6~3.4cm)(其中多发病灶取直径最大者计算)。93例(38.6%)患者术前检测血清CA125中位数为24.3U/mL(16.4~46.4U/mL)(参考值0~35U/mL)。其中5例未行手术治疗。33例患者CA125大于正常值,其中9例合并EMs,6例为多发病灶。皮下型、鞘膜型和腹膜型的血清CA125水平相比,差异有统计学意义(P<0.05);单纯型和复杂型的血清CA125水平相比,差异有统计学意义(P<0.05);单发型和多发型的血清CA125水平相比,差异无统计学意义(P>0.05)。见表1。

表1 病变类型与血清CA125的关系
2.4 手术情况
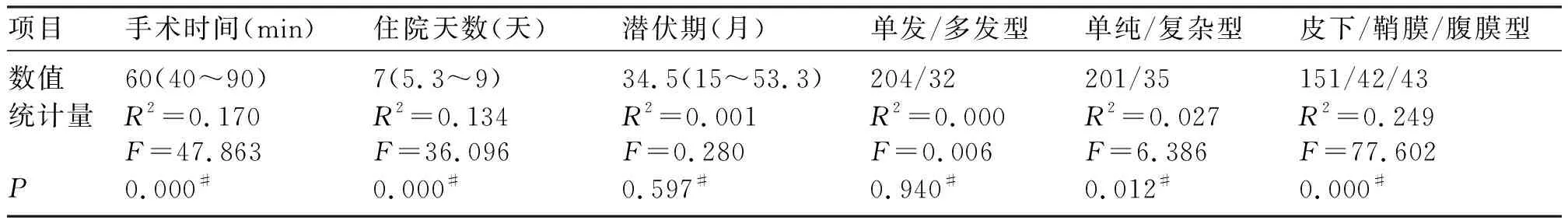
2.4.1 病灶特点 术中探查病灶直径中位数为3.0cm(2.0~4.8cm),单发型86.4%(204例),多发型占13.6%(32例),其中22例(68.8%)存在2个病灶,其余存在3个及以上病灶,超声提示多发型与术中探查相符率37.5%(12/32)。单发型和多发型的手术时间及术中出血量相比,差异有统计学意义(P<0.05)。见表2。横切口217例(92.0%),竖切口19例(8.0%)。根据术中探查见皮下型42例(17.8%),鞘膜型151例(64.0%),腹膜型43例(18.2%),23例穿透腹膜,其中2例与大网膜广泛粘连,5例侵及膀胱,1例侵及膀胱后壁肌层,行膀胱部分切除术。皮下型、鞘膜型和腹膜型的病灶大小及术中出血量相比,差异有统计学意义(P<0.05),且经LSD检验,病灶直径越大,侵及深度越深,差异有统计学意义(P<0.05)。见表3。患者病程与病灶大小存在正相关,差异有统计学意义(P<0.05),病程越长,病灶越大。病灶大小与潜伏期及总病程无明显相关性,差异无统计学意义(P>0.05)。见表4。

表2 单发型和多发型一般资料比较

表3 三种病变类型一般资料比较

表4 病灶大小与其它指标线性回归分析
续表4
2.4.2 手术治疗 除5例患者因个人原因出院,其余236例均行手术治疗。术中切除原手术瘢痕4例(1.69%),术后随访均未复发。手术切除病灶边缘0.5cm以上。单纯行AWE病灶切除术者199例(84.3%),同时行其他手术操作者37例,卵巢子宫内膜异位囊肿切除术14例,子宫肌瘤切除术11例,宫腔镜息肉摘除、刮宫、取环术7例,子宫全切术4例,子宫颈锥形切除术1例。根据术中病灶大小及家属意愿放置补片14(5.9%)例,其中1例因病损巨大放置2个补片;222例未放置补片,其中18例患者术后给予引流管引流。术中出血量中位数为20ml(10~50mL)。手术时间中位数为60min(40~90min)。病灶大小与手术时间、术中出血量、是否放置补片、单纯型和复杂型、皮下型鞘膜型和腹膜型及住院天数存在正相关,差异有统计学意义(P<0.05),即病灶越大,手术时间越长,术中出血量增加,术中需放置补片的概率也会增加,易合并盆腔EMs,病灶侵及越深。见表4。术中单纯型201例,复杂型(合并盆腔EMs)35例。单纯型和复杂型的发病年龄、病灶大小、病程、手术时间及术中出血量比较,差异有统计学意义(P<0.05),即合并盆腔EMs(复杂型)的患者往往发病年龄相对较大,病灶直径大,病程长,手术时间长,术中出血量大。见表5。术后4例因不明原因未做病理检测;232例患者行病理检测,均提示AWE,未见恶变者。

表5 单纯型和复杂型的一般资料比较
2.5 药物治疗、随访及复发情况
2.5.1 药物治疗 术前41例曾用药治疗,消炎止痛药22例,中药物理疗法10例,孕三烯酮2例,米非司酮3例,妈富隆2例,GnRH-a 2例,多数效果不佳,虽部分可暂时缓解症状,但停药后立即复发。术后26例进行药物治疗,其中GnRH-a 13例,米非司酮8例,孕三烯酮4例,达英-35 1例。
2.5.2 随访及复发情况 术后随访(8~128)月,失访55例。5例自动出院患者中2例失访,其余3例至今均未手术,1例中药治疗,症状有所缓解,已近绝经;1例因先天性心脏病不建议手术,2016年始GnRH-a治疗至今,现症状有所缓解,病灶未见增大;1例自出院至今未作任何处理,自述经期时刀口左侧疼痛剧烈,右侧不明显,仍坚持继续观察。未复发+失访组220例(未复发165例+失访55例),7例术后再次妊娠行剖宫产术,刀口瘢痕处未见异常;7例刀口处偶有与经期无关的麻木、酸痛、弯腰痛等症状;4例因病损巨大,刀口张力大,用力时常有牵拉疼痛感,1例术后近10年,用力时仍有刀口疼痛;4例患者表示刀口处阴雨天疼痛明显;2例患者下腹部手术部位左右不对称,极不美观。复发组16例(6.8%),其中2例因外院手术治疗后复发就诊我院,于我院手术治疗后现再次复发,2例再次行AWE手术治疗。平均复发时间25.3个月,术后药物治疗的26例患者均未复发。通过筛查分析(取P<0.2),病灶数、直径、潜伏期、手术时间是AWE复发的相对危险因素。其中病灶数为AWE复发的独立危险因素(P=0.033),与单发型相比,多发型AWE患者复发风险远高于单发型(HR=3.152,95%CI为1.095~9.078)。见图1。其中1例患者既往体健,1次剖宫产史,剖宫产术后第2年发现多发腹壁包块,且逐渐增大,术后第4年行AWE手术,术前给予GnRH-a治疗3月,自述包块减小。术后1年内发现再次复发,于当地行AWE手术。术后2年再次出现复发,现超声提示直径2cm,经期疼痛明显,暂未处理。
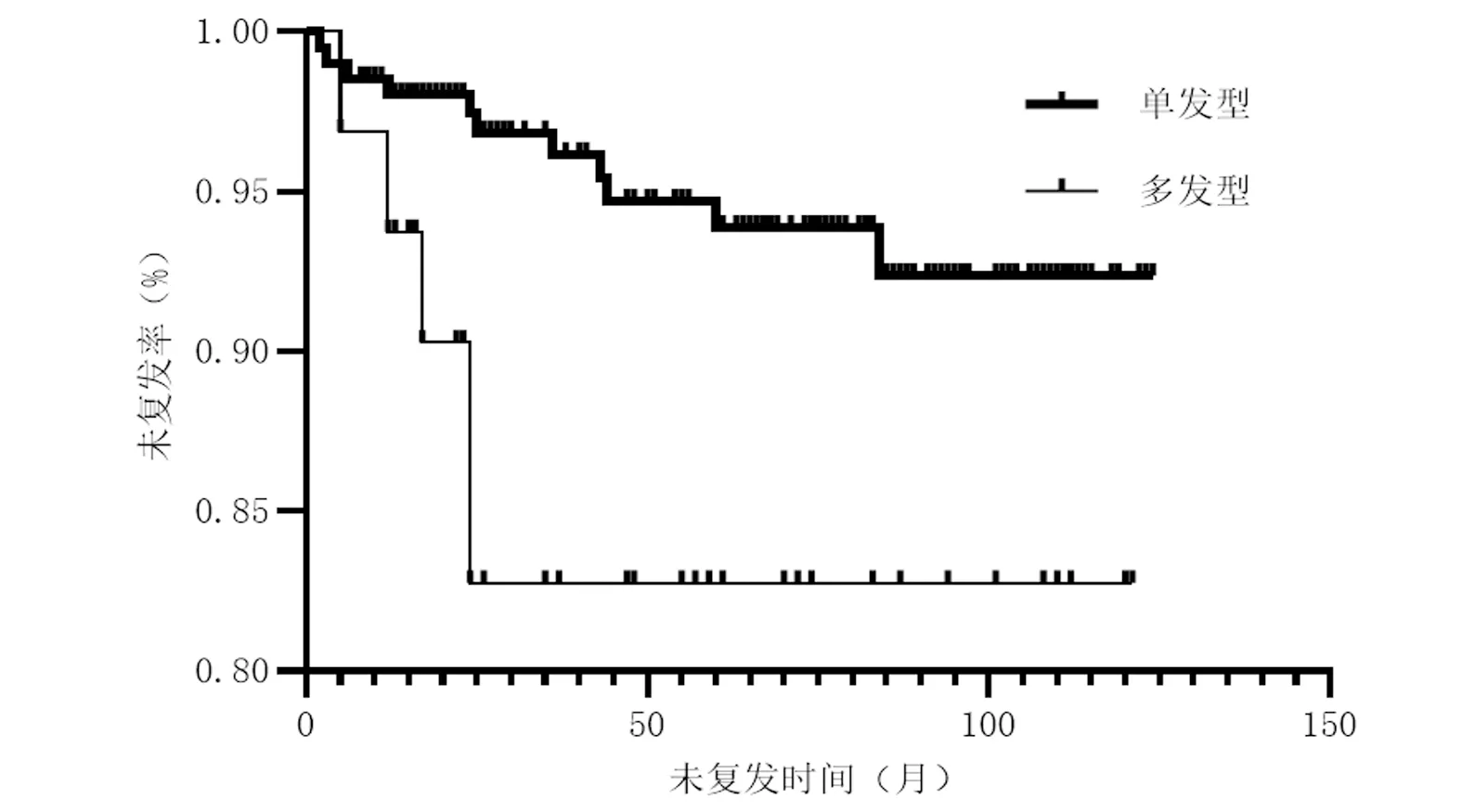
图1 单发型及多发型腹壁EMs未复发曲线(Log-rank test)
3 讨 论
3.1 发病率及发病机制 Meyer于1903年报道了第一例腹部EMs[16-17],之后陆续有所报道,但AWE较罕见,很难得到确切的患病率,一般认为AWE的患病率在0.03%~1%之间[15-16]。妇产科手术史是腹壁EMs发病的最重要的危险因素,尤其是剖宫产手术史,剖宫产术后的AWE发生率约为0.03%~2%[14,18]。本研究中,98.8%(238例)的患者既往有剖宫产手术史,可见绝大部分AWE的发生与剖宫产术有着密不可分的关系。剖宫产手术过程中有活性的子宫内膜组织直接暴露于手术切口附近,切口愈合过程中,新生的毛细血管可为异位内膜组织提供丰富的血供,大大增加了内膜种植的风险。理论上,任何存在直接或间接接触子宫内膜组织的手术操作,都可能成为AWE的发病诱因,如穿透宫腔的子宫肌瘤挖除术等,这种医源性植入理论被广为接受。然而,近年来也有许多自发性AWE的病例报道,它的发生占AWE的20%[4,19],自发性AWE的发病率约为0%~38%[19]。自发性AWE的患者既往无任何手术史[20-22],却可在腹壁形成典型的子宫内膜异位灶,医源性种植理论显然是解释不通的,体腔上皮化生理论、淋巴和(或)血液传播理论、细胞免疫改变理论等的提出很好地解释了自发性AWE的发病机制,逐渐被大家认可。本研究中未收集到自发性AWE的病例,考虑为样本量过少的原因。
3.2 临床特征及诊断 目前认为AWE的典型临床表现为:剖宫产手术史、腹部瘢痕处包块和月经周期疼痛三联征[23]。本研究中,所有病例都有腹部手术史,其中有既往剖宫产史者占98.8%。93.4%患者因触及明显腹壁包块就诊,94.6%患者因刀口处或周围疼痛就诊,其中82.9%患者的疼痛与月经周期有明显相关性。11例患者因其他妇科疾病入院手术,术中发现AWE的存在。可见并不是所有患者都具有典型的三联征表现,很多患者仅仅是因为触及到刀口包块或因刀口处疼痛感就诊,甚至没有任何临床表现,大大增加了疾病的临床诊断难度。相关辅助检查可为疾病诊断提供重要依据。超声检查是最好的筛查方法[12],具有无创、实用、低成本等优势[24]。本研究中86.7%的患者行超声检查,结果均提示腹壁包块存在。细针穿刺细胞学检查是一种快速、准确、廉价的术前诊断方法[23],因为其是有创操作且具有潜在二次种植的风险,临床应用较少。其他辅助检查,如计算机断层扫描(CT)和磁共振(MRI)仅用于术前评估病灶侵及程度[25],不用做常规检查方法。
临床上普遍认为,血清CA125在诊断AWE中没有特异性。本研究通过对AWE不同分型间的比较,发现皮下型、鞘膜型和腹膜型AWE的血清CA125水平相比,差异有统计学意义(P=0.011),通过S-N-K检测,腹膜型血清CA125水平明显高于其它两型,这一结果可能是因腹膜型病灶较大且常常穿透腹腔,造成损伤范围广泛。单纯型和复杂型AWE的血清CA125相比,差异有统计学意义(P=0.011),复杂型常合并盆腔内异症,这可能是引起血清CA125表达较高的原因之一。可见术前血清CA125的检测是必要的。血清CA125在指导AWE临床分型中可能存在一定价值,这一点还需更大样本量的临床研究去证实。病理组织检查是诊断AWE的金标准。AWE很少发生恶变(1%的病例)[4,24],恶变中最常见的组织学亚型是透明细胞癌[26],其20个月的生存率仅为57%,若病灶反复复发常提示存在恶变可能。
3.3 分型特点 为了更好地分析不同类型AWE的临床表现特点,指导临床治疗和管理,本研究根据不同条件对AWE进行分型。根据术中探查内异症病灶底部侵及深度分为3型:皮下型、鞘膜型及腹膜型,这三型中腹膜型AWE最复杂,病灶较大,侵及范围广、浸润深,常常穿透腹膜进入腹腔,与大网膜广泛粘连,甚至侵及膀胱肌层,需请泌尿外科医师台上会诊行部分膀胱切除修补术。本研究中腹膜型病灶的直径大于鞘膜型及皮下型,术中出血量也显著高于其他两型(P<0.05)。血清CA125对AWE诊断的敏感性及特异性较低,但是腹膜型AWE患者血清CA125表达相对较高(P<0.05)。术前超声若提示病灶直径大且血清CA125水平较高者,应考虑腹膜型AWE。可见,术前超声检查及血清CA125的测定对AWE的分型具有指导意义。临床上可根据AWE的分型对疾病严重程度做出初步评估,指导术前备血、术中补片使用、术中麻醉药物剂量使用等。本研究根据病灶数分为单发型和多发型(包块≥2个),发现多发型AWE的手术时间及术中出血量大于单发型(P<0.05),病灶数为AWE复发的独立危险因素(P=0.033)。与单发型相比,多发型AWE患者的复发风险远高于单发型(HR=3.152,95%CI为1.095~9.078)。因此,对于诊断为多发型AWE的患者,术前充分告知患者存在较高复发风险,充分做好术前准备,术中尽可能切除所有病灶,术后建议给予药物治疗预防复发。根据是否同时合并盆腔EMs分为单纯型(腹壁EMs)及复杂型(腹壁EMs合并盆腔EMs),复杂型AWE的血清CA125水平远高于单纯型AWE(P<0.05),复杂型AWE患者的发病年龄、病灶大小、病程、手术时间及术中出血量大于单纯型(P<0.05),即合并盆腔EMs(复杂型)的患者往往发病年龄相对较大,病灶直径大,病程长,手术时间长,术中出血量大,复杂型AWE常合并卵巢子宫内膜异位囊肿,术前除了做好腹壁EMs病灶切除准备外,还应考虑卵巢子宫内膜异位囊肿剥除。由上可见,对AWE进行详细分型是有必要的,有助于指导临床工作,不同分型的AWE术前、术中及术后有着不同的注意事项。目前尚未形成规范的AWE分型标准,仍需大样本量临床研究总结。
3.4 治疗及复发 本研究结果显示,患者病程与病灶大小存在正相关,差异有统计学意义(P<0.05),病程越长,病灶越大,且病灶越大,侵及越深、范围越广,越容易穿透腹腔合并盆腔EMs,术中放置补片的概率会增加,手术时间和术中出血量会相应增加,给患者的精神及经济造成巨大损害。因此,本病应早发现、早诊断、早治疗,一旦确诊应尽早治疗。AWE最有效的治疗方法是手术切除病灶[10,23,27-28],切除范围至少超过病灶边缘1cm[4,14,29]。药物治疗的成功率很低,只能暂时缓解症状[17],停药后往往立即复发。一些文献中主张在特殊情况下应用激素治疗,其主要目的是减小病灶包块,降低手术难度,减少术中出血[24]。本研究中1例因先天性心脏病不建议手术治疗的患者,2016年始GnRH-a治疗至今,症状有所缓解,病灶未见增大,对于这种特殊患者,药物控制治疗显得非常重要。关于AWE的复发率,文献报道不尽相同,约为1.5%~17.4%[23-24,30]。本研究中,复发患者16例,占6.8%,与报道相符。通过Cox回归单因素分析(取P<0.2),结果提示病灶数、直径、潜伏期、手术时间是AWE复发的相对危险因素。其中病灶个数为影响AWE的独立危险因素(P=0.033),与单发型相比,多发型AWE患者复发风险远高于单发型(HR=3.152,95%CI为1.095~9.078)。因为复发患者中再次复发的部位不全是之前AWE手术部位,推测多发型复发风险高的可能原因是病灶多发,术前术中存在漏诊。多发型患者的每个病灶处于不同的状态(有的表现为可触及的腹部包块;有的仅是轻微疼痛,未触及明显包块;有的仍处于潜伏期),手术过程中术者可能把注意力集中于表现明显包块的病灶上,忽略其他潜在病灶,手术刺激(术中出血、术后血管重建等)后潜在病灶逐渐表现出来,出现“复发”表现,这还需要大样本的研究证实。术后给予药物治疗的26例患者均未复发,术后药物治疗对预防复发可能存在一定价值。
综上所述,AWE应早发现、早诊断、早治疗。随着病程延长,病灶直径增大,治疗成本及手术风险也会增加,一旦确诊,应立即手术治疗。对于多发病灶,术前应充分评估、术中仔细探查,尽可能地切除所有病灶,可减少复发风险。术中应尽量减少不必要的组织及神经损伤,对于病灶较大者,要考虑术后刀口的美观性。AWE与妇产科手术关系密切,尤其是剖宫产术,严格控制剖宫产指征对于减少AWE发生具有重要意义。AWE的有效分型对临床治疗和患者管理具有指导价值,超声检查和血清CA125对AWE分型可能有一定意义。术后及时药物治疗可能对预防疾病复发有一定价值。由于本研究样本量相对较少,得出的结论还需进一步大样本量研究证实。
