卒中后呼吸系统感染气道管理专家指导意见
2021-07-03董漪叶婷董强执笔作者
董漪,叶婷,董强(执笔作者)
根据《中国脑卒中防治报告2019》的数据,我国40岁及以上人群的卒中人口标化患病率不断上升,由2012年的1.89%上升至2018年的2.32%[1]。由此推算,我国40岁及以上卒中现患人数达1318万,其中仅2018年我国就约有194万人死于卒中[1]。肺部感染是卒中患者最常见的并发症。我国缺血性卒中和出血性卒中患者合并肺炎/肺部感染的比例分别为10.1%和31.4%,均居所有卒中相关并发症的首位[2]。
呼吸系统感染(respiratory tract infections,RTIs)影响鼻窦、咽、喉、气管或肺部。近年来,卒中后相关RTIs的研究多集中于卒中相关肺炎(stroke associated pneumonia,SAP)、吸入性肺炎(aspiration pneumonia,AP)和机械通气并发呼吸机相关肺炎(ventilator associated pneumonia,VAP)等方面[3-5]。广义而言,SAP定义为非机械辅助通气的卒中患者在发病7 d内新出现的肺炎,是加重卒中后脑损伤的重要危险因素[6]。AP定义为由于咳嗽、吞咽反射减弱等原因,导致患者口咽分泌物、胃内容物及食物反流误吸入肺而引起肺部炎症[7]。VAP专指卒中患者进行机械通气后相关的肺部感染,是影响重症卒中患者救治成功率的关键因素之一[8]。虽然不同类型卒中后RTIs的概念不尽相同,但都会影响患者预后,需要早期对其进行规范管理,以降低患者的感染率和致残率。鉴于此,我们联合神经内科、呼吸科及重症医学科等多学科专家共同制订指导意见,专注于卒中后全呼吸道的管理流程,包括上呼吸道和下呼吸道感染,为预防卒中后RTIs提供可参考的临床实践应用规范。
1 卒中后呼吸系统感染的危险因素
本指导意见将卒中后RTIs的危险因素分为不可调控危险因素和可调控危险因素,以便于临床医护人员提前识别和干预,从而减少RTIs的风险(表1)。
1.1 不可调控危险因素
1.1.1 年龄
高龄是卒中后RTIs的危险因素,年龄每增加1岁,SAP的风险增加1.096~1.113倍[9-10]。既往研究发现,急性缺血性卒中SAP患者以80岁以上更为多见,不同年龄段SAP的发生率分别为44.83%(≥80岁)、33.68%(65~79岁)和16.64%(50~64岁),不同年龄组之间差异有统计学意义(P<0.0001)[11]。
1.1.2 卒中严重程度
意识障碍是卒中常见的临床表现,也是急性卒中患者发生医院获得感染的独立危险因素(OR8.730,95%CI0.273~43.978)[12]。除昏迷患者外,思睡或嗜睡患者也表现出自主反射减弱,对外界环境变动的适应能力下降,继而可能出现各种的继发性伤害。一项回顾性研究分析了72例脑部疾病导致意识障碍的患者,发现感染部位以呼吸系统最多,高达54.7%[13]。除了意识障碍外,肢体残障等卒中严重程度(如NIHSS评分)也影响着RTIs的发生风险[14]。既往研究提示,在合并肺部感染的卒中患者中,63.63%为重症卒中(NIHSS>20分)[15]。
1.1.3 卒中分型
卒中分型也与疾病严重程度相关。美国一项纳入了596例缺血性卒中患者(21~89岁)的病例对照研究发现,RTIs更多地发生在大血管动脉粥样硬化或心源性栓塞患者中[16]。缺血性卒中发病1周内RTIs风险更高[17]。另外,根据牛津郡社区卒中项目分型(Oxfordshire Community Stroke Project Classification,OCSP),发病2周时,完全前循环梗死患者发生RTIs的比例高达33.3%,显著高于部分前循环梗死和后循环梗死患者(P<0.01),但6个月时不同OCSP分型患者的RTIs风险无显著差异[18]。
1.1.4 基础疾病
急性卒中患者常合并糖尿病、慢性心功能不全、慢性阻塞性肺疾病等基础疾病。高血压(OR3.873,95%CI1.939~7.592)、糖尿病(OR2.308,95%CI1.254~4.245)、高同型半胱氨酸血症(OR2.234,95%CI1.115~4.475)、高脂血症(OR1.886,95%CI1.043~3.412)等基础疾病均与RTIs相关[19-21]。此外,合并阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea,OSA)与卒中不良预后相关,研究证实OSA患者发生社区获得性肺炎的风险增加与呼吸暂停低通气指数(apnea hypopnea index,AHI)有关,其中AHI>30的患者(OR3.18,95%CI1.11~11.56)较AHI>10的患者(OR2.86,95%CI1.29~6.44)发生获得性肺炎的风险更大[22-23]。
1.1.5 吸烟史
吸烟本身可造成人体呼吸道微生态中细菌密度、数量及种类发生改变。既往吸烟会增加卒中患者RTIs的风险,原因可能是烟草中的有害物质对呼吸道三大防御机制,即黏液-纤毛转运系统、咳嗽反射和免疫系统均有直接的损害[24-25]。在卒中合并RTIs的患者中,吸烟患者呼吸道厌氧菌检出比例为非吸烟患者的2~8倍[26]。
1.2 可调控危险因素
1.2.1 吞咽障碍
吞咽障碍是SAP重要的独立危险因素[27]。吞咽障碍指吞咽过程的异常,患者不能将食物或液体从口腔安全送至胃内而易发生误吸,包括咀嚼、舌运动异常等[28]。合并吞咽障碍的卒中患者极易发生误吸,吸入物不仅包括患者口咽部的分泌物,还包括鼻腔分泌物、口腔内残留的食物、胃肠道内容物和反流的消化液。常见的感染病原体为G-杆菌、厌氧菌和金黄色葡萄球菌[29]。2018年《美国缺血性卒中早期管理指南》指出,急性缺血性卒中患者的吞咽障碍发生率达37%~78%[30]。重视吞咽功能受损症状,科学筛查评估,早期干预,可有效降低AP的发生[31]。
1.2.2 卒中相关的侵入性操作
为了诊疗需要,卒中患者会接受一些医源性操作以维持生命或预防并发症,这些侵入性操作可能会引发RTIs。如支气管镜、气管插管等侵入性操作可使外界环境与气道连通,细菌进入呼吸道并引起感染;留置胃管、空肠管等可影响胃贲门关闭,造成胃内容物食管反流。有研究发现侵入性操作可使急性卒中患者RTIs的发生率增加3倍以上[19]。
1.2.3 长期卧床
卒中患者常出现肢体功能受限或共济功能失调等症状,从而活动能力受限甚至卧床。长期卧床会导致呼吸肌力不足、气道引流不畅、分泌物滞留等问题,增加院内RTIs风险[32-33]。尤其是老年患者,各器官系统功能衰退,咳嗽反射减弱,痰多不易咳出[34]。痰液淤积在肺底,利于细菌增殖,引发坠积性肺炎,临床表现为咳嗽、发热、呼吸困难等症状[35]。
推荐意见:
建议尽早识别RTIs高危因素,以指导进一步治疗,高危因素总结见表1。对甄别出2条以上不可控因素或任何1条可控因素的患者,应立刻实施预防RTIs的相关医疗措施。
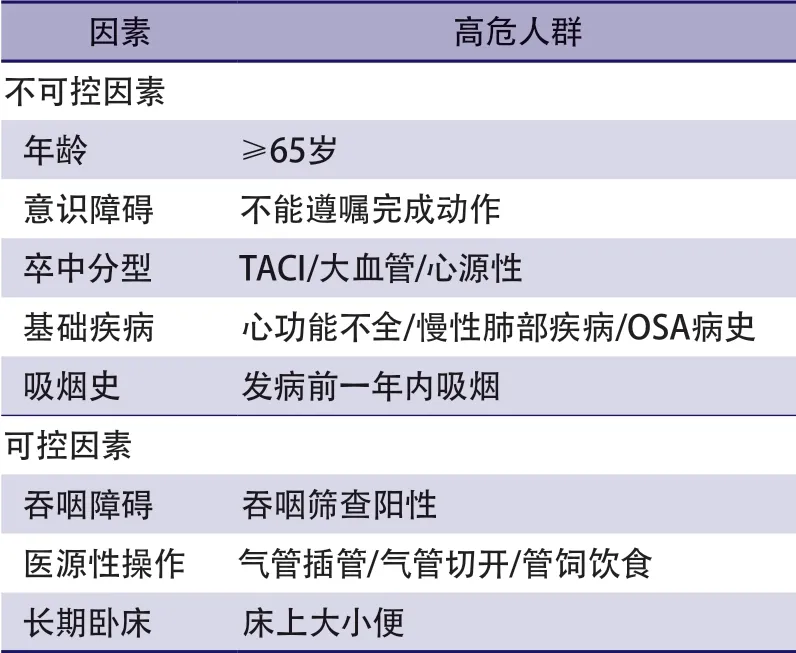
表1 卒中患者呼吸系统感染高危因素
2 卒中后呼吸系统感染相关的风险评估方法
根据上述可控的危险因素,专家组总结了针对RTIs风险的评估方法,包括吞咽筛查、神经功能和活动能力的评估等(图1)。
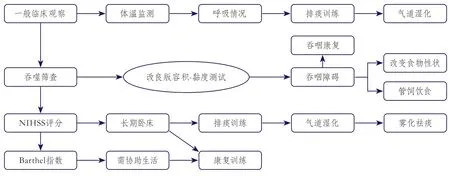
图1 卒中患者预防呼吸系统感染的筛查、评估和处理流程
2.1 吞咽筛查
急性卒中患者应在口服药物、食物(包括水)前完成吞咽筛查,尽早识别吞咽障碍。若无电视荧光吞咽造影检查(video fluoroscopic swallowing study,VFSS)条件,可通过床旁筛查区分能经口进食和存在吞咽障碍的患者,了解吞咽障碍严重程度,制订适合患者的治疗计划和策略[36]。
可普遍推广的吞咽障碍筛查方法要求简单、准确、可靠、安全、经济,且操作人员在床边即可完成。目前,国际上关于吞咽障碍筛查方法较多,但尚没有公认的、统一的标准。洼田饮水试验因其操作简便而普遍应用于临床,但是饮水无法评估患者吞咽其他非液态性状食物的情况。改良版容积-黏度测试作为一种安全简单的床旁工具(图2),已被验证适用于中国急性卒中患者,建议在临床推广[37-38]。
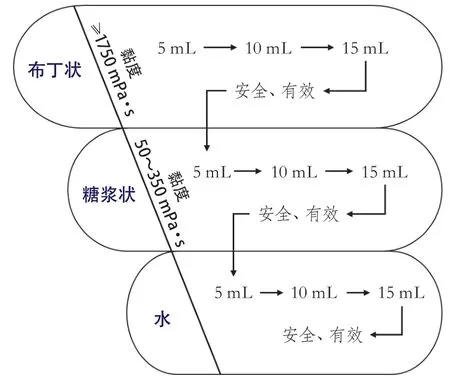
图2 改良版容积-黏度测试流程
2.2 神经功能评估
NIHSS可用来评估卒中患者病情的严重程度[39]。重症卒中患者的吞咽动作协调性减退,保护性咳嗽反射变弱,RTIs的风险可能增加[40]。既往巴西的研究发现合并吞咽障碍的卒中患者NIHSS评分与肺炎发生率风险相关(OR1.17,95%CI1.01~1.36)[41]。
2.3 活动能力评估
Barthel指数(Barthel index,BI)可对患者日常生活能力进行评定,总分范围在0~100分,在临床上被广泛使用[42-43]。BI评定为中度依赖(41~60分)和重度依赖(<40分)的患者需要长期卧床,依赖他人照顾,发生RTIs的风险增加[44]。
2.4 一般临床观察
卒中患者出现发热、呼吸音异常、咳痰,或者实验室检查提示白细胞水平升高或降低、CRP增加,或有明确的痰培养阳性,结合影像学检查结果可作为RTIs的诊断标准[45]。除了关注SAP相关的临床诊断,还要注意上呼吸道和支气管感染症状,尤其是对于张口呼吸的患者[4]。张口呼吸可导致口腔、咽喉和呼吸道干燥,增加口腔内细菌定植的机会,导致气道分泌物增多,增加呼吸道感染风险[46]。
推荐意见:
在卒中患者中,建议使用改良容积-黏度测试等床旁吞咽评估工具作为患者进食前的吞咽筛查手段。需权衡卒中患者的卒中严重程度和活动能力评估结果,结合临床实际情况,对于高危RTIs人群重点关注,定期复查随访。
3 预防呼吸系统感染的管理
患者入院后应尽早启动RTIs预防以减少风险,其中体位改变、口腔气道护理、吞咽与营养管理、康复训练等方法均有助于减少RTIs。
3.1 一般护理
卒中后患者的一般护理需关注患者的体位摆放、体温监测、口腔清洁等方面(表2)[47-50]。
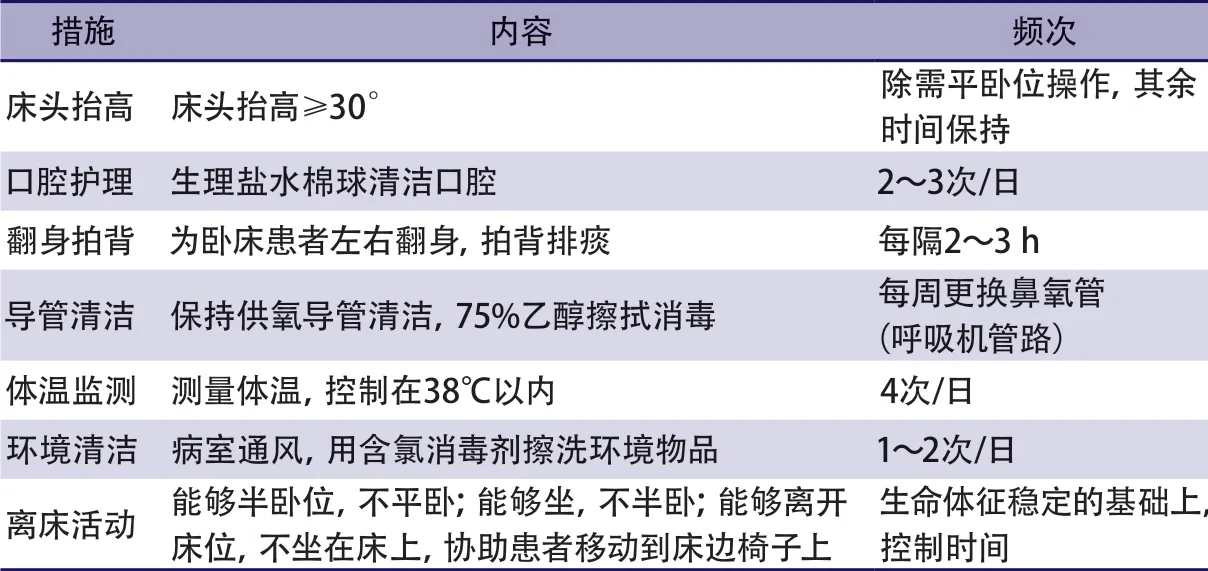
表2 预防呼吸系统感染一般护理措施
3.2 吞咽与营养管理
结合患者吞咽障碍评估的结果,选择安全进食途径。研究报道,管饲相关并发症发生率为9.4%,死亡率为0.53%,同时管饲并没有减少卒中后患者的误吸风险[51-52]。因此,应首先考虑改变食物性状和黏稠度,帮助吞咽障碍患者安全进食[53-54]。对于不能经口进食的患者,管饲喂养保证给予足够热量的肠内营养支持。
3.3 康复训练
早期肢体的康复训练能帮助卒中患者尽早站立,扩大活动范围,避免长期卧床。关于康复时间,卒中发病24 h内早期干预的安全性和有效性(Efficacy and Safety of Very Early Mobilisation within 24 h of Stroke Onset,AVERT)研究的结果显示,虽然极早期康复训练(24 h内)未有获益,但在卒中病情稳定48 h后即可进行早期、规范化康复护理[55-56]。除此以外,电刺激、口肌训练等物理刺激康复锻炼能显著改善卒中患者的吞咽障碍,可用于早期吞咽功能治疗,帮助预防RTIs[57-59]。若患者能配合,也可通过吸气和吐气康复训练增加体内气体交换,提升肺功能,帮助痰液排出[60]。
3.4 气道湿化
气道湿化有助于重症卒中患者排痰,减少肺部并发症。对高危RTIs患者行常规雾化吸入,能降低痰液黏稠度,使口腔黏膜湿化,也便于医护人员进行口腔护理和吸痰操作[61]。
3.5 排痰训练
临床最常规的排痰方法是翻身拍背法。另外,餐前进行体位引流,胸部叩击与震颤,也有助于痰液的被动排出。若患者能配合,也应对卒中患者进行主动咳嗽训练法培训,以促进主动排痰[62]。
推荐意见:
应尽早对高危RTIs患者进行各项风险的干预(图1)。尤其针对吞咽障碍、排痰困难及意识障碍的患者,应尽早采取改变体位、管饲、被动或者主动排痰、雾化祛痰等干预方法,结合康复训练,减少RTIs的风险。
4 卒中后气道管理的措施
4.1 非人工气道的管理
对于无人工气道的卒中患者,咳嗽减弱及排痰障碍会增加RTIs的风险。因此,需要关注吸痰操作的护理细节。吸痰前,应给予患者高流量吸氧1~2 min。吸引前,患者应取去枕卧位,肩下垫一软枕,头稍后仰。其他注意事项见表3[61,63]。
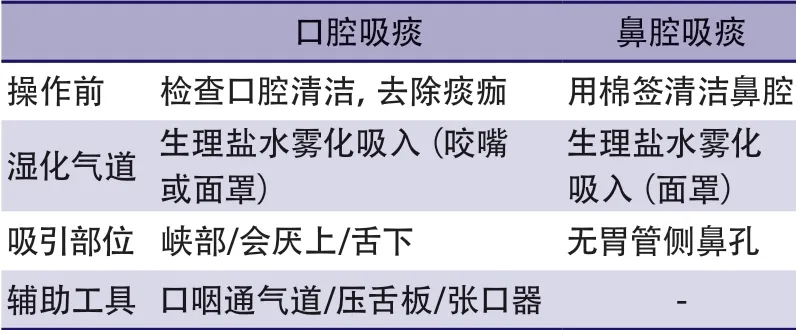
表3 口鼻腔吸痰注意事项
推荐意见:
尽可能积极地实施非人工气道管理,预防RTIs发生。口腔吸痰为首选吸痰方式。建议使用雾化吸入的方式湿化气道,帮助分泌物排出。
4.2 人工气道的管理
卒中患者肺部感染后易发生气道阻塞、低氧血症及高碳酸血症,如果不及时纠正,可导致组织细胞能量缺乏,造成多器官功能衰竭[64]。其中,呼吸衰竭和心力衰竭是卒中后RTIs的严重并发症,增加了卒中患者的死亡率。必要时可采用机械通气改善组织低灌注和低血容量状态[65]。气道湿化、气道分泌物吸引及气囊管理是人工气道管理中的重点。
4.2.1 气道湿化
合并RTIs的卒中患者往往气道内分泌物较多,且部分患者可能存在痰液黏稠,容易在人工管道上附着,导致人工气道堵塞不畅。气道湿化是人工气道护理中的重要环节,充分的湿化有利于维持呼吸道的生理功能,稀释痰液,使痰液易于排出体外[66-67]。因此,所有机械通气的患者都需接受主动湿化,湿化器使用的具体注意事项见表4。

表4 湿化器使用注意事项
4.2.2 气道分泌物吸引
气道分泌物吸引的操作应严格执行护理常规,保证无菌操作,具体注意事项见表5[68-69]。
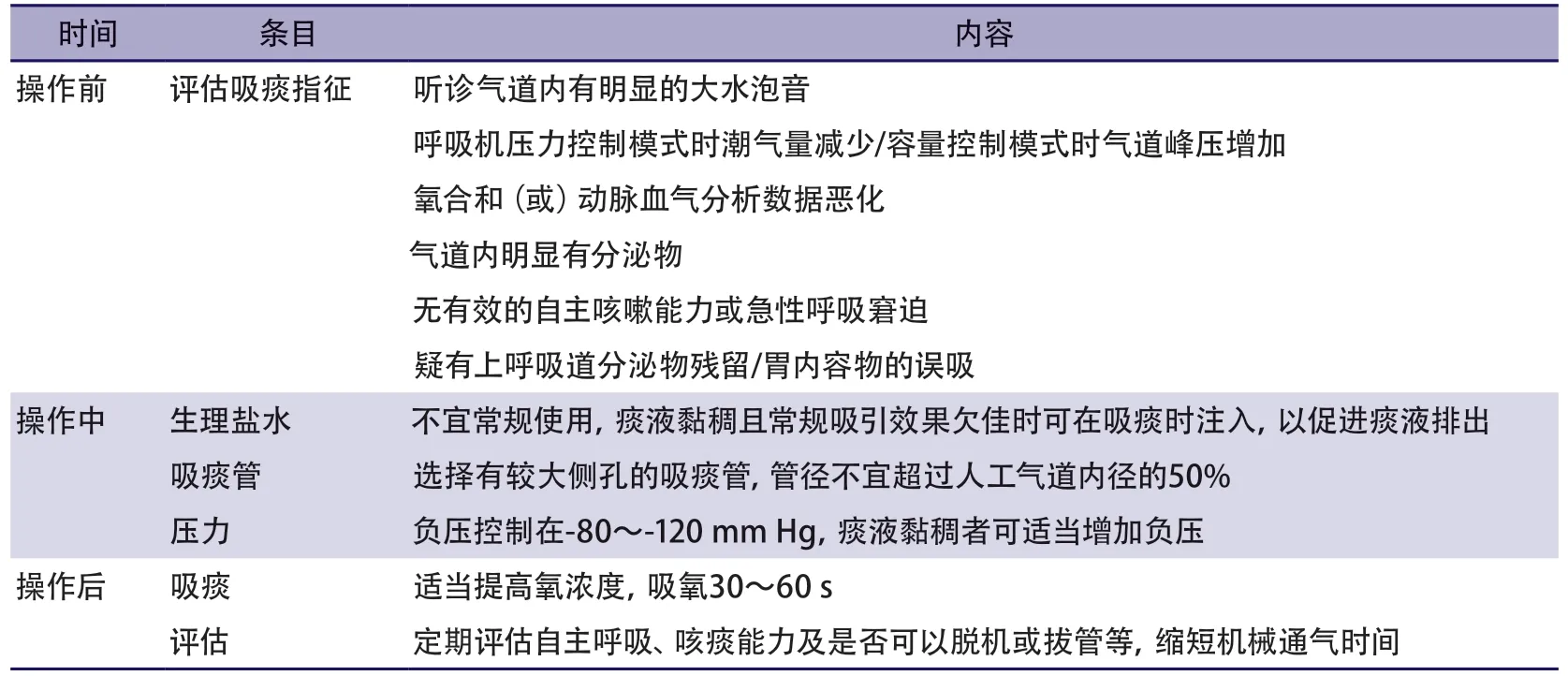
表5 气道分泌物吸引注意事项
4.2.3 气囊管理
气囊的作用是保持声门以下的气道封闭,从而保障正压通气的有效完成。气囊压力控制应在25~30 cm H2O,不推荐根据经验判定的指触法给予气囊充气,可采用自动充气泵维持气囊压,每隔6~8 h重新测量气囊压力[70]。选择合适型号的人工气道,建立后需仔细判断气囊所在位置。当气囊压足够仍存在漏气现象时,应考虑改变人工气道位置或更换其他型号的人工气道。为预防VAP发生,应定期清除气囊上滞留物,可采用带声门下吸引的人工气道,间断吸引。
推荐意见:
人工气道必须采用合适的湿化。推荐使用密闭式气管内吸痰装置,以避免交叉感染和低氧血症的发生,并降低细菌定植率。监测气囊压力,及时清除气囊和声门下分泌物。
4.3 雾化祛痰
雾化已被证实可用于多种肺部疾病的治疗,如肺炎、哮喘、囊性纤维化、肺损伤和呼吸困难等[71]。喷射式雾化器是临床最常用的雾化装置。
4.3.1 常用雾化祛痰药物
目前国内临床对卒中患者常用的雾化祛痰药物包括乙酰半胱氨酸溶液、氨溴索溶液等(表6)。

表6 常用雾化祛痰药物
4.3.2 雾化操作注意事项
气道雾化的时机通常为餐前或用餐30 min后,鼻饲患者需暂停喂养,防止气雾刺激引发呕吐。意识清醒的患者采取半卧位或坐位,认知障碍或咳嗽能力弱的患者床头抬高30°。单次雾化时间控制在15~20 min以内,时间过长可能会导致患者缺氧、分泌物过度液化,通气不足,肺膨胀致使气道阻塞加重。雾化液量不宜过满(≤10 mL),雾化器过满将无法使雾化液形成气雾,降低雾化效能。非机械通气患者呼吸道内异物或分泌物过多时,应指导患者咳出,必要时进行口腔吸痰。机械通气患者呼吸机模式更换为辅助-控制通气模式,并适当上调预设的呼吸频率,保证有效通气量,雾化结束后恢复原参数模式;使用喷射雾化器需下调呼吸机压力;氧气驱动雾化需下调呼吸机吸氧浓度;呼吸机吸气端连接过滤器,关闭流量监测、取下流量传感器,避免损坏呼吸机内部精密部件;气管切开患者脱机后需要使用T管连接雾化器[72]。
推荐意见:
推荐对非人工气道和建立人工气道的卒中患者常规使用雾化祛痰,预防和治疗RTIs发生。
5 总结
本专家撰写小组依据目前的临床研究结果,结合专家建议,制定了本指导意见。卒中后呼吸系统感染气道管理应发挥多学科合作的优势,将各类措施综合应用于临床实践,强化相关学科医护人员对气道管理理念的认知,预防感染。
专家委员会名单(按姓名拼音排序):
陈会生 中国人民解放军北部战区总医院
董 强 复旦大学附属华山医院
郭 力 河北医科大学第二医院
柯开富 南通大学附属医院
刘丽萍 首都医科大学附属北京天坛医院
陆正齐 中山大学附属第三医院
罗本燕 浙江大学医学院附属第一医院
秦新月 重庆医科大学附属第一医院
宋元林 复旦大学附属中山医院
王翠兰 山东大学齐鲁医院
王 柠 福建医科大学附属第一医院
吴 波 四川大学华西医院
肖 波 中南大学湘雅医院
许予明 郑州大学第一附属医院
袁 军 内蒙古自治区人民医院
赵玉武 上海市第六人民医院
朱晓萍 上海市第十人民医院
