支架辅助弹簧圈栓塞治疗前交通动脉宽颈动脉瘤
2021-07-03陈柏宇曹毅鲍娟杨勇涛景睿李云飞胡佳怡赵青
陈柏宇,曹毅,鲍娟,杨勇涛,景睿,李云飞,胡佳怡,赵青
前交通动脉瘤(anterior communicating artery aneurysm,ACoAA)约占颅内动脉瘤的35%[1],为临床最常见的颅内动脉瘤。ACoAA位于前交通动脉复合体,前交通动脉复合体有许多穿支动脉,前交通动脉穿支动脉损伤可引起偏瘫、人格改变、智力变化等“前交通动脉综合征”。研究表明,ACoAA开颅夹闭术后可能由于穿支血管损伤而导致患者出现人格改变、健忘等术后并发症[2-3],采用介入微弹簧圈栓塞的ACoAA患者较少发生上述并发症[4]。但宽颈动脉瘤常难以采用单纯的弹簧圈栓塞治疗,大多数宽颈ACoAA的介入治疗需采用辅助技术来实现,支架辅助弹簧圈栓塞是目前最常用的方法。本文旨在探讨采用适宜的支架辅助栓塞技术治疗宽颈ACoAA的有效性和安全性。
1 对象与方法
1.1 研究对象 该回顾性研究收集昆明医科大学第二附属医院脑血管病科2016年7月1日-2020年7月31日连续入院行血管内治疗的破裂或未破裂ACoAA患者,纳入其中采用支架辅助栓塞的宽颈ACoAA患者。其中未破裂动脉瘤患者为头昏、头痛或其他脑血管病相关症状为主诉到院检查,经头颈动脉CTA或MRA筛查发现ACoAA。所有患者均行DSA检查明确诊断。
纳入标准:①年龄18~80岁;②经DSA检查,确诊为宽颈ACoAA(瘤颈>4 mm或瘤体瘤颈比<2[5]),并进行了支架辅助栓塞治疗;③无血管内治疗禁忌,患者及家属签署知情同意。
排除标准:①术前评估患者Hunt-Hess评分5级;②前交通动脉瘤合并颅内肿瘤、动静脉畸形、动静脉瘘等;③颅内多发动脉瘤;④采取了开颅夹闭术治疗的ACoAA;⑤既往有严重高血压脑出血、脑外伤、大面积脑梗死或反复卒中病史,严重心、肺、肾等重要器官功能不全,或术前即有明显残疾,影响预后评估;⑥有使用抗血小板及抗凝药物禁忌。
1.2 研究方法
1.2.1 一般资料收集 收集患者的基线资料,包括年龄、性别、既往史(高血压、糖尿病、冠心病、脑梗死)、Hunt-Hess评分等。
1.2.2 头颅影像学检查 所有患者入院后均完成头颅CT检查明确是否有蛛网膜下腔出血;入院后经CTA或MRA检查初步明确ACoAA诊断,最后经DSA确诊。
1.2.3 手术方法及围手术期处理 全脑DSA明确诊断后,所有患者均在全身麻醉下行血管内介入治疗。股动脉穿刺置6F动脉鞘,常规肝素化。所有宽颈ACoAA均行支架辅助栓塞。选取工作角度并测量动脉瘤瘤体大小、瘤颈及载瘤动脉远、近端管径,根据动脉瘤的形态特征、载瘤动脉管径、动脉瘤与载瘤动脉关系等选择适宜支架。微导丝导引下先将支架微导管送入载瘤动脉远端,再用微导管输送弹簧圈至动脉瘤腔内,经支架导管输送支架至拟释放位置,根据需要采用先释放或半释放技术释放支架,同时弹簧圈栓塞动脉瘤。支架打开时均给予替罗非班注射液负荷剂量(10 μg/kg)静脉推注(3 min内静脉团注),随后持续泵入维持量0.15 μg/(kg·min)12~24 h(据术中是否有血栓事件及造影剂滞留),停替罗非班前4 h叠加口服氯吡格雷(75 mg/d)、阿司匹林(100 mg/d),维持口服双抗3个月,然后改为单用阿司匹林(100 mg/d)长期口服。术后患者重症监护室密切观察生命体征、神经系统体征,动态复查头颅CT。未破裂的宽颈ACoAA拟行支架辅助栓塞者术前服用氯吡格雷(75 mg/d)和阿司匹林(100 mg/d)双联抗血小板治疗3~5 d。
有4例患者因动脉瘤破裂出血至脑室铸型同时行侧脑室穿刺外引流术。
1.2.4 疗效及安全性评估 术后即刻行DSA,根据Raymond分级评价动脉瘤即刻栓塞程度(Ⅰ级:完全栓塞;Ⅱ级:近全栓塞,瘤颈残留;Ⅲ级:部分栓塞,瘤体部分残留),作为技术评价指标。治疗安全性评价指标是评估术中、术后1个月内并发症,包括动脉瘤再出血、缺血性卒中等。疗效评价指标包括术后6个月复查DSA观察动脉瘤栓塞情况,及应用mRS评分评估患者临床预后,mRS 0~2分为预后良好。
1.3 统计学方法 应用SPSS 22.0统计学软件对资料进行描述性统计分析。对于计量资料,如果符合正态分布采用表示,非正态分布的计量资料采用M(P25~P75)表示。计数资料采用例数(%)表示。
2 结果
2.1 一般资料 经血管内治疗的ACoAA患者共80例,其中采用支架辅助栓塞的宽颈ACoAA患者共32例,包括破裂动脉瘤22例,未破裂动脉瘤10例。除2例患者死亡,余30例均完成随访,无随访脱落患者。32例患者基线特征包括:男性19例(59.38%),年龄23~80岁,平均55.7±11.2岁;既往有高血压病史21例(65.63%),糖尿病史6例(18.75%),冠心病史3例(9.38%),脑梗死病史(非致残性轻型卒中)10例(31.25%);入院时22例破裂动脉瘤患者Hunt-Hess分级1级3例(9.38%),2级9例(28.13%),3级5例(15.62%),4级5例(15.62%),其中病情较重(Hunt-Hess分级3~4级)者占45.45%(10/22)。
32例患者有一侧大脑前动脉A1优势征者28例(87.50%)。32个动脉瘤最长径2.90~12.00 mm,中位值为4.98(3.00~8.13)mm。32例患者拟释放支架的大脑前动脉-前交通动脉血管管径1.60~2.60 mm,平均2.28±0.27 mm。
2.2 术中使用支架情况 32例患者术中共使用支架33枚(其中1例采用T型支架)。使用支架类型如下:LVIS支架15枚(45.45%),LVIS Jr.支架4枚(12.12%),LEO baby支架6枚(18.18%),Enterprise支架4枚(12.12%),Enterprise Ⅱ支架3枚(9.38%)和Solitaire支架1枚(12.12%)。经典病例见图1~图3。
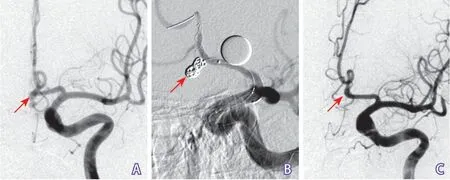
图1 LVIS支架辅助栓塞破裂前交通动脉瘤
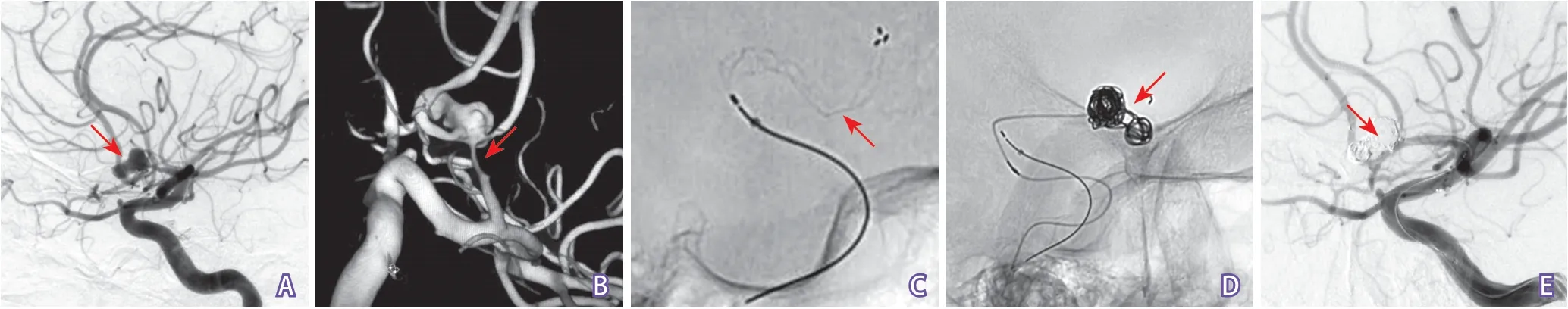
图2 Solitaire支架辅助栓塞破裂前交通动脉瘤
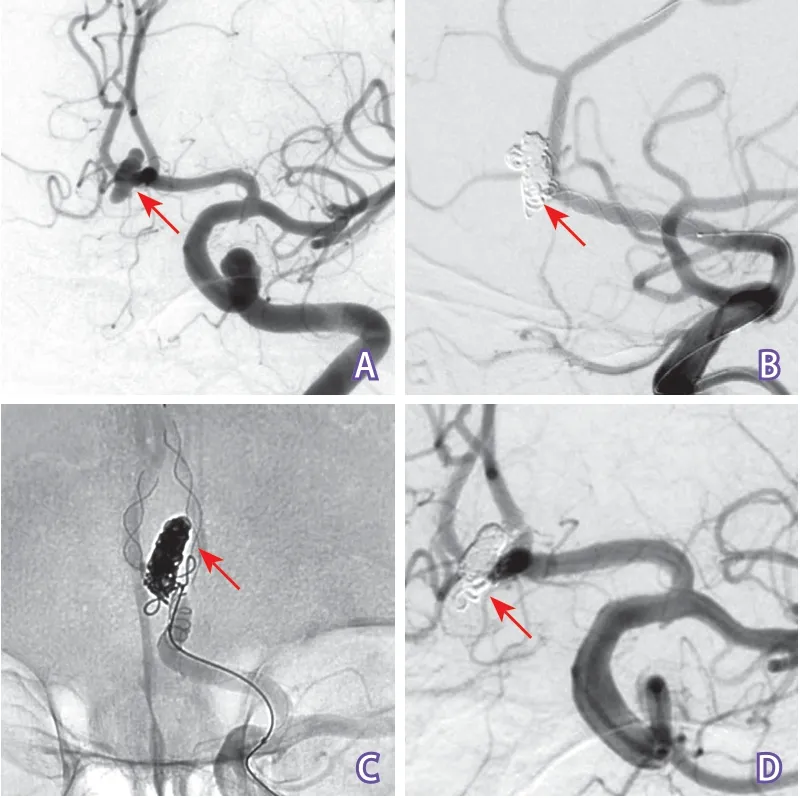
图3 LEO baby T型支架辅助栓塞破裂前交通动脉瘤
2.3 术后即刻栓塞效果及围手术期并发症 32例患者术后即刻栓塞程度Raymond Ⅰ级28例(87.50%),Raymond Ⅱ级4例(12.50%),22例破裂动脉瘤均为Raymond Ⅰ级栓塞。其中术后24 h内动脉瘤再出血死亡1例(3.13%);术中支架内血栓形成3例(9.38%),予微导管内推注替罗非班、静脉维持泵入替罗非班等处理后血管血流恢复通畅,但有1例术后并发大面积脑梗死死亡(该患者为HIV感染的蛛网膜下腔出血患者,Hunt-Hess分级3级,动脉瘤栓塞术前造影见双侧大脑中动脉闭塞,由双侧大脑前动脉代偿大脑中动脉供血区供血),另2例术后出现顶叶分水岭区多发小点片状梗死,遗留轻微神经功能缺损症状。1例术后约1周时出现交通性脑积水在术后1个月行脑室-腹腔分流术。其他并发症包括电解质紊乱1例(3.12%),精神症状(3.12%),尿崩症1例(3.12%),均在术后1周内出现,至出院时基本痊愈。
2.4 预后随访 除2例(6.25%)患者死亡(1例因术后动脉瘤再次出血,1例因术中支架内血栓形成),余30例术后6个月均复查了DSA,动脉瘤均无复发。预后良好(mRS 0~2分)26例(81.30%),mRS 3~4分4例(12.50%)。
3 讨论
前交通动脉瘤是临床最常见的颅内动脉瘤之一,破裂发生率高[6]。90%的ACoAA是位于前交通复合体的囊状动脉瘤[7]。前交通复合体包括前交通动脉和相连的两侧大脑前动脉A1段及其各穿支动脉,大脑前动脉A1段是最常有发育变异的组成部分,前交通动脉动脉瘤的发生、发展与大脑前动脉A1段的解剖变异有密切关联。一侧大脑前动脉A1段发育不良、缺如等血管变异(一侧A1优势),常与ACoAA的发生相关[8]。本组患者一侧A1优势者占87.50%(28/32)。
开颅夹闭和血管内治疗均为ACoAA的常见治疗方式。Moon等[9]的进行的一项大规模前瞻性、随机对照临床试验表明,对于破裂的ACoAA,选择血管内治疗和手术夹闭都是安全和有效的。相关解剖学研究[10]发现前交通动脉的穿支血管有2~6支,包括胼胝体下动脉、下丘脑支、视交叉支、胼胝体下支等;而DSA仅能显示回返动脉、眶额动脉等较大的分支,一些细小穿支常不显影,但这些穿支损伤可引起严重的临床症状。基于前交通动脉复合体解剖的特殊性,开颅夹闭术损伤细小穿支动脉的可能性较血管内治疗更大,而采用微弹簧圈栓塞的ACoAA患者较少发生由于穿支血管损伤所致的并发症[4]。随着神经介入技术的发展,介入材料不断创新,大多数ACoAA都可以用血管内治疗的方法治愈。Brzegowy等[11]的研究表明,血管内治疗是ACoAA安全有效的治疗方法。
但宽颈动脉瘤由于微弹簧圈在动脉瘤内不能稳定而突入载瘤动脉从而影响载瘤动脉血流,无法采取单纯弹簧圈填塞。Beretta等[12]认为,对于宽颈动脉瘤,单纯弹簧圈填塞完全闭塞成功率仅为30%~40%,而微弹簧圈填塞密度与动脉瘤的复发率存在显著相关性,填塞密度越高,动脉瘤复发的可能性越小[13]。因此目前大多数宽颈ACoAA需采用血管内辅助技术来实现完全栓塞。Geyik等[14]对500例支架辅助栓塞动脉瘤的病例进行随访,证明支架辅助栓塞动脉瘤是首选方法之一。Feng等[15]研究亦证实支架辅助微弹簧圈栓塞安全可行。ACoAA的患者大部分存在大脑前动脉一侧A1优势,即一侧大脑前动脉A1发育不良甚至缺如,由另一侧A1段通过前交通动脉供应双侧A2段,因此,在治疗前交通动脉宽颈动脉瘤时如何通过支架对前交通动脉及双侧大脑前动脉A2段进行保护、支架是否会影响到前交通动脉复合体的穿支血管供血等是目前血管内治疗宽颈ACoAA的难点热点。
本研究32例宽颈ACoAA均采用支架辅助栓塞。因前交通动脉与大脑前动脉夹角较大,大脑前动脉A1-A2的夹角亦常<100度[16],倾向于使用顺应性和贴壁性良好的编织支架,可以更好在血管转角处释放,并对血管内皮细胞提供物理支撑[17]。本研究中术中选择的支架主要为LVIS支架,其顺应性好,同时也具有一定的血管腔内径向支撑力。LVIS和LEO支架具有相对较高的金属覆盖率(23%),有一定的血流导向作用。Ge等[18]认为LVIS可以有效防止动脉瘤复发。但考虑到前交通复合体穿支众多,应警惕LVIS的金属覆盖率高可能会增加穿支闭塞的可能[19]。LVIS、LEO支架适用于2.0~4.5 mm管径的血管,LVIS Jr或LEO baby则适用于更小的血管管径(1.5~2.0 mm)。有研究表明,根据前交通动脉的管径特点,使用LVIS Jr支架辅助栓塞可以有效治疗复杂的宽颈动脉瘤[20]。Solitaire支架网眼支架较大,微导丝、微导管易穿过支架网眼。若载瘤动脉血管管径纤细,同时进入释放支架及输送栓塞动脉瘤用弹簧圈的双管道困难,或动脉瘤颈累及双侧大脑前动脉A2段,需使用Y型支架辅助栓塞时,可考虑使用Solitaire支架辅助栓塞。Enterprise Ⅱ是新一代雕刻支架,与原Enterprise比较,除良好的支撑性外,还具有更好的顺应性和贴壁性,且在1.5 mm及以上管径的血管中即可打开,也为宽颈ACoAA的支架辅助栓塞治疗提供了更多的选择。
本组32例患者即刻栓塞率Raymond Ⅰ级达87.50%(28/32),6个月后随访均无复发。总体死亡率6.25%(2/32),预后良好者占81.30%(26/32),预后较差(mRS 3~4分)者占12.50%(4/32),但在本研究入组的22例破裂动脉瘤中Hunt-Hess 3~4级者占45.45%(10/22),即重症患者比例较高,有4例起病时即有脑室铸型,同时行侧脑室穿刺外引流术,大部分患者取得了良好结局。2例死亡患者,1例为HIV感染颅内多发血管病变患者,术后并发大面积脑梗死。此类特殊感染或血管炎等自身免疫性疾病患者,因广泛的血管病变、血管壁炎性损伤等,更易形成支架内血栓,应慎用支架辅助动脉瘤栓塞;另外1例患者术后发生再次破裂出血后导致死亡。对于已发生破裂的动脉瘤应致密栓塞,尤其注意子囊、假性动脉瘤等危险结构,因支架辅助栓塞的患者术中术后需采取持续的抗凝治疗,如未致密栓塞,在抗凝治疗下,上述危险结构易发生再次破裂出血。Zhang等[21]研究表明,动脉瘤支架辅助栓塞组较单纯弹簧圈栓塞组术中术后的缺血并发症发生率高。本研究患者术中支架内血栓形成3例,除死亡的HIV感染患者外,另2例随访均未导致严重神经功能缺损症状。支架的充分打开和良好贴壁是避免支架内血栓形成的关键,因此应避免术中长时间或反复操作引起血管痉挛或内膜受损从而诱发血栓形成[22]。对于支架辅助栓塞的患者,术中术后需采用持续的抗凝治疗,围手术期采用个体化、充分的抗凝方案是预防缺血并发症的关键;如术中发现有支架内血栓形成或远端缺血时,应及时处理,如微导管内推注尿激酶或替罗非班等措施,可明显改善患者预后。前交通复合体的穿通支管径细小,在造影过程常不显影,如在术中损伤,可能导致下丘脑前部、胼胝体下区、前联合、终板中央区等脑区缺血而出现意识障碍、视力下降、严重电解质紊乱、尿崩等并发症,在本组患者中,此类并发症发生率不高,且症状较轻。有研究表明,血管内治疗的ACoAA患者穿支血管损伤的并发症仍少于开颅夹闭[4]。但在以下情况应选择开颅夹闭[23]:①患者脑血管痉挛较重或载瘤动脉过于纤细,支架辅助栓塞困难;②巨大动脉瘤栓塞后有占位效应的;③动脉瘤破裂合并脑内较大颅内血肿形成者等。
总之,根据ACoAA及载瘤动脉的特点,采用个体化的支架辅助栓塞策略和手术技巧治疗宽颈ACoAA,及时处理手术相关并发症,能明显改善患者预后,当前研究已证明支架辅助栓塞治疗宽颈ACoAA是安全有效的。尤其对于Hunt-Hess分级高,全身状况差及高龄等难以耐受开颅夹闭的重症患者,具有明显优势。本研究例数较少,仅为单中心经验,未与其他治疗方法做随机对照研究,但仍可为ACoAA的血管内治疗提供一定的临床参考。
【点睛】前交通动脉复合体解剖较为复杂。采用个体化的支架辅助弹簧圈栓塞技术治疗前交通动脉宽颈动脉瘤能使患者获得良好预后,有较好的安全性和有效性。
