ATAD3基因簇缺失通过调节线粒体DNA和胆固醇代谢对小鼠小脑功能障碍的影响*
2021-07-02林正英杨光伟白娇黄建
林正英, 杨光伟, 白娇, 黄建
(1.自贡市中医医院 检验科, 四川 自贡 643000; 2.都江堰市妇幼保健院 检验科, 四川 都江堰 611830; 3.自贡市中医医院檀木林分院 针灸一科, 四川 自贡 643000)
mtDNA突变和核编码因子的突变会导致广泛的人类疾病,其中大多数会影响中枢神经系统[1]。mtDNA最初被认为在不受包装蛋白质束缚的情况下自由漂浮在线粒体基质中,现在已经确定mtDNA与线粒体内膜有关[2],其功能障碍可能会导致核苷酸结构和组成的改变,从而可能反过来影响mtDNA的分离和膜结构,从而诱发线粒体疾病[3]。胆固醇动态平衡紊乱可导致mtDNA异常[4],参与调控该作用的因子包括ATAD3、ATPase家族以及AAA+结构域[5]。大多数物种只有1个ATAD3基因,而人类则有一个紧密排列的ATAD3C、ATAD3B和ATAD3A 3个基因簇,它们紧密靠近1p号染色体的端粒[6],ATAD3A突变能够导致线粒体异常表型[7-9],其机制尚不明确。本研究旨在探究ATAD3基因簇缺失导致与mtDNA和胆固醇代谢相关的小脑功能障碍的关系,以为临床诊治提供理论依据。
1 材料与方法
1.1 实验动物和分组
8~12周雄性C57BL/6(n=48)小鼠购自南方医科大学实验动物管理中心[生产许可证号SCXK(粤)2016-0041],将其随机分为对照组(正常雄性C57BL/6小鼠,n=24)和Atad3缺失组(Atad3 -/-纯合缺失C57BL/6小鼠,n=24),饲养在室温下、以12 h明/暗交替周期的无病毒-抗原设施中,可随意获得食物和水。
1.2 方法
从敲除小鼠项目库中获得了胚胎干(ES)细胞克隆,其中内源Atad3已通过同源重组(http://www.komp.org)进行修饰。将含有Atad3陷阱基因的ES细胞系(克隆CDS37385,来自JM8.N4细胞,背景6N)注入C57BL/6J衍生的胚泡中,获得的胚胎植入假孕的寄养母亲体内。为了检测嵌合体,本研究扩增了烟酰胺核苷酸转氢酶(Nnt)基因座,该基因座在6N背景下为纯合野生型(ES细胞),而在6J背景下为纯合突变体(胚泡)。用于扩增Nnt基因的引物如下:NntA-COMMON为5′-GTAGGGCCAACTGTTTCTGCATGA-3′,NntD-WT为5′-GGGGATAGGAAGCAAATACCAAGTTG-3′,NntC-MUT为5′-GTGGAATTCCGCTGAGAGAACTCTT -3′。使杂合的Atad3 +/-小鼠与普遍表达翻转酶小鼠(Rosa26_FLP,Jackson Laboratory,012930)交配,以切除新霉素选择标记。与杂合小鼠Atad3 +/-自交产生的纯合后代Atad3 -/-小鼠用于表型研究的所需基因型,随后将小鼠与C57BL6J一起繁殖了7代以上,取第子代小鼠的成纤维细胞进行实验。
1.3 观察指标
1.3.1采用RT-qPCR检测ATAD3 mRNA表达水平 用异氟烷麻醉实验小鼠,断头处死,取小脑,-80 ℃储存,组织匀浆,分离RNA,定量RNA浓度和纯度;用DNase I(Promega公司,美国)在37 ℃下处理等量的RNA(1 μg)30 min,在65 ℃灭活DNase 15 min。使用高容量cDNA存档工具包(Applied Biosystems公司,美国)对RNA进行反转录,Taqman qPCR使用JumpStart Taq Readymix(Sigma公司,美国)和ATAD3小鼠特异性Applied Biosystems引物,反应方案包括一个初始升温时间(2 min,50 ℃;10 min,95 ℃)和40个后续循环(15 s,95 ℃;1 min,60 ℃)。与标准曲线比较,计算出目标基因的相对浓度。
1.3.2蛋白质印迹法分析蛋白质表达水平 用异氟烷麻醉实验小鼠,断头处死。取小脑于-80 ℃储存、匀浆,测定总蛋白质浓度,并在540 nm处测量吸光度。将蛋白质在95 ℃的样品缓冲液(62.5 mmoL/L Tris-HCl,20%甘油,2%十二烷基硫酸钠,5%β-巯基乙醇,pH6.8)中变性,等量的蛋白质上样到预制的聚丙烯酰胺NuPage凝胶(Invitrogen公司,美国)中;蛋白质转移到硝酸纤维素膜上,用含5%牛奶的Tris缓冲盐水(TBS,pH7.6)和1%Tween(TBS-T)封闭膜,加入含5%IgG的牛血清白蛋白的一抗(BSA公司,美国)、4 ℃过夜,并在5%牛奶TBS-T中于室温下过氧化物酶偶联的二抗(BSA公司,美国),显影,计算条带的光密度。
1.3.3采用免疫荧光染色和共聚焦显微镜检查线粒体形态 活细胞用MitoTracker Red(红色,线粒体)和PicoGreen(绿色,核和mtDNA)染色,将成纤维细胞以2×104接种在12 mm玻璃盖玻片上,用抗TOMM20(上海碧云天公司)和LAMP1(上海碧云天公司)的一抗以及Alexafluor偶联二抗(上海碧云天公司)进行孵育,在37 ℃下用PicoGreen 3 mL将细胞染色30~45 min,向介质中添加50 nmol/L MitoTracker Red染料(上海碧云天公司)或50 nmol/L MitoTracker Deep Red染料(上海碧云天公司)以可视化线粒体网络。来自固定样本和实时样本的图像均在由Metamorph软件操作的Olympus旋转盘共聚焦系统(Olympus公司,日本)上获取。通过共聚焦显微镜观察成纤维细胞的线粒体形态。
1.3.4采用溶酶体聚集体图像分析溶酶体结构 通过免疫荧光染色和共聚焦显微镜检查成纤维细胞系中的溶酶体结构,抗TOMM20(红色,线粒体)和LAMP1(绿色,溶酶体)的抗体染色,对图像中正常和增大的溶酶体的细胞数进行评分,以定量分析溶酶体聚集体的存在。
1.3.5采用PureLink Genomic DNA Mini Kit分析mtDNA拷贝数 从小鼠成纤维细胞中提取总基因组DNA(gDNA)与核和mtDNA,使用QuantStudio 6 Flex实时PCR系统(Invitrogen公司,美国)通过实时定量PCR(qPCR)分析相对mtDNA拷贝数。
1.3.6采用HPLC-质谱法测定小鼠的肌肉脂质 取2月龄对照组小鼠和Atad3缺失组小鼠的肌肉组织,用正相HPLC分离甘油磷脂和鞘脂,HPLC条件为Agilent Zorbax Rx-Sil色谱柱(柱长100 mm,内径0.25 mm):流动相A(氯仿 ∶甲醇 ∶氢氧化铵=89.9 ∶10 ∶0.1,V/V)和流动相B(氯仿 ∶甲醇 ∶水 ∶氢氧化铵,55 ∶39.9 ∶5 ∶0.1,V/V),95%A持续2 min,在18 min内线性梯度达到30%A,并保持3 min。通过反相HPLC分离甾醇和甘油脂,不同的是使用Agilent Zorbax Eclipse XDB-C18色谱柱(4.6 μm ×100 μm)。
1.3.7旋转脚架下落的潜伏时间 采取rotarod试验进行行为学评分,用旋转脚架下落的潜伏时间评价小鼠运动的学习能力以及肢体的协调能力。各组小鼠在造模前均进行行为学训练,连续3 d,即在速度为4 r/min的转轮上匀速训练跑轮,入组标准为至少持续60 s。在术后第1、7、14、21及28天,各组小鼠分别使用3个旋转速度(8、16、24、32和40 r/min)进行rotarod试验,记录其行为学评分。使用旋转脚架设备测量运动协调和平衡,在每次试验中,活塞杆均在120 s内加速至最终速度,在最终速度下再保持30 s,最后在30 s内降至0 s,间隔时间为 2 min,记录每个试验的旋转脚架下落的潜伏时间,即小鼠从开始至跌落的时间,重复3次,计算其平均值。整个过程由对实验分组毫不知情的实验人员操作。
1.4 统计学分析
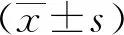
2 结果
2.1 ATAD3 mRNA和蛋白质表达水平
与对照组比较,Atad3缺失组的ATAD3 mRNA和蛋白质表达水平降低,差异有统计学意义(P<0.05)。见图1、表1。

图1 Atad3缺失对ATAD3蛋白表达的影响

表1 两组ATAD3 mRNA和蛋白表达
2.2 线粒体形态
与对照组比较,Atad3缺失组纤维细胞中可视化的线粒体网络碎片化,线粒体断裂和部分断裂比例增加,线粒体中间和融合比例降低,差异有统计学意义(P<0.05)。见图2、表2。
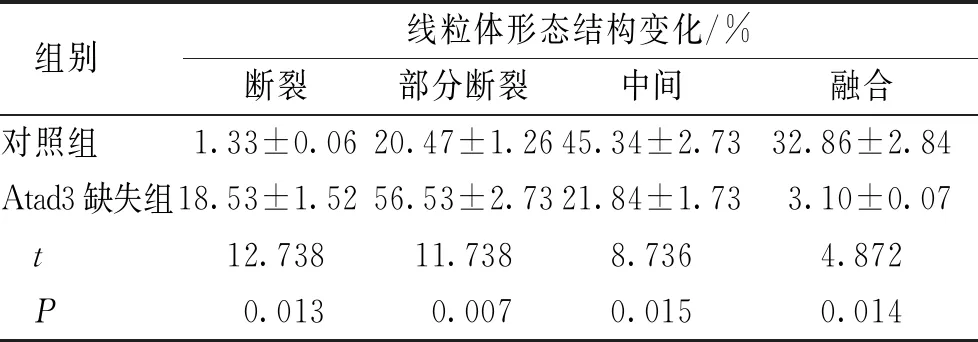
表2 两组细胞中的线粒体结构变化
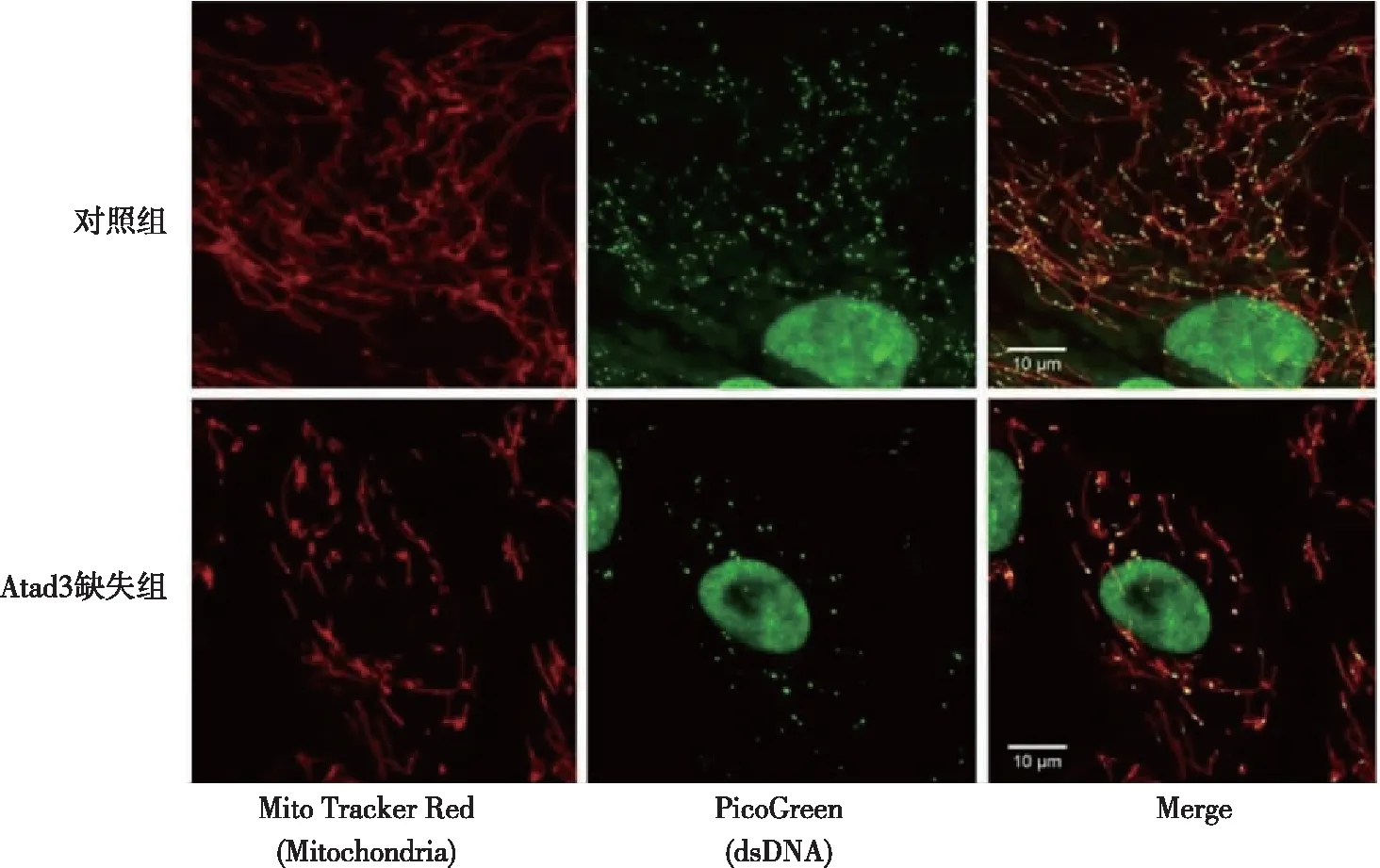
图2 两组成纤维细胞线粒体共聚焦显微镜检查
2.3 溶酶体结构
与对照组比较,Atad3缺失组溶酶体液泡增大,正常溶酶体比例降低,增大溶酶体比例升高(P<0.05)。见图3、表3。
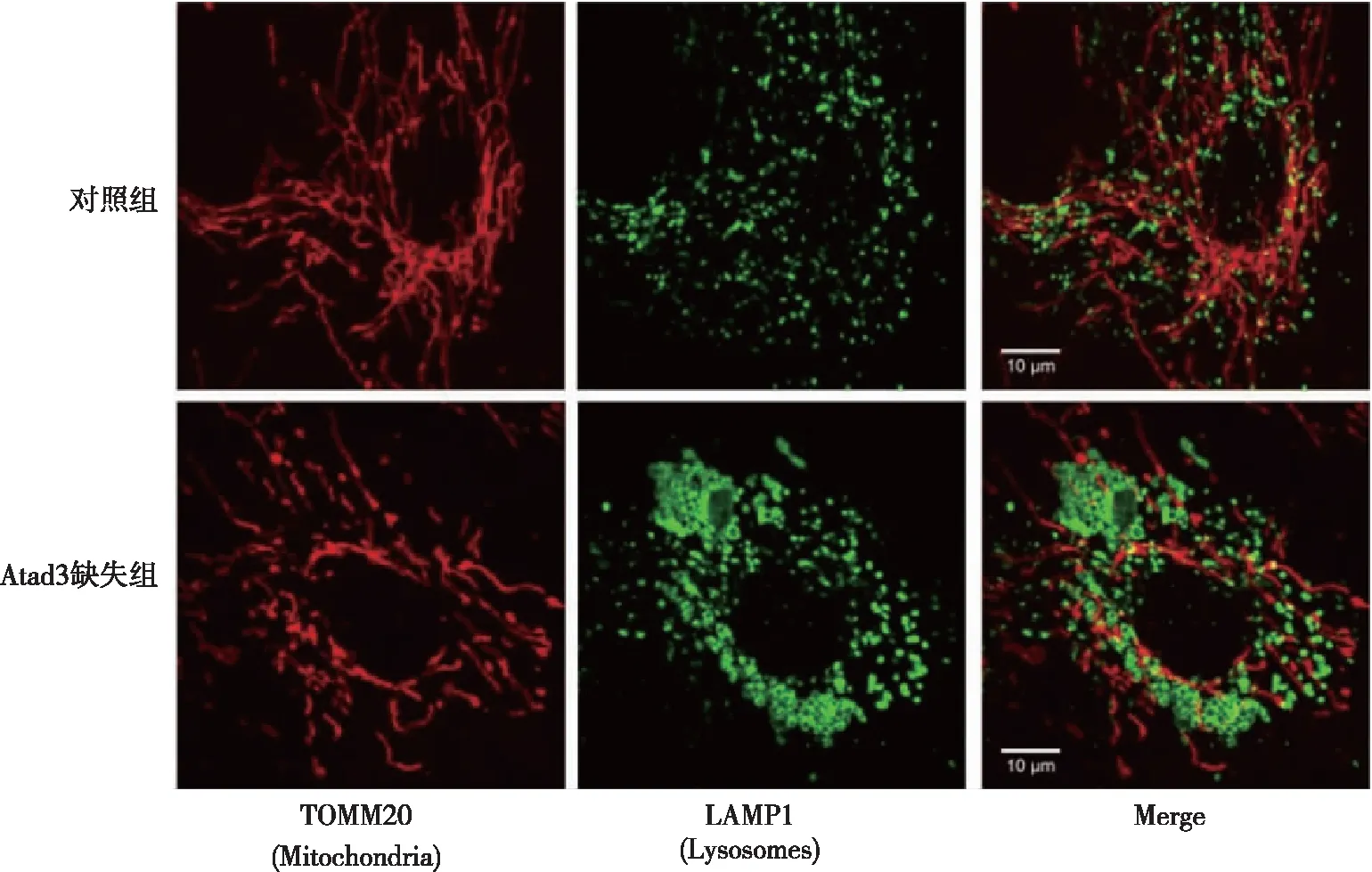
图3 两组成纤维细胞中溶酶体结构比较
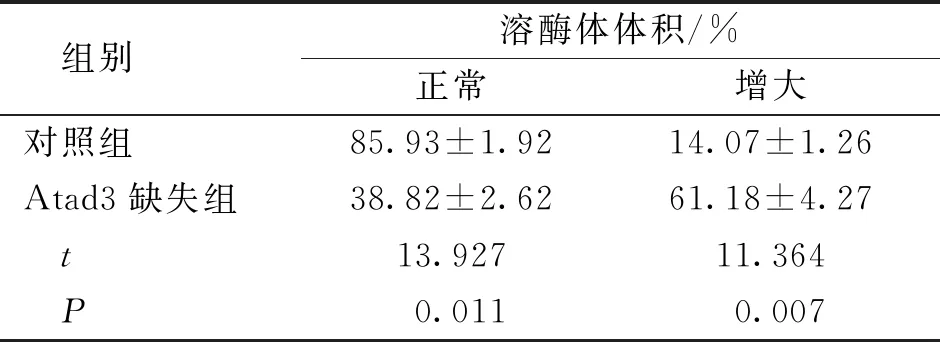
表3 两组成纤维细胞系中的溶酶体结构比较
2.4 mtDNA拷贝数
与对照组比较,Atad3缺失组mtDNA拷贝数和每个细胞的mtDNA核苷数降低,差异有统计学意义(P<0.05)。见表4。

表4 两组mtDNA拷贝数和每个细胞的mtDNA核苷数
2.5 小鼠肌肉组织胆固醇水平
在从2月龄鼠的肌肉中提取的样品中,没有发现对照组小鼠和Atad3缺失组小鼠的脂质组成的明显差异(图3A)。与对照组比较,5月龄Atad3缺失组小鼠肌肉组织有不同的胆固醇酯分布(图3B)。Atad3缺失组肌肉在,ER中合成的胆固醇酯水平降低(通常含有短的饱和或单不饱和酰基链),从饮食中获得的胆固醇酯水平升高(通常含有更长和更多的不饱和酰基链);总胆固醇酯/游离胆固醇的定量水平降低,差异有统计学意义(P<0.05)。见图4、表5。
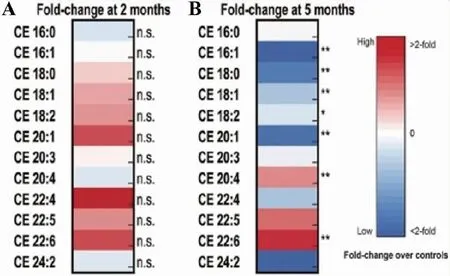
图4 总胆固醇相关的不同胆固醇酯肌肉组织脂肪分析

表5 肌肉组织总胆固醇/游离胆固醇比值
2.6 旋转脚架下落的潜伏时间
不同的旋转速度(8、16、24、32和40 r/min)下,Atad3缺失组小鼠旋转脚架下落潜伏时间低于对照组,差异有统计学意义(P<0.05)。见表6。

表6 两组小鼠旋转脚架下落的潜伏时间比较
3 讨论
本研究使用ATAD3基因敲除小鼠模型研究了线粒体内膜ATPase ATAD3的体内功能。ATAD3的缺失可导致线粒体超微结构受损,mtDNA复制停滞,总胆固醇酯/游离胆固醇的比率降低,以及小脑功能障碍。线粒体在类固醇生成中具有重要作用[10-11]。胆固醇产物的缺乏可诱发伴随ATAD3缺失的小脑功能异常。与致命的婴儿ATAD3B/ATAD3A基因融合缺陷相反,隐性和从头显性的ATAD3A错义突变与轻度形式的小脑功能障碍和更广泛的神经系统疾病和多系统疾病有关[12],即ATAD3A的错义突变会导致ATAD3的一部分功能丧失或引起功能异常,而不是因为ATAD3A位点的双等位基因缺失导致严重的蛋白质缺乏[13]。在ATAD3缺失动物中,mtDNA的减少伴随着mtDNA重排的形成,该重排在年长的动物中积累[14]。保留的mtDNA序列包括D环区域以及12S和16S核糖体RNA基因。这种缺失模式与在病理状态下发现的重排分子非常相似,例如成人发作性进行性眼外肌麻痹和MNGIE[15]。
本研究显示,ATAD3缺失导致纤维细胞中可视化的线粒体网络碎片化,线粒体断裂和部分断裂比例增加,线粒体中间和融合比例降低。线粒体是影响胆固醇代谢的关键细胞器,而ATAD3调节线粒体的胆固醇供应。由ATAD3缺乏引起的胆固醇生物合成的线粒体信号优先于细胞的其余部分,这表明将线粒体胆固醇水平保持在严格范围内非常重要[16]。胆固醇代谢紊乱对mtDNA的影响表明,将胆固醇插入线粒体内膜对于mtDNA复制和分离很重要[17]。线粒体内膜中的胆固醇含量低或分散,有望改变其刚性,从而阻碍mtDNA分离[18]。胆固醇和线粒体的完整性都与神经变性有关。本研究显示,在5周龄的动物中,与对照组比较,Atad3缺失组肌肉中总胆固醇酯/游离胆固醇的定量水平降低。胆固醇可能是与ATAD3缺陷相关的病理学的关键因素,该观点得到了与胆固醇相关的遗传性疾病中小脑功能障碍的支持[19]。小脑在调节高阶认知和行为功能中起着重要作用,小脑发育不全通常与Smith-Lemli-Opitz综合征有关,后者是胆固醇合成的隐性疾病,而小脑功能障碍是C型Niemann-Pick疾病的特征[20]。存在mtDNA异常C型Niemann-Pick疾病和ATAD3缺失障碍表明,这些可能是小脑病理的主要驱动因素。本研究显示,ATAD3缺失导致小脑功能障碍,线粒体内膜AAA蛋白ATAD3A的功能在胆固醇向线粒体的运输中发挥关键作用, AAA蛋白是通过形成六聚体环状结构发生作用,ATP酶的催化作用需要底物的配合,且异常线粒体过度分裂形态与溶酶体空洞有密切关联。
综上所述,ATAD3缺失主要破坏了线粒体结构,导致线粒体断裂,并增加了溶酶体液泡大小,导致胆固醇向线粒体的运输被下调,mtDNA复制停滞以及mtDNA的耗竭和缺失,最终导致小脑功能障碍。
