RBPJ-miR155-NF-κB-HIF-1α通路对大鼠脑缺血再灌注损伤的作用及分子机制*
2021-07-02何洋王黎洲李成安天志周石段庆红
何洋, 王黎洲, 李成, 安天志, 周石, 段庆红*
(贵州医科大学附属医院 介入科, 贵州 贵阳 550004)
在我国脑血管疾病的患者越来越多,已成为心脏病之后的第2大死因[1]。我国每年脑血管疾病新发患者约270万,约130万患者死于脑血管疾病[2]。卒中为常见的脑血管疾病,其中缺血性卒中所占比例高达85%[3],目前脑缺血再灌注损伤是引发缺血性脑卒中致残及致死的重要原因,患者后遗症往往比较严重[4-5],但其涉及的相关通路及干预靶点仍不十分明确。脑缺血再灌注损伤受多条信号通路的影响,目前相关报道主要为Toll样受体、核转录因子-κB(nuclear transcription factor-κB,NF-κB)、丝裂原活化蛋白激酶及Notch信号通路等[6],其中重组信号序列结合蛋白J(recombination signal sequence binding protein J,RBPJ)为Notch信号通路的关键蛋白,不仅与脑梗死的程度密切相关,同时与脑缺血再灌注后神经功能的修复密切相关,而脑缺血再灌注损伤患者血清中的微小核糖核酸(microRNA,miR)含量往往发生变化[7]。本课题组前期研究发现miR155可通过Notch信号通路调节一氧化氮(nitric oxide,NO)和内皮型NO合酶(endothelial nitric oxide synthase,eNOS)的表达[8];脑缺血再灌注后会导致炎症因子含量明显升高,引起炎症反应,进而引发一系列的并发症[9]。缺氧诱导因子-1(hypoxia inducible factor-1α,HIF-1α)是1992年首次发现的一种能与促红细胞生成素基因相结合的核转录因子[10]。有报道发现脑缺血再灌注时,HIF-1α含量会迅速升高,引起炎症反应[11];miR155通过影响HIF-1α促进血管损伤再生[8]。本研究拟通过建立大鼠脑缺血-再灌注模型,探讨RBPJ-miR155-NF-κB-HIF-1α通路效应分子之间的关联性,并通过基因过表达和沉默技术进一步验证通路效应分子相关作用位点及其与炎症因子的作用,进而为脑缺血再灌注损伤的治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性8周龄健康Wistar大鼠60只,体质量200~300 g,饲养于无菌、恒温及暗明交替的清洁级环境中,适应性饲养7 d,避免外界刺激,术前12 h禁食;新生24 h以内的雄性SD乳鼠10只,体质量6~8 g。实验动物均由学校动物实验中心提供,本研究获得学校动物伦理委员会批准(1800823)。
1.1.2主要试剂和仪器 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)染色液(天津灏洋),免疫组织化学和TRIzol试剂盒(美国Miltenyi Biotec),75%乙醇和三氯甲烷(天津大茂),Neurobasal-A培养基、B-27及GlutaMAX添加剂(美国Life Technologies),无菌乙二胺四乙酸(ethylene diamine tetraacetic,EDT)抗凝采血管和96孔培养板(美国BD),磷酸盐缓冲液(美国SAB);双荧光素酶报告基因检测试剂盒(中国碧云天),HIF-1α酶联免疫试剂盒(上海BG),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)及IL-1β的酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒(美国R&D Systems)。
1.2 方法
1.2.1大鼠脑缺血再灌注模型的建立及分组 60只雄性大鼠采用随机数字表法完全随机化均分为假手术(sham)组和实验组。实验组大鼠采用10%水合氯醛300 mg/kg剂量腹腔注射,运用颈内动脉线栓法建立大鼠脑缺血模型[12],即暴露大鼠颈外动脉(external carotid arteries,ECA)、颈内动脉(internal carotid artery,ICA)及左颈总动脉后,微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA;在距 CCA 分叉部 4mm 处剪一小口,将拴线插入到 ICA,用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度约18 mm 时停止推送,此时线栓头端至大脑中动脉内并阻断其相应区域的血液供应,并即刻开始计时,90 min后从ICA中轻轻取出线栓进行再灌注[8]。Sham组大鼠麻醉后接受和实验组进行相同的手术操作,但不置入线栓(即无大脑中动脉血流阻断),手术全程及结束后均于37 ℃恒温电热板上维持大鼠体温。术后采用Longa评分评估神经功能损伤[13]。后0.3 mL/100 g水合氯醛腹腔麻醉2组大鼠后断头取脑。
1.2.2TTC染色及梗死体积测量 取“1.2.1”项下2组大鼠脑组织,-20 ℃冰箱速冻15 min,作2 mm厚度的连续切片。将切片置于2%TTC避光,37 ℃温箱20 min,均匀染色,4%多聚甲醛固定,染成红色的为正常脑组织,白色为梗死脑组织,将染色的脑片按切片顺序排列,标号、设定标尺并拍照(图1),取梗死灶相对最大的切片,计算梗死灶所在层面的面积百分比。
1.2.3实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR) 检测脑组织miR-155、HIF-1α、RBPJ及NF-κB的表达 取“1.2.1”项下2组大鼠脑组织,提取RNA,加离子水50 μL溶解RNA,15 ℃水浴10 min,使用紫外分光光度计测定提取RNA的纯度,储存于-80 ℃冰箱中。进一步将RNA反转录为cDNA,随后采用qRT-PCR检测miR155、HIF-1α、RBPJ及NF-κB的表达。RTQ-PCR反应条件如下:95 ℃预反应2 min,95 ℃变性,扩增40个循环,60 ℃退火、延伸。miR155(正向5′-GCTTCGGTAATGCTAATCGTG-3′,反向5′-CAGAGCAGGGTCCGAGGTA3′,);Notchl (正向5′-TCAATGTTCGAGGACCAGATG-3′,反向5′-TCACTGTFGCCTGTCTCAAG-3′);Hesl (正向5′-AGCCAACTGAAAACACCTGATY-3′,反向5′-GGACTrrATGATTAGCAGTGG-3′);GAPDH(正向5′-GGCAAGTTCAACGGCACAG-3′,反向5′-ACGCCAGTAGACTCCACGAC-3′),比较循环阈值(Ct)法计算基因相对表达量。
1.2.4ELISA检测脑组织中HIF-1α、TNF-α、IL-1β及IL-6 取“1.2.1”项下2组大鼠脑组织,1 200 r/min离心10 min,收集上清液,采用ELISA法检测脑组织中HIF-1α水平,严格按照检测试剂说明书操作。实验组和sham组大鼠及转染慢病毒抑制RBPJ-miR155-NF-κB-HIF-1α通路后实验组大鼠脑组织中TNF-α、IL-1β和IL-6水平同样采用ELISA法检进行,所有操作均按照试剂盒完成。
1.2.5组织病理染色显微镜镜下观察脑组织学 取“1.2.1”项下2组大鼠脑组织,固定于10%福尔马林溶液中,后行石蜡包埋、切片、抗原修复等,再血清封闭,最后行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色;或行免疫组织化学 (immunohistochemistry, IHC)染色,检测对应加NF-κB一抗,加生物素标记二抗,DAB显色,复染细胞核,脱水封片,显微镜镜下观察染色。
1.2.6蛋白印迹法(Western blot)检测HIF-1α、RBPJ及NF-κB的表达 取“1.2.1”项下2组大鼠脑组织,RIPA裂解,转移至4 ℃离心机12 000 r/min离心15 min,取上清液,保存至-80 ℃冰箱,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS- PAGE)分离蛋白质,再转至聚偏二氟乙烯膜 (polyvinylidene fluoride,PVDF)上,加相应抗体后4 ℃ PBST冲洗3次,辣根过氧化物酶(horseradish peroxidase,HRP)结合二次抗体孵育30 min,使用增强化学发光试剂盒处理PVDF膜,使用QualityOne 软件进行分析。
1.2.7双荧光素酶报告基因检测及染色质免疫共沉淀测序检测miR155与HIF-1α、RBPJ及NF-κB的相互作用位点 使用Promega 的双荧光素酶基因报告分析系统进行样品荧光素酶活性的测定,将HIF-1α基因相关结合位点the hypoxia-responsive element (HRE)及E-box: CANNTG至pSICHECK-2双荧光素报告载体中,使用miR155片段分别与HRE质粒载体及CANNTG载体共同转染血管内皮细胞(vascular endothelial cell,VEC)细胞,使用双荧光素试剂盒检测HRE及E-box:CANNTG的调控;分别将RBPJ、NF-κB基因相关序列3′UTR及突变位点克隆至pSICHECK-2双荧光素报告载体中,使用miR155片段分别与3′UTR质粒载体及突变载体共同转染VEC细胞,使用双荧光素试剂盒分别检测RBPJ、NF-κB基因相关序列3′UTR及突变序列的调控作用;采用染色质免疫共沉淀测序技术(chromatin immunoprecipitation followed by sequencing,ChIP-Seq)进行大鼠脑组织细胞的裂解,使用提取总脱氧核糖核酸(deoxyribonucleic acid,DNA),使用抗体进行免疫沉淀,通过洗涤、解交联等得到纯化的ChIP-DNA片段。
1.2.8神经元细胞培养 取SD乳鼠麻醉状态下处死,整只浸泡于75%乙醇中约5 min,无菌取头、取大脑,取出的双侧大脑海马置于预冷的D-Hank's平衡盐溶液中;将海马组织剪成1 mm3大小的组织块,0.25%胰蛋白酶消化15 min,置特殊培养基(谷氨酰胺500 μL、双抗500 μL、B27 1 mL及neurobasal-A 48 mL)于37 ℃、5%CO2、95%湿度培养箱中进行培养[14],最终获取原代神经元细胞以进行后续实验。
1.2.9慢病毒转染 乳鼠神经元细胞接种于6孔板中,于37 ℃、5%CO2条件下培养。待细胞生长覆盖度达50%时进行慢病毒感染,对照组加10 μL培养基,转染组分别加miR155-shRNA 10 μL +Polybrene 2 μL、HIF-1α-shRNA 10 μL+Polybrene 2 μL、RBPJ- shRNA 10 μL+Polybrene 2 μL、NF-κB- shRNA 10 μL+Polybrene 2 μL干扰病毒,转染过夜,每日更换培养基,5 d后使用Western blot鉴定进行病毒转染效果检查,转染成功的细胞进行后续实验。 收集对照组和转染组上清液,采用ELISA法检测RBPJ-miR155-NF-κB-HIF-1α中沉默其中1个分子后其它3个分子的表达水平;实验操作流程具体按照检测试剂说明书操作。
1.3 统计学分析
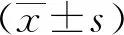
2 结果
2.1 缺血再灌注损伤大鼠模型
sham组大鼠Longa评分为(0.00±0.00)分,实验组为(2.59±0.39)分,实验组高于对照组,差异有统计学意义(t=14.92,P<0. 001);经TTC染色后,梗死区域为白色,非梗死区域为红色,实验组大鼠脑梗死面积明显大于sham组,差异有统计学意义(P<0.05)。见图1。
注:A为TTC染色(白色为梗死区域,红色为非梗死区域),B为梗死面积百分比;(1)与sham组比较,P<0. 05。
2.2 RBPJ-miR155-NF-κB-HIF-1α通路效应分子的含量
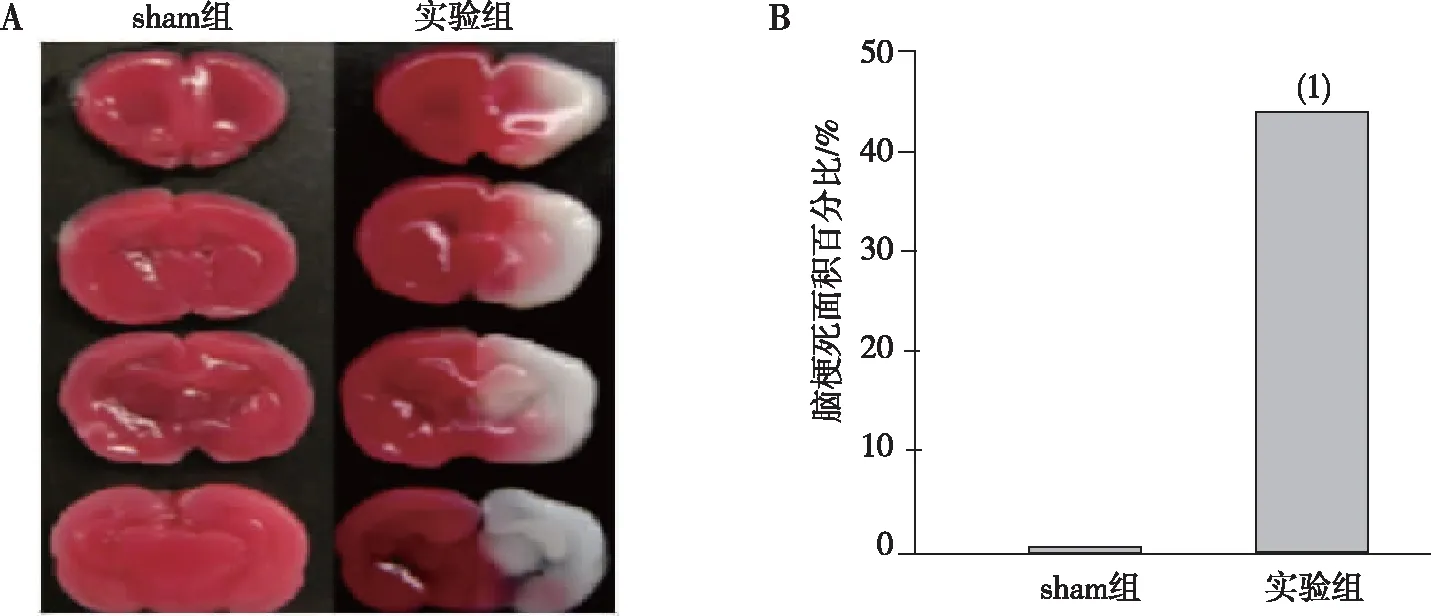
HE染色结果表明,sham组大鼠大脑皮层组织完整、神经元完整、细胞结构清晰且NF-κB存在于细胞浆、内无明显移位,实验组大鼠神经元细胞数量明显减少、NF-κB明显从细胞浆移位于细胞核;免疫印迹法检测发现实验组大鼠脑组织中miR-155、HIF-1α、RBPJ及NF-κB的表达水平均高于Sham组,差异均有统计学意义(P<0. 05)。见图2和图3。

图2 sham组和实验组大鼠神经元细胞和NF-κB的表达(400×)
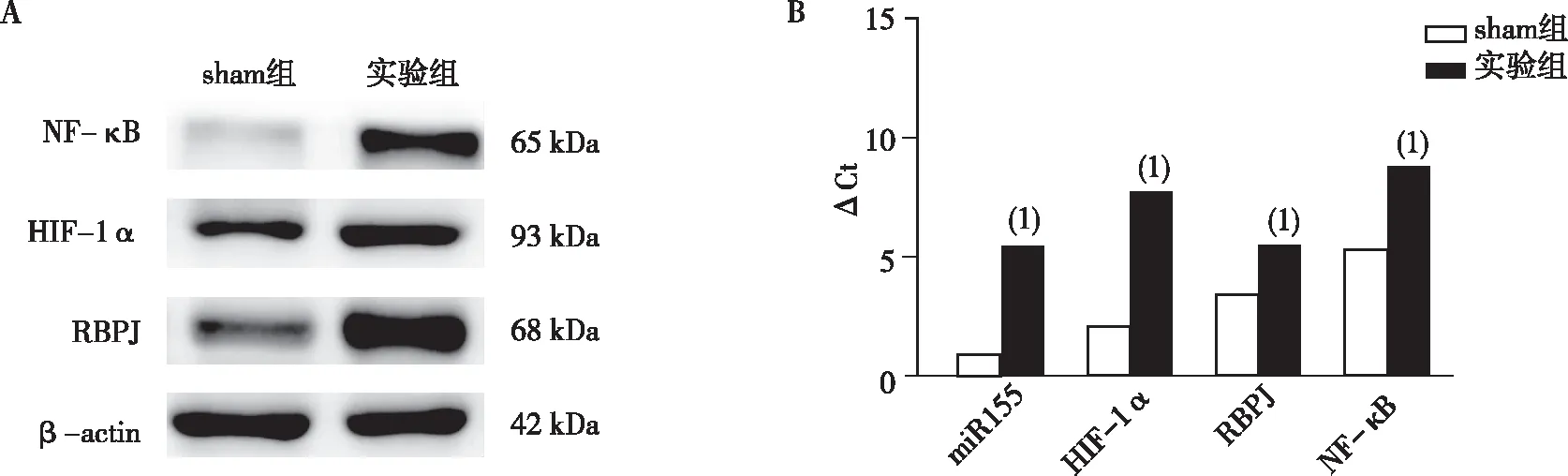
注:A为条带灰度图;B为qRT-PCR定量结果;(1)与sham组比较,P<0. 05。
2.3 RBPJ-miR155-NF-κB-HIF-1α通路轴效应分子的关系
使用基因沉默技术,分别沉默miR155、HIF-1α、RBPJ、NF-κB其中的一种对RBPJ-miR155-NF-κB-HIF-1α通路效应分子的关联性进行验证,结果表明沉默RBPJ-miR155-NF-κB-HIF-1α通路中单个效应分子,剩余的3个效应分子的表达均较sham组升高(P<0. 05)。见表1。
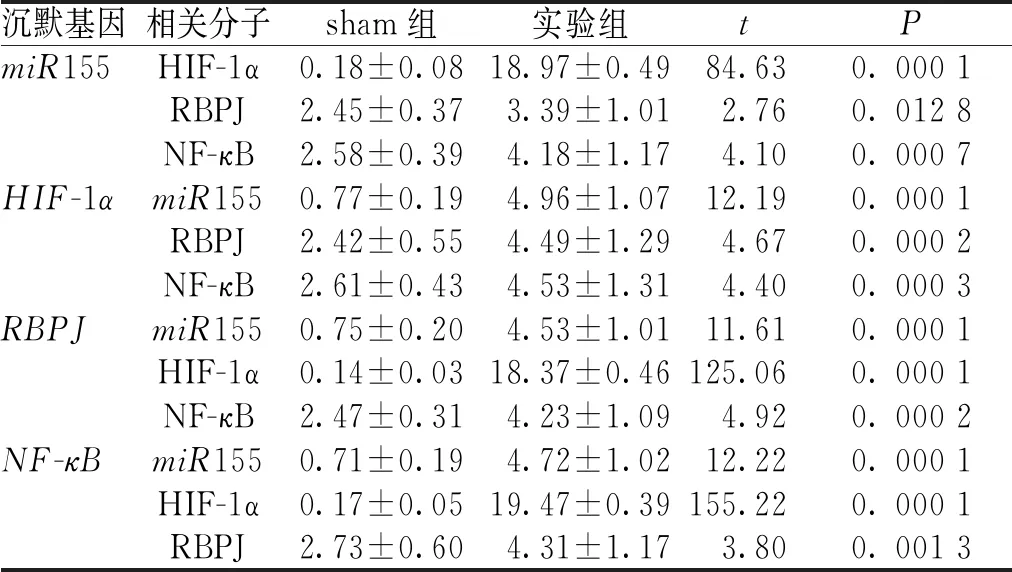
表1 RBPJ-miR155-NF-κB-HIF-1α通路效应分子的关系
2.4 miR155与HIF-1α、RBPJ及NF-κβ的相互作用位点
利用双荧光素酶报告基因检测、ChIP-Seq检测miR155与HIF-1α、RBPJ及NF-κB相互作用位点,对miR155与HIF-1α的结合情况进行研究分析,发现两者之间的结合位点为E-box: CANNTG,双荧光素酶报告提示miR-155与E-box:CANNTG进行结合;对miR-155与NF-κB的结合情况进行研究分析,结果发现两者之间的结合位点为AC-CAAAG,双荧光素酶报告提示miR-155与NF-κB3′UTR进行结合;对miR-155与RBJP的结合情况进行研究分析,双荧光素酶报告提示miR-155与RBJP3′UTR进行结合。见图4。
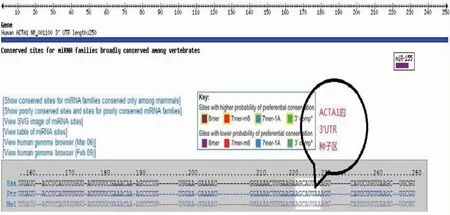
注:黑色标注圈为ACTA1的3′UTR种子区。
2.5 RBPJ-miR155-NF-κB-HIF-1α通路与炎症因子的联系
ELISA法检测结果显示,实验组大鼠阻断前血清炎症相关因子TNF-α、IL-1β和IL-6的表达均较sham组升高,差异均有统计学意义(P<0. 05);通过慢病毒转染抑制RBPJ-miR155-NF-κB-HIF-1α通路后,TNF-α、IL-1β和IL-6的表达较实验组转染前均下降(P<0. 05)。见表2。

表2 sham组和实验组大鼠血清炎症因子水平
3 讨论
缺血性脑卒中的治疗已取得了很大进展,但仍有许多问题需要解决。溶栓时间窗的扩展和溶栓药物的选择均是亟待解决的问题[15-16]。临床上常用的溶栓药物如纤溶酶等,虽然可恢复缺血半暗带的血流供应,挽救缺血组织,然而治疗方式受时间影响较大,有效时间窗较短;且在恢复供血的过程中,可能会造成脑缺血再灌注损伤[17]。脑缺血再灌注的过程中,受损脑组织由于血流量的减少,存在缺氧问题,炎症反应在缺氧状态下不断增强,炎症介质快速增多,介导不同的信号通路[18]。本研究在动物水平通过建立大鼠脑缺血再灌注损伤模型,通过荧光定量PCR及免疫组化等方法对RBPJ-miR155-NF-κB-HIF-1α通路效应分子之间的关联性进行合理推测,并通过基因过表达、沉默技术进一步验证该通路miR155、HIF-1α、RBPJ及NF-κB效应分子之间是互相连通的,也进一步验证RBPJ-miR155-NF-κB-HIF-1α通路的存在。
脑缺血再灌注模型中脑损伤机制较为复杂,受多种细胞通路、多种调控分子的作用,在病情的发生和发展过程中起着重要的作用[19]。已有研究证实miR155、HIF-1α、RBPJ及NF-κB等与脑缺血再灌注损伤密切相关,对脑组织的损伤呈上升趋势,且能激活炎症相关因子来促进局部炎症反应的发生及发展[20-21],但各通路相关蛋白间是否存在相互作用,以及各通路相关蛋白间是否相互作用尚不明确。本研究结果表明,RBPJ-miR155-NF-κB-HIF-1α通路相关蛋白miR155、HIF-1α、RBPJ、NF-κB在脑缺血损伤再灌注模型大鼠中的表达均高于sham组,提示该通路与大鼠脑缺血损伤再灌注损伤密切相关,与既往的文献报道一致[22]。
双荧光素酶报告基因技术和ChIP-Seq为近年来新兴的生物测定技术是在染色质免疫沉淀技术及基因测序技术基础上发展起来的综合性检验技术,能够实现获得与DNA结合蛋白相互作用的DNA片段信息,是与深度基因相结合的方法,据报道两种检测方法具有一定的可行性[23],故本次研究的方法是准确合理的。本研究主要使用上述方法进行了通路中miR155与其他信号分子间相互作用位点的测定,证实了miR155与HIF-1α、RBPJ以及NF-κB均存在相互作用的结合位点。
脑缺血再灌注时,在缺血灶局部存在大量炎症因子,并且炎症细胞的激活、浸润及黏附分子的合成分泌呈一种相互增强相互促进的级联反应,并通过一定的炎症信号通路使脑组织由缺血性损伤转向炎症性损伤[24]。本次研究表明RBPJ-miR155-NF-κB-HIF-1α通路与炎症反应的发生、发展密切相关,通路的相关蛋白miR155与HIF-1α、RBPJ以及NF-κB相互影响,共同作用,通过阻断上述通路能够降低相关炎症因子的表达,说明脑缺血再灌注损伤模型中炎症因子表达增多与RBPJ-miR155-NF-κB-HIF-1α通路激活密切相关,将来可通过改善RBPJ-miR155-NF-κB-HIF-1α信号通路的响应,会在一定程度上减轻脑缺血再灌注的炎症反应。
综上所述,RBPJ-miR155-NF-κB-HIF-1α通路在大鼠脑缺血再灌注损伤中起着重要的调控作用,机制可能与该通路相关蛋白miR155、HIF-1α、RBPJ及NF-κB之间相互影响,并和炎症因子的表达相关。
