溶酶体酸性环境促进猪血凝性脑脊髓炎病毒的复制
2022-06-17李彩丽王改丽柳雨竹艾晓敏王真真关继羽贺文琦兰云刚陆慧君
李彩丽,王改丽,柳雨竹,艾晓敏,王真真,李 姿,关继羽,贺文琦,高 丰,兰云刚*,陆慧君*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林省畜牧兽医科学研究院,吉林 长春 130062 )
猪血凝性脑脊髓炎(porcine hemagglutinating encephalomyelitis,PHE)是由猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV)感染而引起仔猪的一种急性、高度接触性传染病[1]。PHEV是冠状病毒科β冠状病毒属成员,也是首个被发现能侵害外周中枢神经系统的冠状病毒[2-3],主要侵害哺乳期仔猪。感染仔猪临床主要表现呕吐、食欲废绝与典型的神经症状[4-5]。近年来PHEV引起的仔猪发病率与病死率在逐年增加,给养猪业造成巨大经济损失。深入研究PHEV的致病机制能够为PHE的有效防控提供重要理论依据。
溶酶体是一种存在于所有真核细胞中的酸性膜结合细胞器,是内吞作用、吞噬作用和自噬传递大分子降解和再循环的中心[6]。溶酶体还参与调控质膜修复、信号转导和细胞分解代谢等细胞内多种生理过程[7]。研究发现,溶酶体体积增大和溶酶体功能紊乱与多种神经系统疾病的发生密切相关,在多种病毒的致病过程中发挥重要的调控作用,其功能与膜和管腔中的水解酶和酸化蛋白密切相关。神经嗜性的PHEV侵入细胞后,神经细胞释放出的病毒粒子被临近的胶质细胞摄取后,溶酶体囊泡结构将其包裹,可限制病毒进一步扩散[8-9]。然而,PHEV对神经细胞溶酶体功能的影响及机制尚不明确。因此,本研究应用PHEV感染神经瘤母细胞(N2a细胞)的模型,研究溶酶体相关蛋白的变化及溶酶体对PHEV复制影响, 有助于揭示PHEV的分子致病机理,为进一步研究PHE的发病机制奠定基础并为该病的科学防控提供新思路。
1 材料与方法
1.1 病毒和细胞PHEV株PHEV-CC14(MF08-3115)[8]、小鼠神经瘤母细胞(N2a细胞)均由吉林大学动物医学学院病理解剖实验室保存。
1.2 主要试剂DMEM培养基和胎牛血清均购自GIBCO公司;胰蛋白酶购自Sigma公司;5×SDS-PAGE Loading Buffer、RAPI蛋白裂解液(p0013-B)、抗荧光衰减封片剂均购自碧云天生物技术有限公司;PageRuler预染蛋白Marker购自赛默飞公司;2×SYBR Green Master Mixture购于Bimake公司;BafA1、Anti-mouse IgG (H+L),F(ab′)2 Fragment (Alexa Fluor®594 Conjugate) # 8890荧光二抗均购自CST公司;GAPDH抗体、Fluorescein (FITC)-conjugated Affinipure Goat Anti-Rat IgG(H+L)488荧光二抗均购自于Proteintech公司;M-MLV反转录酶、RRI、10 mmol/L dNTP、RNAiso Plus Total RNA提取试剂均购自TaKaRa公司;溶酶体相关膜蛋白1(LAMP1)抗体购自BD Pharmingen公司(美国);溶酶体荧光探针Lyso Tracker Red DND-99购自Invitrogen公司(美国);PVDF膜(孔径为0.45 μm)购自Merck Millipore公司;PHEV多抗由本实验室制备并保存。
1.3 细胞培养与病毒感染将N2a细胞接种于6孔板中,置于37℃、5% CO2培养箱中培养,直至细胞密度达到60%~80%时进行PHEV感染试验,以确保接毒后的感染效率。用无血清的培养液先对细胞表面进行清洗,之后向培养瓶中缓缓加入0.2 mL的PHEV病毒液(TCID50为10-4.5/0.1 mL),将细胞置于培养箱中孵育1 h。随后,加入含2%血清的DMEM培养液,按试验需求收集感染PHEV不同时间的细胞样品。
1.4 LysoTracker Red标记与BafA1处理将N2a细胞接种于12孔板中无菌的细胞爬片上,培养至细胞的密度能够达到60%左右时,加入0.1 mL PHEV病毒液(TCID50为10-4.5/0.1 mL),感染48 h后使用50 μmol/L LysoTracker Red在37℃、5% CO2培养箱中孵育45 min以标记溶酶体,然后用37℃ PBS洗涤爬片,封片。
经BafA1抑制剂(300 μmol/L)预处理1 h后的N2a细胞,接种PHEV并以等体积的DMEM作为对照,孵育1 h后,加入含有相同浓度BafA1的DMEM共培养24 h收集样品,进行后序操作。
1.5 Western blot检测用含1 mmol/L PMSF的RAPI蛋白裂解液裂解1.3和1.4收集的细胞样品,置于冰上孵育30 min充分裂解蛋白,然后将样品以12 000 r/min 4℃离心10 min,以去除杂质;最后加入上样缓冲液,于微波炉中煮沸10 min 获得蛋白样品。进行12%SDS-PAGE电泳后并电转印至PVDF膜上,10%脱脂奶粉37℃封闭1 h后,分别加入LAMP1、PHEV、GAPDH抗体4℃孵育过夜;TBST清洗5 min/次,洗5次膜后使用HRP标记的二抗孵育,洗膜后ECL显色,并利用Image J软件对蛋白进行定量分析。
1.6 荧光定量PCR检测按照1.3和1.4方法处理细胞后,根据RNAiso Plus Total RNA提取试剂说明书提取细胞总RNA,反转录为cDNA。在GenBank中查找编码PHEV N蛋白的基因(AY078417),使用Primer Premier 5.0软件设计特异性引物。PHEV-NFP、5′-CCGGAATTCGGTC-TTTCACTCCTGGCAAG-3′和PHEV-NRP:5′-CG-GGGTACCTTATATTTCTGAGGTATC-3′,将引物序列交由库美生物合成。PCR扩增结束后,回收目的条带连入pMD18-T载体中,再进行质粒提取,D260 nm值定量,将质粒倍比稀释作为标准品进行荧光定量PCR反应。同时用同样的方法设计PHEV特异性引物:上游引物5′-TCTGGGAATCCTGACGAG-3′,下游引物5′-AGGCGCTGCAACACTTAC-3′,检测PHEV的mRNA表达水平。荧光定量PCR反应体系如下:2×SYBR Green Master Mix 10 μL、cDNA模板2 μL、上下游引物各1 μL、蒸馏水补充至20 μL。反应条件:95℃ 3 min;95℃ 15 s,60℃ 30 s,40个循环;72℃ 10 min。所得数据由QuantstudioTMDesign & Analysis Software version 1.5.1软件分析。
1.7 间接免疫荧光将N2a细胞接种于含有细胞爬片的12孔板中,待细胞生长密度达到60%左右时,接种PHEV并设置未处理组为空白对照。48 h后弃去培养基,并用PBS洗3次,使用4%多聚甲醛室温下固定15 min, 然后PBS洗3次,置于含有0.05%TritonX-100的5%脱脂奶粉37℃透膜封闭1 h 后,加入稀释好的一抗于4℃孵育过夜;次日,PBS洗3次后,加入荧光二抗,37℃避光孵育1 h;PBS清洗细胞爬片,清洗擦干净后滴加含有DAPI染核的封片剂进行封片。最后,根据不同的染料选择不同波段的激发光,使用激光共聚焦显微镜观察结果采集图像。
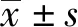
2 结果
2.1 PHEV感染N2a细胞后LAMP1蛋白表达变化收集PHEV感染N2a细胞48 h后的蛋白样品,通过Western blot方法进行检测,结果如图1所示,与空白对照组相比,接毒组LAMP1蛋白表达量显著升高。
2.2 PHEV与溶酶体的共定位分析按照1.7的方法处理PHEV感染48 h的N2a细胞,用特异性LAMP1单抗和PHEV多抗进行标记,并且以正常N2a细胞作为阴性对照。结果如图2A所示,对照组N2a细胞中的LAMP1呈现弥散且大小均匀分布,但在感染PHEV的细胞中,定位于细胞核周围的LAMP1聚集呈现明亮的较大囊泡样,并且与PHEV共定位表达。此外,通过对形态大小>1 μm的溶酶体数量进行统计,结果发现PHEV感染致溶酶体体积增大(图2B)。上述结果表明,PHEV能与神经细胞溶酶体共定位,并使溶酶体体积增大。
2.3 PHEV对溶酶体pH的影响PHEV感染N2a细胞48 h后,用溶酶体红色荧光探针lysotracker进行染色,激光共聚焦显微镜观察细胞内荧光染色情况。结果如图3A所示,对照组N2a细胞中,红色斑点较少且黯淡,但在感染PHEV的细胞中,红色斑点较多且明亮,并通过Image J软件对照组和接毒组的单个细胞的荧光强度进行分析,统计结果如图3B。结果表明,PHEV感染N2a细胞会使溶酶体酸性增强。
A.LysoTracker Red标记PHEV感染的N2a细胞;B.单个细胞的荧光强度
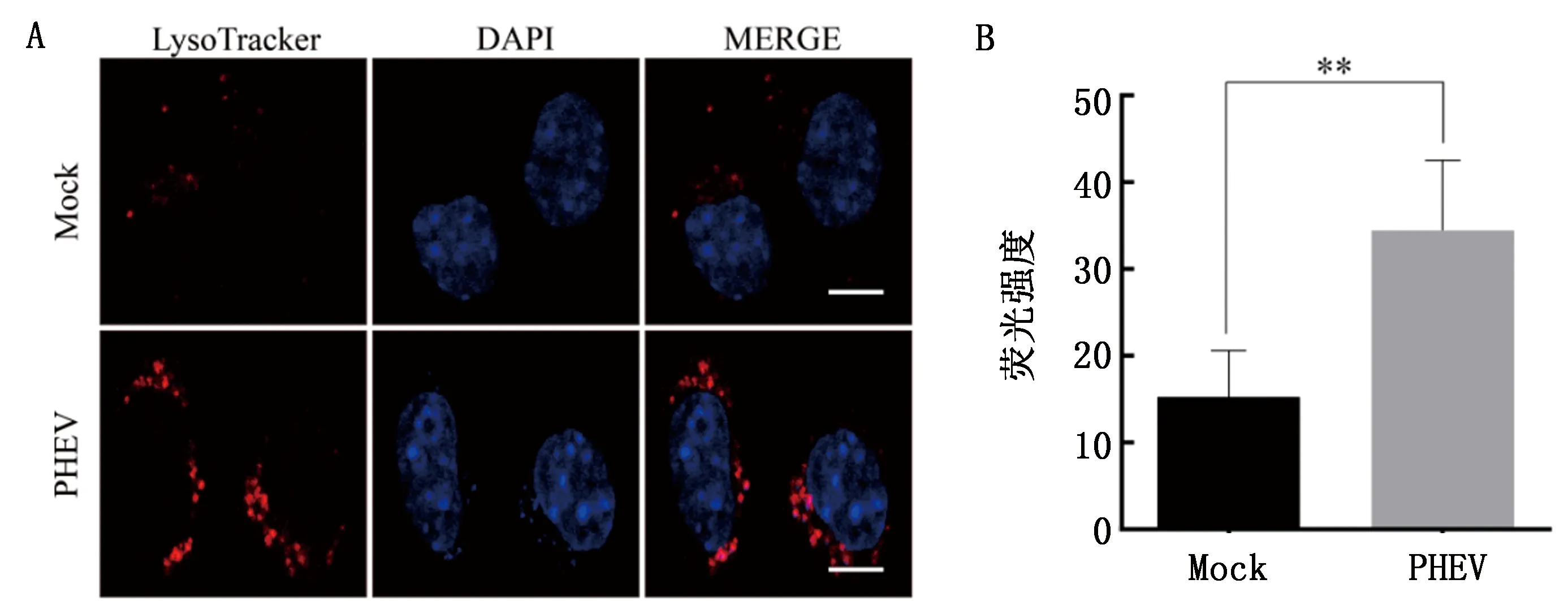
2.4 间接免疫荧光检测BafA1抑制溶酶体酸化的效果按照1.4的方法使用BafA1处理细胞,使用溶酶体红色荧光探针lysotracker 进行染色45 min,然后用4%多聚甲醛固定细胞并用特异性LAMP1单抗和PHEV多抗进行荧光标记。结果如图4所示,BafA1抑制剂处理后,溶酶体荧光探针Lyso TrackerRed的红色荧光强度都减弱,表明用BafA1抑制剂处理后再接种病毒,BafA1抑制剂起到抑制溶酶体酸化的效果。
图4 间接免疫荧光检测BafA1抑制剂预处理N2a细胞
2.5 BafA1预处理N2a细胞后对PHEV复制的影响按照1.4的方法使用BafA1处理细胞,然后感染PHEV 24 h收集细胞裂解液样品,通过Western blot方法检测PHEV的表达水平。结果如图5 A所示,经BafA1预处理细胞后再感染PHEV,细胞裂解液中病毒的表达量明显低于未处理的感染组。根据病毒的N基因拷贝数确定样品中PHEV基因组RNA的拷贝数,荧光定量PCR检测发现(图5B),胞内的PHEV基因组RNA的拷贝数下降,病毒含量降低。该结果表明,经BafA1抑制剂预处理N2a细胞后再感染PHEV,能够阻碍PHEV在N2a细胞中的复制。

A.细胞裂解液中PHEV N蛋白表达变化;B.细胞裂解液中PHEV N基因拷贝数变化
3 讨论
PHEV为β冠状病毒属的成员,主要侵害仔猪,尤其是3周龄以内的哺乳仔猪感染率最高,被感染仔猪临床上主要表现为神经症状、呕吐和衰竭等[5,11]。近年来不断有猪场暴发PHE的报道,猪感染PHEV非常普遍且呈世界性分布,PHEV对养猪业存在巨大的危害。此外,2015年美国密歇根州暴发新型PHEV,被感染成年猪表现出流感样症状[12],说明PHEV还存在变异流行的风险。因此对PHEV致病机制的研究尤为重要。
溶酶体是真核细胞中广泛存在的一种富含酸性水解酶的细胞器,由一个带有膜蛋白和酸性管腔的单层脂质组成,主要通过降解内源和外源性大分子物质来维持细胞内的动态平衡;而功能紊乱可导致致病相关蛋白的过度积累使正常的细胞功能逐渐丧失[13-14]。已有研究发现,溶酶体功能的紊乱与多种神经系统疾病的发生发展密切相关。溶酶体功能紊乱可导致致病相关蛋白过度积累致使疾病发生[15],如:溶酶体系统的改变,导致β-淀粉样蛋白(Aβ)沉积进而诱发阿尔茨海默症(AD);亨廷顿病(HD)是由突变亨廷顿蛋白在溶酶体中缓慢积累,改变了溶酶体活性,导致聚集的突变亨廷顿蛋白降解异常引起的。目前研究发现,溶酶体在多种病毒的致病过程中发挥重要的调控作用,如:甲型流感病毒神经氨酸酶(NA)直接结合溶酶体相关膜蛋白并诱导溶酶体破裂,进一步导致宿主细胞死亡[7]。
当前新冠肺炎的暴发对全球人类健康造成了相当大的危害,新冠病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是其暴发的病原体[16]。SARS-CoV-2进入细胞依赖于病毒刺突(S)蛋白与细胞受体的结合以及被宿主细胞蛋白酶裂解(比如组织蛋白酶L和组织蛋白酶B)的刺突蛋白,而组织蛋白酶L和组织蛋白酶B是溶酶体途径的重要组成部分,2种酶几乎都位于溶酶体中[17]。冠状病毒通过S蛋白吸附到细胞表面受体后,溶酶体蛋白酶通过裂解冠状病毒表面刺突蛋白,激活宿主和病毒膜的融合,帮助病毒进入宿主细胞的细胞质,溶酶体蛋白酶在冠状病毒入侵中发挥关键作用,先是通过晚期核内体/MVBs从高尔基体/TGN到溶酶体的直接途径,第2种更迂回的途径是通过逆行转运回到ER/ERGIC,病毒再到达溶酶体[18-19]。利用溶酶体中的组织蛋白酶L和组织蛋白酶B以及细胞外胰蛋白酶独立激活S蛋白进行膜融合[20]。研究发现,溶酶体酸化是溶酶体酶的稳定性和酶的活性所必需的,即使pH值的微小增加也足以抑制这些酶并停止其关键的生物学功能[21],如BafA1预处理细胞阻止溶酶体酸化,从而抑制了猪三角冠状病毒(PDCoV)进入细胞[22]。PHEV是一种嗜神经性病毒,能够侵入中枢神经系统(CNS),引起急性感染和宿主神经功能障碍,PHEV感染后溶酶体相关蛋白的变化及溶酶体酸性环境对PHEV的影响研究仍有待阐明。
在本研究中,首先我们利用Western blot的方法对PHEV感染N2a细胞后对溶酶体相关蛋白的影响进行检测,结果发现PHEV感染后溶酶体相关膜蛋白1(LAMP1)重组蛋白总量显著升高。溶酶体结构和功能的完整性需要溶酶体相关膜蛋白以及腔内组织蛋白酶的共同调节,由此推测PHEV感染可能引起了神经细胞溶酶体功能的紊乱。为了进一步明确PHEV感染对溶酶体的影响,我们进行了间接免疫荧光分析,发现病毒能与神经细胞溶酶体共定位,并使溶酶体体积增大,我们推测病毒感染改变了溶酶体的形态。随后,我们用溶酶体荧光探针Lyso TrackerRed DND-99标记PHEV感染48 h后的N2a细胞,结果发现病毒感染后会使溶酶体的酸性增强,提示溶酶体酸性微环境可能对PHEV的生命周期造成影响。为了进一步明确溶酶体酸性微环境对PHEV复制的影响,我们使用BafA1预处理细胞使空泡型H+-ATP酶受到抑制进而阻止溶酶体酸化,经Western blot和荧光定量PCR检测发现,感染PHEV后胞内病毒含量却表现出明显低于未经BafA1处理的感染组。结果表明,在溶酶体酸化环境受到抑制时,PHEV复制也会受到阻碍,胞内子代病毒含量显著降低。具体相关调控机制研究仍有待开展。
综上,本研究结果表明PHEV感染神经细胞能定位于溶酶体,影响溶酶体的形态和功能,并引起溶酶体相关蛋白和组织蛋白的变化及溶酶体酸性微环境改变对PHEV复制的作用。上述研究结果不仅有助于揭示PHEV的致病机制,以及为PHE的防制研究提供新思路,同时还可以为研究溶酶体在其他神经系统病毒感染性疾病中的作用提供研究基础。
