黄连素对人耐紫杉醇去势性前列腺癌细胞活力、增殖及HMGB1表达的影响*
2021-07-02张健彭煜晖李毅梁欣明付文莉张婷柏华禹文峰吴昌学张启芳
张健, 彭煜晖, 李毅, 梁欣明, 付文莉, 张婷, 柏华, 禹文峰, 吴昌学* , 张启芳*
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004; 2.贵州医科大学第三附属医院 医学中心实验室, 贵州 都匀 558000)
前列腺癌是男性泌尿系统的恶性肿瘤,已成为全世界男性癌症相关死亡率的第2大原因[1], 因其早期症状与前列腺炎相似,常被人忽视,致使多数前列腺癌患者在被诊断时已为转移性前列腺癌(metastatic prostate cancer, mPCa)[2]。mPCa通常接受雄激素剥夺治疗[3],该疗法在早期阶段有效,然而许多mPCa患者慢慢发展雄激素不敏感,即去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[3]。紫杉醇(paclitaxel,PTX)通常为CRPC 患者标准治疗选药,PTX是一种生物碱,可通过作用于细胞微管发挥其抗肿瘤作用,但是CRPC对PTX的耐药性限制了其治疗效果[4]。小檗碱(berberine,BBR)是一种天然生物碱化合物,存在于几种药用植物中,如刺檗;因它可从中药黄连中分离,又称黄连素,是黄连抗菌的有效成分[5]。近几年研究表明,BBR能通过不同靶基因有效地抑制几种肿瘤细胞生长,也可通过上调miR-203增强胃癌细胞对顺铂的敏感性,亦可通过抑制核因子κB(nuclear factor kappa-B,NF-κB)通路阻碍黑色素瘤细胞A375.S2迁移[6-7];BBR可以诱导胶质母细胞瘤细胞U251和U87进入衰老状态,不再生长[8];BBR通过诱导肝癌细胞自噬介导的死亡和凋亡介导的死亡[9]。但是,BBR对DU145R细胞的影响机制尚不清楚。此外,高迁移率族蛋白1(high mobility group box 1,HMGB1)在多种癌组织的表达也显著高于相应的正常组织[10-11];HMGB1和RAGE共表达与前列腺癌不良预后密切相关[12];小鼠结肠癌细胞CT26中,HMGB1的释放促进了细胞的转移[13];HMGB1可通过激活蛋白激酶B信号通路从而促进前列腺癌的转移[14]。重要的是,在人耐PTX去势性前列腺癌细胞中抑制HMGB1的表达后,细胞增殖受到显著抑制[15],但在人耐PTX去势性前列腺癌细胞中BBR是否与HMGB1作用尚不清楚。因此,本研究拟探讨BBR是否可通过HMGB1表达影响DU145R的细胞活力和增殖,现将结果汇报如下。
1 材料与方法
1.1 材料
1.1.1细胞来源 人前列腺癌细胞株DU145细胞购于美国模式培养物集存库(American type culture collection,ATCC),人耐PTX去势性前列腺癌细胞株DU145R为本实验室构建。
1.1.2主要试剂和仪器 RPMI 1640培养基及澳洲胎牛血清(美国Gibco),黄连素(中国 大连美仑生物), 兔抗单克隆抗体HMGB1与HRP标记的抗兔的二抗(美国CST),超敏化学发光试剂盒(enhanced chemiluminescence,ECL)和聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore),二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒和蛋白Marker(美国Thermo),抗体稀释液、封闭液、十二烷基苯硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)凝胶配置试剂盒(中国碧云天),PTX和二甲基亚砜(dimethyl sulfoxide,DMSO;美国Sigma),GeneGnome XRO NPC 化学发光成像仪(英国SYNGENE),Varioskan LUX多通道酶标仪(美国 Thermo Fisher Scientific),Bio-Rda MiniⅡ/Ⅲ垂直电泳仪和Bio-Rda powerpacHC高流电源(美国Bio-Rad)。
1.2 方法
1.2.1细胞培养及处理 人前列腺癌细胞株DU145及PTX耐药前列腺癌细胞株DU145R放于含有10%胎牛血清和1×Antibiotic-Antimycotic的RPMI 1640培养基,5%CO2的37 ℃培养箱中培养。
1.2.2细胞活力检测 取对数生长期DU145R细胞,调整细胞悬液浓度为1×104个/孔,接种于96孔板中。使用0、5、10、20、30及50 μmol/L BBR(即0、5、10、20、30及50 μmol/L BBR组)处理48和72 h,使用细胞计数试剂盒8(cell counting kit-8,CCK8)检测450 nm波长处的光密度(optical density,OD)值,并计算抑制率[抑制率=(OD对照组-OD处理组)/OD对照组×100%]评估细胞活力。
1.2.3细胞克隆形成实验 取对数生长期DU145R细胞,消化重悬制备为单细胞悬液,调整细胞浓度为3×103接种于6孔板中,DMSO、10及 20 μmol/L BBR处理细胞(即DMSO组、10 μmol/L BBR组及20 μmol/L BBR组),每3天更换1次含药物的培养基,14 d后甲醇固定,结晶紫染色并计算克隆形成数量。
1.2.4HMGB1基因表达分析及预后分析 利用Oncomine数据库分析HMGB1mRNA在人前列腺癌及正常组织中的差异表达,然后利用人蛋白质图谱(human protein atlas , HPA)数据库分析HMGB1在正常组织和前列腺癌中的蛋白表达差异;使用TIMER2.0在线分析工具分析HMGB1基因表达于前列腺癌患者预后的关系,根据HMGB1基因表达中位值将前列腺癌患者分为HMGB1高表达组与HMGB1低表达组。
1.2.5蛋白印迹(Western blot)法检测HMGB1蛋白表达 取对数生长期细胞DU145作为DU145组,0、10及20 μmol/L BBR处理对数生长期DU145R细胞分别作为0、10及20 μmol/L DU145R组,收集各组细胞,提取总蛋白,蛋白上样30 μg,80 V恒压电泳并将目的蛋白转移到PVDF膜;5%脱脂牛奶室温封闭1 h,室温下孵育HMGB1一抗(1 ∶1 000)2 h,然后孵育抗兔二抗(1 ∶1 000)1 h,ECL超敏化学发光液检测蛋白的表达,利用Image J分析图像强度。
1.3 统计学分析
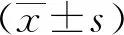
2 结果
2.1 细胞活力
使用0、5、10、20、30及50 μmol/L BBR处理DU145R48和72 h后,CCK8试剂盒检测BBR对细胞活力的影响。结果表明,与0 μmol/L BBR组相比,各浓度组中DU145R细胞的抑制率降低(P<0.05或P<0.01)。见图1。
注: 0 μmol/L BBR组比较,(1)P<0.05,(2)P<0.01。
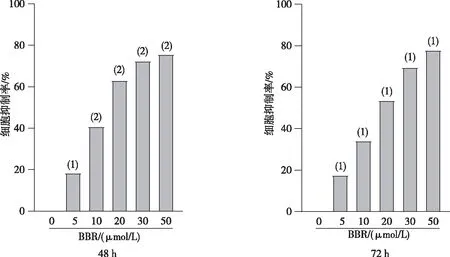
2.2 细胞增殖
克隆形成实验结果表明,与DMSO组相比,5 与10 μmol/L BBR组DU145R细胞的克隆形成数量减少(P<0.05或P<0.01)。见图2。
注: 与DMSO组比较,(1)P<0.05,(2)P<0.01。
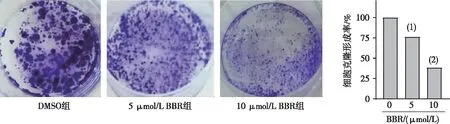
2.3 HMGB1在耐药细胞高表达和与前列腺癌的临床相关性
采用Western blot法检测了HMGB1在DU145R中的表达,结果显示HMGB1在DU145R中的表达明显高于DU145细胞(P<0.001);使用Oncomine数据库及HPA分别分析HMGB1在前列腺正常组织与前列腺癌中的mRNA及蛋白表达水平,结果显示,前列腺癌中的HMGB1 mRNA及蛋白表达水平均高于前列腺正常组织;利用TIMER2.0数据库获取前列腺癌患者生存数据,生存分析结果表明,HMGB1高表达与前列腺癌患者不良预后相关(P=0.019 3)。见图3。
注:A、B分别为HMGB1在DU145R中的表达和定量结果,C为HMGB1 mRNA 的表达,D、E分别为正常组织和前列腺癌组织中HMGB1蛋白表达(200×),F为HMGB1表达与患者生存时间分析; (1)与DU145细胞或正常组比较,P<0.001。
2.4 HMGB1的表达
为了检测在DU145R细胞中BBR是否影响了HMGB1的表达,利用10和20 μmol/L BBR处理细胞12 h后,Western blot法检测HMGB1表达水平,结果显示,10和20 μmol/L BBR组DU145R细胞中HMGB1的表达水平分别低于0 μmol/L BBR组,差异均有统计学意义(P<0.05),提示BBR能抑制DU145R细胞中HMGB1的表达。见图4。
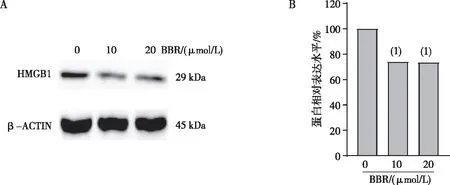
注:(1)与0 μmol/L BBR组比较,P<0.05。
3 讨论
克服CRPC耐药性是临床治疗CRPC的一大难题[16]。本课题组前期结果表明PTX诱导的HMGB1的表达促进CRPC细胞的PTX耐药[15]。本研究结果显示,与对照组相比,BBR处理DU145R细胞后,细胞活力及增殖能力分别随着浓度的增加而降低 (P<0.05),说明BBR能够抑制DU145R细胞活力及细胞增殖;在前列腺癌组织中HMGB1 mRNA水平和蛋白水平明显高于正常组织(P<0.001),HMGB1高表达与前列腺癌患者不良预后相关(P=0.019 3),这说明HMGB1与前列腺癌具有临床相关性;在蛋白水平上,BBR处理下调了HMGB1的表达,进一步揭示了BBR抑制DU145R细胞活力和增殖的机制。
肿瘤细胞以多种方式对化疗作出反应,包括诱导和释放损伤相关分子模式(damage-associated molecular patterns, DAMP)[17]。 DAMP可诱导免疫原性细胞死亡,从而促进宿主抗癌免疫力[12]。HMGB1是DAMP家族成员之一[18]。最近研究报道,由于前列腺素E2 (prostaglandin,PGE2)的作用,致使HMGB1并没有激活免疫活力的能力[17,19]。研究报道,HMGB1的敲低会增加细胞死亡,并在体内和体外恢复癌细胞的化学敏感性[20],这表明此敲低可能导致诱导癌症进展和耐药性。释放到细胞外HMGB1可增强化疗后幸存的残余癌细胞的再生、转移和化学耐药性,例如释放的HMGB1能够促进骨髓瘤、乳腺癌、 肺腺癌、 前列腺癌、甲状腺癌及鼻咽癌等细胞的耐药性[21-26]。从本研究的结果可看出,BBR抑制了HMGB1的表达,提示BBR抑制DU145R细胞活力和增殖与HMGB1相关。此外,HMGB1在前列腺癌组织中表达明显增加,HMGB1高表达与前列腺患者不良预后相关。HMGB1作为检测对前列腺癌诊断指标之一[27-28],说明HMGB1与前列腺癌具有临床相关性。综上所述,HMGB1是耐药前列腺癌细胞细胞的理想靶标。
有研究发现,BBR能够抑制顺铂耐药的胃癌细胞BGC-823及SGC-7901的活力[29],抑制阿霉素耐药的乳腺癌细胞MCF-7活力及增殖[30]。与本研究结果相似,BBR能够有效地抑制DU145R细胞的活力及增殖。本课题组前期研究结果表明HMGB1表达促进CRPC细胞PTX耐药[11]。本研究结果显示BBR可明显抑制HMGB1在DU145R细胞的表达。
综上所述,BBR可以通过下调HMGB1表达抑制DU145R细胞活力和增殖,从而发挥抗肿瘤增殖活性,说明BBR有望成为克服PTX耐药的候选化药物。本研究未在动物体内进行体内实验验证,未来的工作中将在PTX抗性的CRPC小鼠模型中验证BBR是否可抑制PTX耐药。虽然本研究存在一定的局限性,但发现BBR能靶向HMGB1,从而为临床上研究新药物提供了新靶点。
