CT引导下经皮肝穿刺接种兔肝VX2肿瘤模型的建立及其肿瘤的CT、MRI评估
2021-07-02陈天鸣潘耀振
陈天鸣, 潘耀振
(贵州医科大学附属医院 肝胆外科, 贵州 贵阳 550004; 贵州省肿瘤医院 肝胆外科, 贵州 贵阳 550001)
肝细胞癌(HCC)是最常见的肝恶性肿瘤之一,高度恶性、预后较差。合适的肝肿瘤动物模型对于肝癌诊断和各种治疗方法的研究很重要。兔VX2肝肿瘤生长迅速,其动脉血供与人类肝癌相似,且肿瘤大小足以通过临床影像观察到[1],因此,兔VX2肝肿瘤模型已广泛用于肝肿瘤研究的各个方面。动物模型成功建立取决于在兔肝中有效接种VX2并生长形成肿瘤,因此在某种程度上,肿瘤接种技术的改进必定会对HCC的进一步研究提供帮助。以往研究中有通过剖腹术、超声或计算机体层成像(computerized tomography, CT)引导经皮穿刺植入肿瘤细胞悬液和肿瘤碎片等方法进行兔肝脏VX2肿瘤的复制,但是都有缺陷[2],常会出现移植瘤处肝表面及临近腹壁发生转移,进而影响实验结果[3]。本探究对兔VX2肝癌模型的制作方法进行了改良,并就其影像学进行评价,现报告如下。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性实验用新西兰白兔,约3~4月,体质量2.5~3.5 kg,由贵州医科大学实验动物中心提供,实验经贵州医科大学附属医院动物伦理委员会批准。
1.1.2主要仪器与试剂 4F血管鞘及穿刺针、2.7F同轴微导管购于日本Terumo公司,外科手术器械盒、陆眠宁Ⅱ由贵州医科大学附属医院提供, GE signa ExciteⅡ1.5T超导型磁共振成像仪、AW4.1工作站购于美国GE Healthcare公司,64排螺旋CT购于荷兰Philips公司,钆喷酸葡胺注射液、碘海醇购于中国上海GE医疗公司,HE染色试剂盒购于广州晶欣生物科技有限公司,CD31抗体、免疫组化试剂盒购于丹麦Dako公司。
1.2 方法
1.2.1VX2肿瘤组织制备 随机选择2只兔在麻醉状态下,将VX2细胞悬液0.2 mL注射到兔双后肢外侧肌肉中;植入3周后,肿瘤增长到直径约3 cm,对兔子实施安乐死,在无菌条件下暴露并剥离位于后肢外侧深部肌肉内的VX2肿瘤组织,仔细剔除肿瘤组织周围的肌肉、血管及筋膜组织,用0.9%生理盐水反复冲洗肿瘤中心坏死组织,留取瘤块周围生长旺盛半透明鱼肉样、富有弹性的、活性较高的VX2肿瘤组织,将肿瘤组织剪成大小约1 mm3的瘤块碎片,进行接种。
1.2.2肝脏VX2肿瘤模型的建立 待接种的实验兔术前常规禁饮食8 h,提前做好中上腹部脱毛、备皮准备;待麻醉起效后,将实验兔仰卧位固定于操作台,严格按照外科无菌操作步骤常规消毒术区皮肤,在CT引导下利用3D打印模板上孔洞进行经皮肝穿刺,将16G的针刺入16只健康兔肝左叶实质中,并注入0.2 mL碘海醇确认针尖避开了肝内血管与胆管;植入1 mm3VX2肿瘤组织,在确认无误后用注入纤维蛋白胶1 mL,封堵穿刺通道以固定VX2肿瘤片段,拔出针头用明胶海绵轻轻按压穿刺处3 min,以防VX2肿瘤外溢及穿刺通道的出血。术后连续3 d给予青霉素40万单位肌肉注射。
1.2.3CT与MRI检测 分别在影像检查前禁食12 h和禁水6 h,CT采用平扫与增强扫描结合,观察肿瘤种植情况及大小。先平扫定位,后序贯动态三期增强扫描,采集时间分别为动脉期(15 s)、静脉期(25 s)和延迟期(45 s)。造影剂选用碘海醇,采用高压注射器设定0.5 L/s的速率注射纯造影剂5 mL。设置扫描参数:管电压120 kV,管电流106 mA。MRI采用平扫与增强扫描结合,在植入后第14天所有模型兔应用带有单独的与SENSE兼容的体部相控阵线圈(人类膝盖线圈,上海晨光医疗技术有限公司),共由8个单元组成在配有SENSE软件的Ingenia3.0T数字化MR扫描机上进行DWI(轴向)和MRI(T1WI和T2WI,轴向)检测,使用毛巾包裹模型兔的腹部,以减少呼吸运动伪影。所有的检查都以相同的参数进行,方案如下:T2-TSE成像参数[重复时间(time of repetition, TR) 1 129 ms, 回波时间(time of echo, TE) 80 ms,时间(time, T)17 s,重建体素(reconstruction voxel, REC voxel) 0.78/0.78/4.00 mm,翻转角(flip angle, FA) 125 deg,视野(field of view, FOV) 400 mm×330 mm;层数,轴位15层,层厚(slice thickness, ST) 4.0 mm,层间距(slice gap, SG) 0 mm,信号平均次数(number of signal averaged, NSA) 1]、T1-TFE成像参数[TR/TE为10/2.3,T为14 s,REC Voxel为0.93/0.93/4.00 mm,FA为15 deg,FOV为400 mm×330 mm;层数,轴位15层,ST为4.0 mm,SG为0 mm,NSA为1]、DWI的参数[TR/TE为749/70, T为36 s,REC Voxel为1.25/125/4.00 mm,FA为90 deg,FOV为400 mm ×330 mm;层数,轴位15层,ST为4.0 mm,SG为0 mm,NSA为1]。在完成T1、T2前5次基线测量后,使用自动注射器(Mallinckrodt,C1213D005X1ml)以马根维显1 mL即钆喷酸葡胺(Gd-DTPA约0.2 mmol / kg体质量)通过左右耳静脉以2 mL/ s的剂量推注,进行DCE-MRI,在静脉注射造影剂(contrast agent,CA)之前和之后依次采集组织的磁共振图像进行DCE-MRI图像分析。将获得的DCE-MRI图像发送到Tissue-4D工作站(Toft模型),从而导出以下参数:(1)体积转移常数K(K volume transfer constant, Ktrans)为造影剂从血管内到血管与细胞之间间隙(extravascular extracellular space,EES)的传输速率;(2)回流速率常数(return rate constant, Kep)为造影剂从EES到血管内腔的的体积;(3)容积分数(fraction by volume, Ve)为间接代表组织中细胞密度,Ve=Ktrans/Kep;(4)初始1 min钆浓度时间曲线下面积(area under curve/initial area under the contrast concentration versus time curve,iAUC60)表示造影剂的剂量从注射点到60 s时的时间强度曲线(time intensity curve,TIC),由肿瘤血液供应和内皮通透性决定的最常用的半定量参数。在灌注成像上选择肿瘤的最大扫描层面或两个最大相邻层面通过软件获取参数Ktrans、Kep、Ve和iAUC60值。
1.2.4组织观察 在完成CT、MRI检查之后,每只模型兔予以安乐死,然后取出肝脏标本确定肝脏中的肿瘤生长情况,使用苏木精-伊红(HE)染色收集所有肝脏肿瘤进行病理检查。
1.2.5微血管密度(microvessel density,MVD)检测 使用针对CD31的单克隆抗体的常规免疫组织化学方法标记血管内皮细胞,癌细胞间质内有孤立的棕黄色血管内皮细胞、细胞簇或血管腔面积<8个红细胞,且管壁无肌层代表1条单独的微血管。先在低倍镜下找肿瘤组织内MVD最高区域,然后在200倍视野下计数3个视野内的微血管数,再将总数除以3,取其平均值作为肿瘤该视野下的MVD。
1.3 统计学分析
2 结果
2.1 肝脏VX2肿瘤模型的建立
从2只兔后肢接种VX2肿瘤细胞处获取VX2肿瘤组织,接种于剩余16只兔的肝脏中,肝脏移植瘤种植术后动物进食量减少、饮水量增多,2~3 d后逐渐恢复术前饮食状况,活动及二便基本正常;在植入过程中未观察到动物死亡和感染。
2.2 CT检查
于种植术后第14天行肝癌CT平扫,16只兔均接种成功,肿瘤均位于肝左外叶,且每只兔均只有一个病灶;接种后第14天,肿瘤平均大小为1.9 cm×1.1 cm,表现为低或等密度结节或肿块影,与周围正常肝实质边缘欠清(图1);增强扫描,动脉期肿瘤明显强化呈环形高密度影,门脉期肿瘤密度降低至等密度,边缘及正常的肝实质增强,静脉期表现为肿瘤密度低于正常肝实质(图2)。
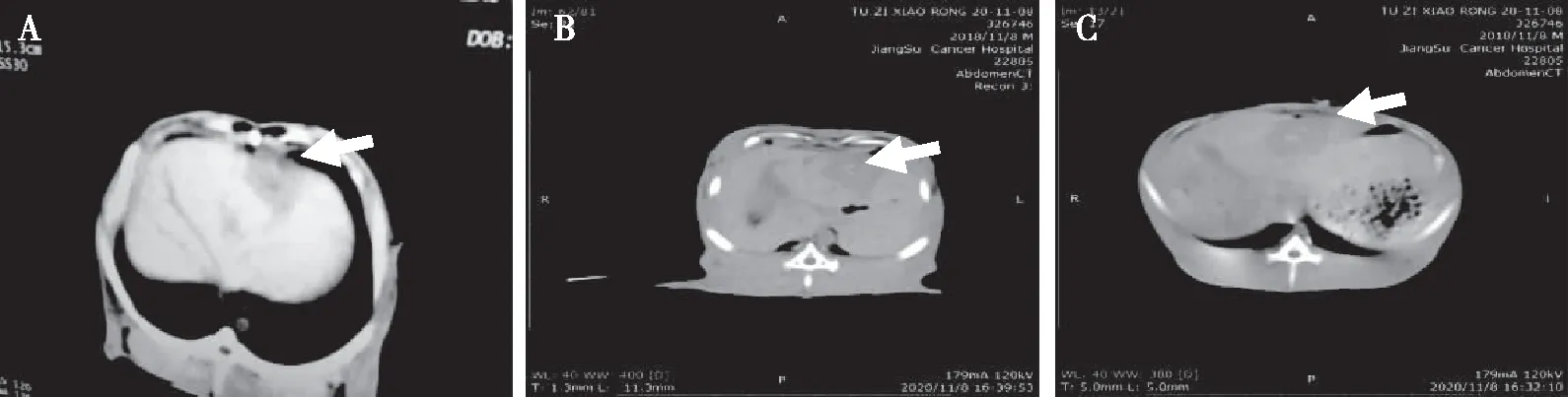
注:A为左肝低密度肿块,B和C为等密度肿块。

注:A为动脉期,B为门脉期,C为静脉期。
2.3 MRI检查
种植术后第14天行肝癌MRI检查,结果显示兔肝左叶肿瘤在T1W图像为低信号,T2W图像和DW图像为高信号。增强MRI显示兔肝左叶肿瘤呈边缘环状强化影,可在静脉注射造影剂之前和之后依次采集组织的磁共振图像进行DCE-MRI图像分析,获取参数Ktrans、Kep、Ve和iAUC60值。见图3和图4。

注:A为轴向T1W图,B为轴向T2W图,C为DW图(b为800 s/mm2),D为冠向T2W图。

注:A为肿瘤轴向T1W图,B为轴向T2W图,C为冠向T2W图,D为轴向DW图(b为800 s/mm2)。
2.4 肿瘤组织观察
肉眼可见肝内直径约1.5 cm的灰白色、鱼肉样结节,与正常肝组织分界清楚,呈圆形、质硬(图5)。HE染色:肿瘤组织中毛细血管多,结缔组织少;肿瘤细胞形态多样、体积大、排列不规则,呈巢状分布;细胞核明显不均一、胞核大且深染,提示肝内VX2肿瘤接种成功(图6~8)。

注:A为肝脏及移植瘤,B为肝脏移植瘤。

注:A为200×,B为400×。
2.5 MVD
显微镜观察结果显示,兔肿瘤组织中染成棕色具有管腔的内皮细胞簇形成微血管或不具有管腔的内皮细胞簇的内皮细胞,见图7。16只兔子肝VX2肿瘤中平均MVD为(23.858±2.115)个/视野。
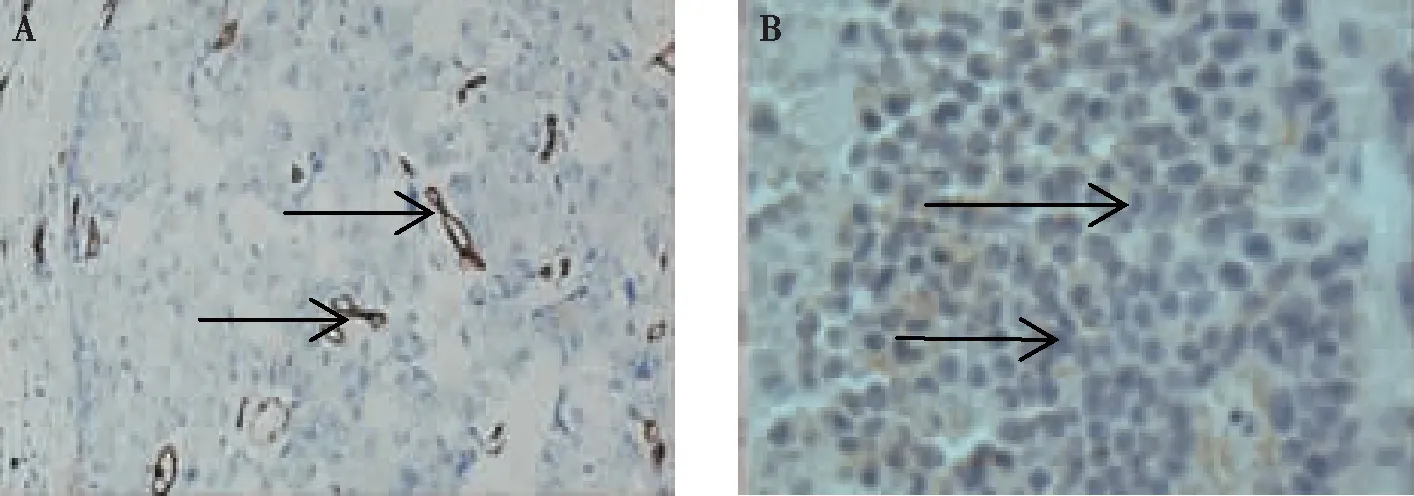
注:A箭头处为微血管管腔(100×),B箭头处为内皮细胞簇(400×)。
2.6 Ktrans、Kep、Ve、 iAUC60与MVD的相关性
Ktrans和iAUC60与MVD正相关(Ktrans:r=0.545,P=0.029; iAUC60:r=0.553,P=0.026),而Kep和Ve与MVD不相关(Kep:r=0.048,P=0.059;Ve:r=0.297,P=0.265)。见表1和图8。
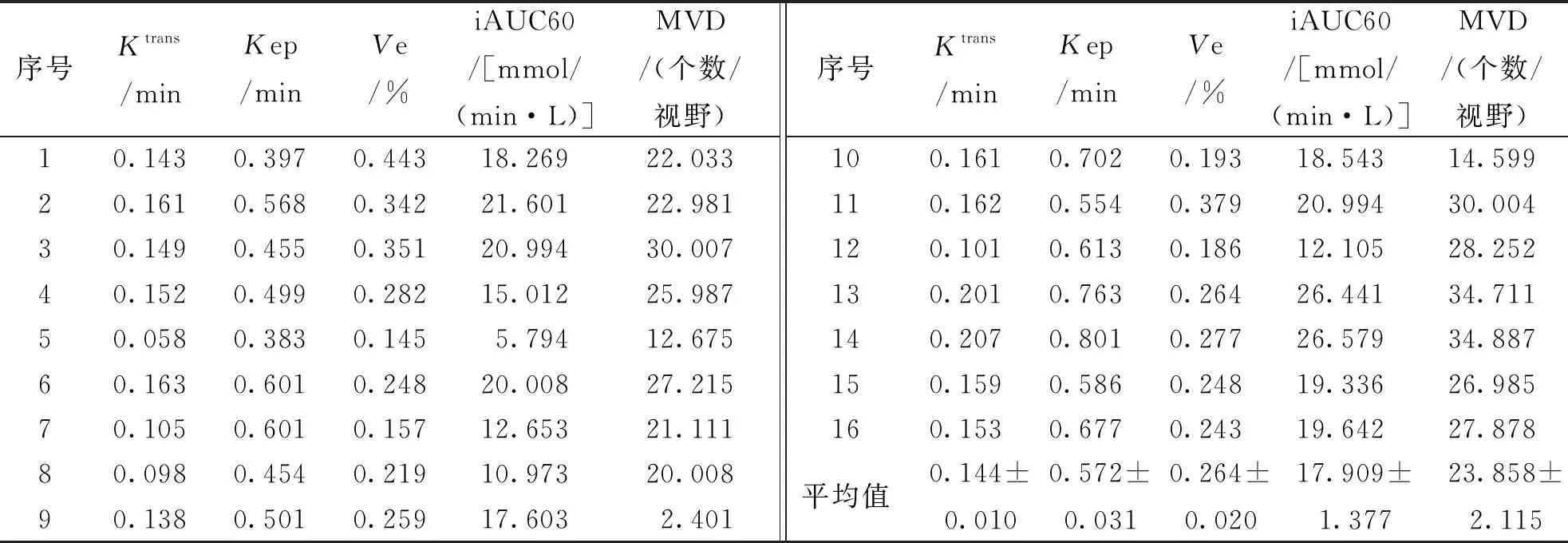
表1 兔肿瘤组织Ktrans、Kep、Ve、iAUC60及MVD

注:A为Ktrans与MVD的相关性,B为Kep与MVD的相关性,C为Ve与MVD的相关性,D为 iAUC60与MVD的相关性。
3 讨论
本研究通过3D打印模板改进CT引导经皮穿刺将活性VX2肿瘤组织碎片植入家兔的肝脏,接种2周后行CT、MRI检测及肝组织病理检查验证模型建立情况,结果显示16只兔肝脏内均成功接种VX2肿瘤,兔成瘤位置精准,成功率100%。穿刺靶点设在左叶中部位置,并注入碘海醇0.2 mL确认针尖避开胆管和血管系统,无大血管损伤及胆瘘发生。植入肿瘤后再用纤维蛋白胶1 mL注入封堵针道,以防VX2肿瘤外溢及误入肝窦与肝内小血管中,拔出针头用明胶海绵轻轻按压穿刺处3 min,以避免异位种植发生。均该模型成功建立可以为肝癌的影像学诊断和治疗研究提供很好的平台。
兔肝癌接种模型较多,从接种途径角度可分为开腹直接接种法与影像引导经皮穿刺接种法,前者因创伤大、并发症多以及易种植转移而逐渐被后者取代[2,4]。目前影像引导主要有CT与超声两种手段[5]。本研究结果表明,CT引导下经皮穿刺将活性VX2肿瘤组织碎片植入家兔肝脏并用纤维蛋白胶注入封堵针道方法优点有:精准引导、简单易行,可减少对肝脏的伤害,缩短手术时间,降低死亡率及开腹与常规影像引导的穿刺并发症,减少腹腔种植、腹壁浸润,从而大大提高模型建立的成功率。但此操作也存在不便之处,如CT无法实施超声引导下实时监测进针路径、实时调整针尖位置功能,也无法提供彩超操作的实时动态图像,相比之下,操作更为复杂[6]。本研究所得数据结果表明该改进对更精准的构建兔VX2肝肿瘤模型有利,具有一定推广意义。如在本研究基础上与超声引导进行前瞻性对比研究,或许能进一步改良兔VX2肝肿瘤模型的建立方法,对肝细胞癌研究的意义深远。兔VX2肝癌通常在VX2肿瘤组织植入后第14天表现出最佳的肿瘤生存力,而没有明显的坏死。因此,本研究中的所有模型兔均在手术后第14天进行MRI检测,以确保肝脏中肿瘤结节的形成。
CT增强是用于检查肝占位的一种有效手段,接种后2周左右时可见边界清楚的低密度结节,增强造影可观察到动脉早期明显强化,门静脉期呈较低密度与周围肝组织分界较清楚,3周以上瘤灶大多出现明显坏死。本研究也发现所有VX2肿瘤2周左右时均表现出相同的增强模式:首先显示出肿瘤外围区域的增强,并且由于坏死而观察到弱的肿瘤内增强。尽管如此,对于小肝癌的诊断MR成像明显优于CT[7],在进行多序列、多方位、多角度显示时,CT增强检测不如MRI增强灵敏、精准、全面。本研究结果还显示肝癌在核磁T1加权上显示低信号,T2加权稍高信号,增强后瘤灶呈边缘环状强化。
近年来灌注成像以评估肿瘤血管生成的非侵入性和可重复性成像方法已经引起了广泛的关注,DCE-MRI作为一种灌注成像,可用于评估射频、微波、冷冻等各种局部肿瘤消融及抗血管生成药物和血管破坏疗法的疗效[8-9],可惜的是目前有关兔VX2动物模型中对DCE-MRI参数和MVD之间关系研究报道较少。本研究结果显示采用DCE-MRI灌注成像技术可大大提高1cm左右瘤灶的检出率,DCE-MRI的参数(Ktransand iAUC60)和MVD之间的显著相关,与既往的研究结果相似[10]。DCE-MRI参数可以提供有关血管血液灌注和血管通透性的功能性信息,这些信息广泛用于评估肝肿瘤患者抗血管治疗,并作为影像学生物标志物来预测治疗效果和生存率[11-12]。众所周知,肿瘤血管生成的主要介质是血管内皮生长因子(VEGF),VEGF和MVD表达之间呈正相关[13-14],因此,病理学家通常使用MVD计数来说明微环境的变化,而MVD表达以CD31的表达来显示[15]。但应用病理上MVD计数方法在临床及诸多实验中无法应用,因此人们一直在寻求通过无创的成像技术检测微环境的变化。已证明MRI是一种用于获取有关肿瘤微脉管系统信息的非侵入性和非电离方法,它提供了多种获取血管信息的方法,MRI方法包括动脉自旋标记,动态磁化率对比MRI,血液氧合水平依赖性成像和DCE-MRI[16-17],其中,DCE-MRI是一种提供血管信息的体内成像方法,已成为临床前和临床研究的重要工具[11,18]。基于CA的首过效应在T2加权DCE-MRI效果是瞬间的,因此获取的图像单一,这在肝脏研究中价值有限;相比之下,T1加权DCE-MRI通常能在更长的时间内测量组织中CA的积累,可以依时间变化采集组织上T1加权信号强度的演化曲线,因此,T1加权DCE-MRI技术更常用于肝癌研究。
Tissue-4D软件基于Toft的单输入两室药代动力学模型,该模型描述了造影剂在血浆和血管外细胞外区室之间的运输,并估计了血浆和EES之间的Ktrans,EES和血浆之间的Kep以及EES的Ve。同时计算出来自浓度-时间曲线的半定量参数iAUC60,对血管生成及微循环中血流状况进行简单而可靠的估计,并可较容易地进行比较研究[19]。本研究之所以选择该模型,是因为VX2肝肿瘤从肝动脉获得大量血液供应,并且血液分布在血浆和EES两个腔室中。
本研究的实验结果提示Ktransand iAUC60有望以无创方式评估肿瘤血管生成,但这一结论还有待进一步研究。(1)MVD测量是一种定量的形态学指标,受ROI的限制,不能反映组织微脉管系统的所有功能特性,包括DCE-MRI测量的通透性。(2)DCE-MRI中分析的参数与MVD计数之间的成像和病理学不完全匹配。(3)在有限数量的动物模型中存在潜在的偏倚,病理与MRI表现之间的相关性需要进一步研究。(4)动脉输入功能的参数是为人体设计的Tissue-4D软件(SIEMENS)的内置数据,因此当使用它来评估实验兔的数据时仍然存在系统错误。
总之,简单而有效的用纤维蛋白胶通过16G鞘管针将肿瘤碎片置入肝脏,显著提高了建模的成功率,并有效减少了并发症的产生,使肿瘤细胞植入后的肝内种植转移概率显著下降,这可能是诱导肝肿瘤的一种有应用前景的有效方法。如此获得的较为理想肝脏VX2肿瘤模型,可通过CT及MRI增强实时且准确地评估肿瘤的血管生成和血流灌注,为诸如敏感药物筛选、药物有效性和毒副作用研究、外科消融、外科手术以及相关肿瘤微环境等相关研究提供平台,对肝癌动物水平上的研究有着重要意义,并对进一步研究提供了新的思路。
