达沙替尼联合干扰素对Raji细胞增殖的作用及机制*
2021-07-02谭大为苏艳丽郑丹郑方童晓丽
谭大为, 苏艳丽, 郑丹, 郑方, 童晓丽
(1.贵州医科大学附属白云医院 血液内科, 贵州 贵阳 550014; 2.贵阳护理职业学院 医学技术系, 贵州 贵阳 550081)
伯基特淋巴瘤(Burkitt's lymphoma,BL)是具有高度侵袭性的非霍奇金淋巴瘤,常发生在淋巴结外的部位,骨髓累及超过25%,其恶性程度极高,细胞倍增周期极短,生长非常迅速,若治疗不及时,患者在数月内死亡[1]。BL发病机制已证实部分与EB病毒(EB virus,EBV)感染相关[2-3],且在临床上观察到,EBV阳性(EBV+)淋巴瘤病例相较于EBV阴性(EBV-)淋巴瘤病例,预后明显较差[4-6];研究发现针对EBV+淋巴瘤诱导EBV进入裂解期的抗病毒治疗,有可能更好地彻底杀灭肿瘤细胞[7-8]。Raji细胞作为BL细胞株,是第1个人类造血系统的连续传代细胞,是淋巴母细胞样、B细胞起源及EBV+的细胞株[9]。干扰素具有抗病毒、抗肿瘤、抑制细胞增殖及免疫调节作用,广泛用于病毒性疾病和恶性肿瘤等疾病的治疗[10-12]。本课题组前期研究发现干扰素能够有效地抑制Raji细胞增殖,并能够上调EB病毒限制性内切酶Ⅰ Z左片段1(EBV BamH Ⅰ Z left fragment 1,BZLF1)和EB病毒限制性内切酶I R左片段1(EBV BamH I R left fragment 1,BRLF1)mRNA的表达[13],但目前临床应用干扰素治疗淋巴瘤仍然未达成共识。达沙替尼为替尼类Abelson(ABL)和Sarcoma(SRC)激酶双重抑制剂,主要用于Breakpoint cluster region(BCR)/ABL+白血病患者的治疗[14],有报道达沙替尼也可抑制多种实体瘤细胞,可作为实体瘤治疗的候选药物[15-17]。因此,本研究通过探讨达沙替尼与干扰素对Raji细胞的效果,为其应用于淋巴瘤特别是EBV+淋巴瘤的临床治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞来源 人BL细胞Raji,购于上海中国科学院细胞库。
1.1.2主要试剂与仪器 RPMI l640培养基、胎牛血清(美国Gibco),细胞增殖检测(cell counting kit-8,CCK8)试剂盒(美国Sigma),细胞周期检测试剂盒(美国BD),达沙替尼(上海蓓琅),干扰素(北京三元),反转录试剂盒(日本Takara),实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)引物、逆转录试剂及qRT-PCR试剂(重庆威斯腾),R反式激活因子(R transactivator,RTA)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(英国Abcam),Z反式激活因子(Z transactivator,ZTA)抗体(美国Santa cruz),羊抗兔免疫球蛋白G(immunoglobulin G,IgG;美国Sigma);多功能酶标仪(美国Thermo Fisher), 实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)仪(美国Applied Biosystems),流式细胞仪(美国BD),垂直板电泳转移装置、Trans-Blot转膜装置及电泳仪(美国Bio-Rad),图像分析系统(美国LabworksTMAnalysis Softwar),Tannon-4200凝胶成像系统(中国天能)。
1.2 方法
1.2.1细胞培养及分组 Raji细胞置于含10%胎牛血清RPMI l640培养基,37 ℃、5%CO2条件下培养,1~2 d换液1次,取对数生长期细胞用于实验。选择0.1、0.5、1.0、5.0、10.0及15.0 μmol/L达沙替尼分别作用Raji细胞12、24及48 h,加CCK8溶液10 μL、孵育4 h,采用酶标仪测定450 nm处的吸光度值(optical delnsity,OD),据各组OD值计算细胞抑制率[细胞抑制率(%)=(OD对照组-OD实验组)/OD对照组×100%],根据各处理条件的抑制率计算半抑制浓度(50% inhibiting concentration,IC50),并选择合适的达沙替尼浓度及作用时间。根据上述实验结果和本课题组前期结果[13]选择干扰素浓度5×106U/L作为联合用药浓度,分为空白对照组(培养过程中不加达沙替尼及干扰素)、单用组(5.0、10.0及15.0 μmol/L达沙替尼)及联用组(5.0、10.0及15.0 μmol/L达沙替尼分别联合5×106U/L干扰素)
1.2.2CCK8法检测细胞增殖活性 取“1.2.1”项下空白对照组、单用组及联用组Raji细胞,孵育24 h,据“1.2.1”中CCK8法计算细胞抑制率。
1.2.3流式细胞术检测细胞周期 取“1.2.1”项下空白对照组、单用组及联用组Raji细胞,孵育24 h,收集细胞;分别加1 mL冰浴预冷70%乙醇,轻轻吹打混匀,4 ℃固定2 h;1 000 r/min离心5 min,沉淀细胞;加冰浴预冷的PBS 1 mL,重悬细胞;1 000 r/min离心5 min沉淀细胞,每管细胞样品中加碘化丙啶(propidium iodide,PI)染色液0.5 mL,重悬细胞,37 ℃避光温浴30 min;采用流式细胞仪于488 nm波长处检测红色荧光。
1.2.4qRT-PCR法检测BZLF1和BRLF1 mRNA的表达 取“1.2.1”项下空白对照组、单用组及联用组Raji细胞,孵育24 h,收集细胞;TRIzol法提取总RNA,将各组总RNA分别加Random 6mers(50 μmol/ L)1 μL、Dntp Mixture(10 mmol/L)1 μL,余用ddH2O补足体积至10 μL,65 ℃、5 min后冰上冷却;每组分别加5×PrimeScript 2 Buffer 4 μL、40 U/ μL RNase lnhibitor 0.5 μL、200 U/μL PrimeScript 2 RTase 1μL,余用ddH2O补足体积至20 μL,缓慢混匀后进行反转录,反应条件为30 ℃ 10 min,42 ℃ 60 min,95 ℃ 5 min,最后冰上冷却;qRT-PCR扩增反应体系为2×PowerUp SYBR Green Master Mix 5 μL、BZLF1或BRLF1 mRNA上下游引物各0.5 μL、核酸模板1 μL、余用ddH2O补足体积至10 μL,扩增条件为50 ℃预变性2 min、95 ℃变性2 min、60 ℃退火1 min、95 ℃延伸15 s,40次循环。BRLF1正、反向引物分别为5-GAAGAAACCAGTCAGGCCGT-3和5′-TGTTGTGGTCAGTTCGTCCA-3′,BZLF1正、反向引物分别为5′-GGGGCTAACCAAGGACAACA-3′和5′-ATTCCTCCAGCGATTCTGGC-3′,内参基因GAPDH正和反向引物分别为5′-AGATCCCTCCAAAATCAAGTGG-3′和5′-GGCAGAGATGATGACCCTTTT-3′。采用相对定量法测定目的基因、内参基因PCR产物的Ct值,以2-ΔΔCt计算目的基因的相对表达量。
1.2.5Western blot检测ZTA和RTA蛋白的表达 取“1.2.1”项下空白对照组、单用组及联用组Raji细胞,孵育24 h,收集细胞并抽提各组细胞总蛋白,测定蛋白浓度,每孔蛋白上样量为20 μg,80 V电压跑过浓缩胶后转换电压至120 V,待溴酚蓝跑至胶板底部时停止,电转印至PVDF膜,5%脱脂牛奶封闭液室温封闭2 h,分别加1 ∶1 000稀释的ZTA、RTA、GAPDH抗体孵育,4 ℃过夜、洗涤,加1 ∶1 000稀释的羊抗兔IgG温育1.5 h、洗涤,ECL曝光液反应2 min,采集图像并进行分析;蛋白条带灰度值经内参校正后,根据灰度值判断目标蛋白的表达情况。
1.3 统计学分析
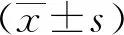
2 结果
2.1 达沙替尼作用浓度的确定
达沙替尼0.1~15.0 μmol/L分别作用于Raji细胞12、24及48 h,0.1 μmol/L达沙替尼作用12 h对Raji细胞即有增殖抑制作用,且随着浓度增加和作用时间延长、抑制作用逐渐增强(r12 h=0.963 7,r24 h=0.966 4,r48 h=0.901 8,P<0.05);达沙替尼作用12、24及48 h的IC50浓度分别为18.2 、10.6及7.8 μmol/L。考虑药物浓度和细胞培养周期,故后续实验分别以5.0、10.0及15.0 μmol/L作为单用组的达沙替尼浓度,联用组则为达沙替尼5.0、10.0及15.0 μmol/L分别与干扰素5×106U/L联合应用,各组作用Raji细胞24 h后检测相关指标。见图1。

注:(1)与同浓度12 h组比较,P<0.05;(2)与同浓度24 h组比较,P<0.05;(3)与同时点0.1 μmol/L达沙替尼组比较,P<0.05;(4)与同时点0.5 μmol/L达沙替尼组比较,P<0.05;(5)与同时点1.0 μmol/L达沙替尼组比较,P<0.05;(6)与同时点5.0 μmol/L达沙替尼组比较,P<0.05;(7)与同时点10.0 μmol/L达沙替尼组比较,P<0.05。
2.2 细胞增殖活性
5.0、10.0及15.0 μmol/L达沙替尼单用组Raji细胞处理24 h后细胞增殖抑制效应呈浓度依赖性(r=0.991 8,P<0.05);各浓度达沙替尼联用组Raji细胞处理24 h后,随着达沙替尼浓度增加,细胞增殖抑制作用增强(r=0.982 7,P<0.05);各浓度达沙替尼联用组Raji细胞的抑制作用分别均比单用组增强,差异均有统计学意义(P<0.05)。见表1。
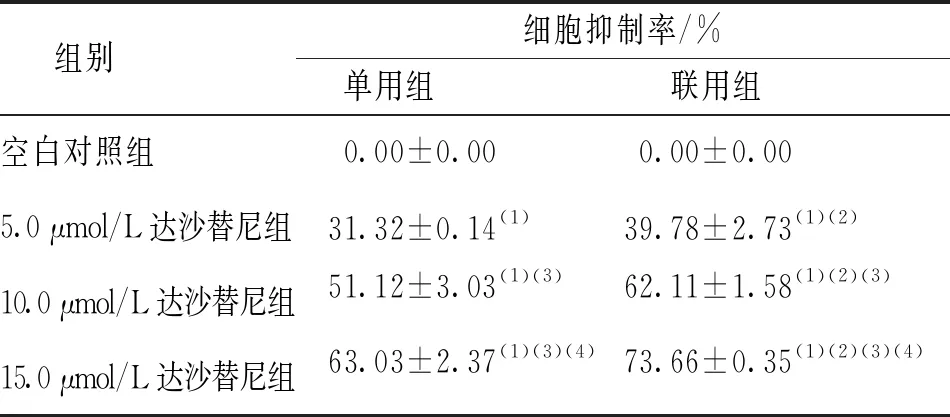
表1 各浓度达沙替尼单用组和联用组Raji细胞抑制率
2.3 细胞周期
流式细胞技术检测结果显示,单用组Raji细胞随着达沙替尼浓度增大,S期细胞比例减少(r=-0.982 3,P<0.05),G2/M期细胞比例增多(r=0.951 6,P<0.05),即增殖周期的细胞减少,G2/M阻滞,Raji细胞的增殖被达沙替尼抑制;随着达沙替尼浓度增大,联用组Raji细胞中S期细胞比例减少(r=-0.990 4,P<0.05),G2/M期细胞比例增多(r=0.945 8,P<0.05),细胞增殖被抑制,且被抑制的程度明显比单用组强(P<0.05)。见图2和表2。
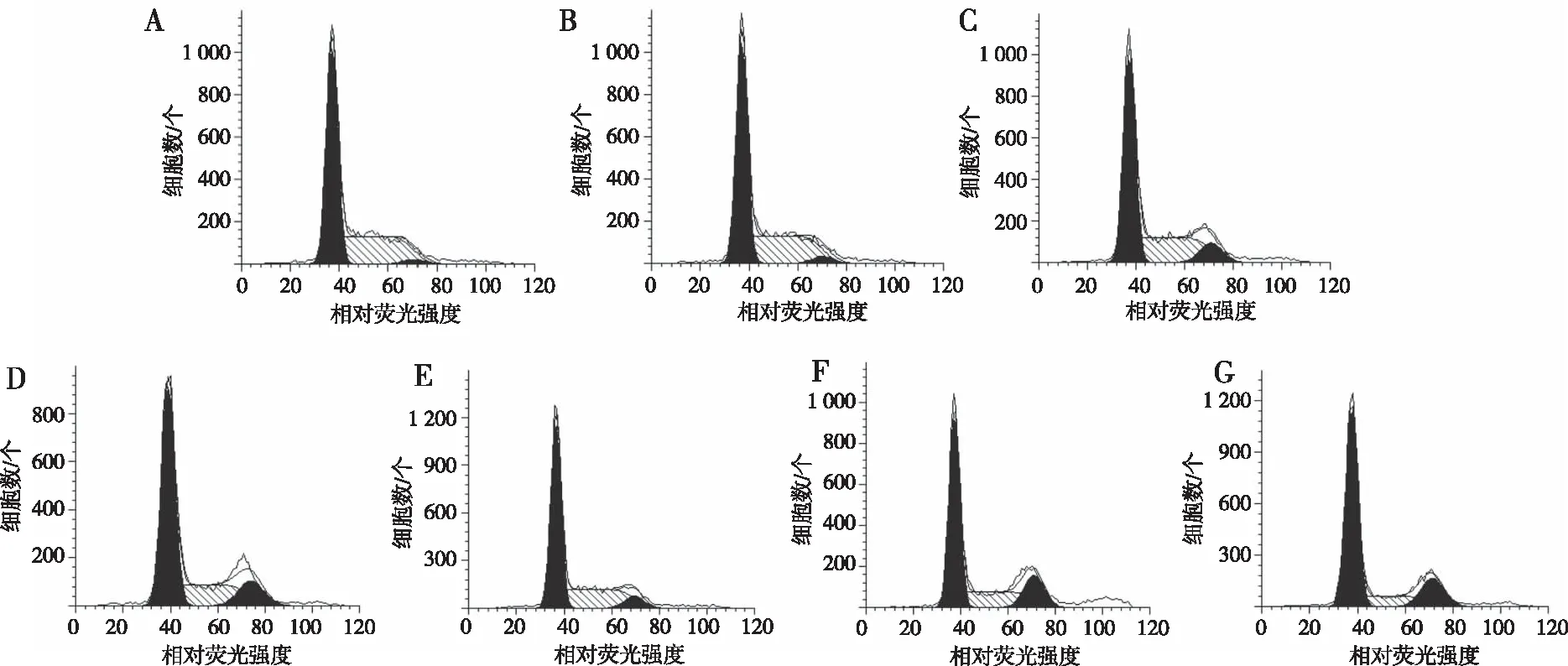
注:A为空白对照组,B~D分别为5.0、10.0及15.0 μmol/L达沙替尼单用组,E~G分别为5.0、10.0及15.0 μmol/L达沙替尼与5×106 U/L干扰素联用组。

表2 各组Raji细胞的各期细胞比例
2.4 BZLF1和BRLF1基因的表达
各组细胞分别经药物处理24 h后,与空白对照组相比,各单用组Raji细胞均能上调BZLF1、BRLF1 mRNA的表达(rBZLF1=0.852 4,rBRLF1=0.834 6,P<0.05);各联用组Raji细胞BZLF1、BRLF1 mRNA的表达均上调,且随着药物浓度的增加,BZLF1、BRLF1 mRNA的表达增加(rBZLF1=0.953 5,rBRLF1=0.917 2,P<0.05),各联用组对BZLF1、BRLF1 mRNA的上调作用强于同浓度单用组(P<0.05)。见表3。

表3 各组Raji细胞BZLF1和BRLF1 mRNA的相对表达量
2.5 ZTA和RTA蛋白表达
Western blot检测结果可见,空白对照组Raji细胞中ZTA和RTA蛋白无表达;各单用组Raji细胞中ZTA、RTA蛋白有表达,且随着药物浓度的增加,ZTA和RTA蛋白表达增加(rZTA=0.841 7,rRTA=0.953 2,P<0.05);各联用组Raji细胞中ZTA和RTA蛋白有表达,且随着达沙替尼浓度的增加,ZTA和RTA蛋白的表达增加(rZTA=0.990 2,rRTA=0.953 8,P<0.05);联用组对ZTA、RTA蛋白表达的上调作用强于同浓度达沙替尼单用组(P<0.05)。见图3和表4。
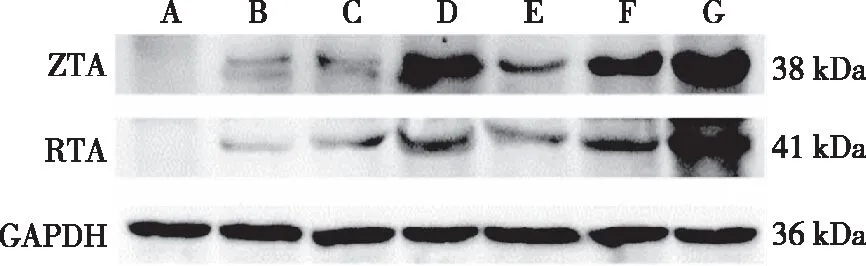
注:A为空白对照组,B~D分别为5.0、10.0及15.0 μmol/L达沙替尼单用组,E~G分别为5.0、10.0及15.0 μmol/L达沙替尼与5×106 U/L联用组。
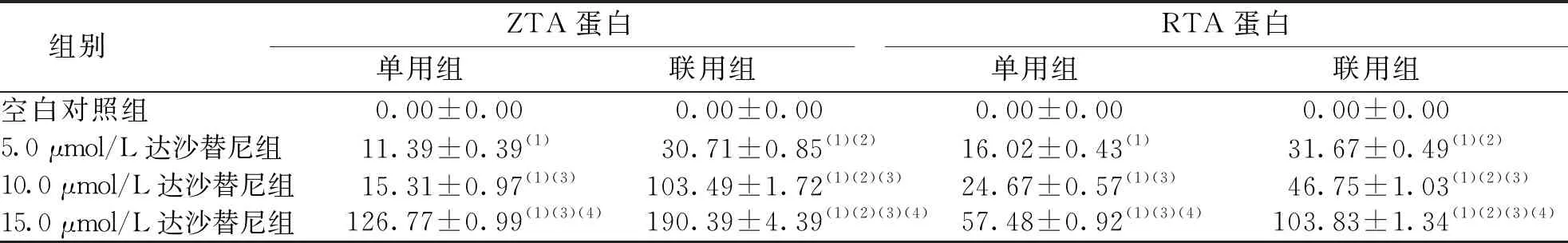
表4 各组Raji细胞的RTA和ZTA蛋白表达
3 讨论
酪氨酸激酶与肿瘤的发生和发展密切相关,酪氨酸激酶活性过高会导致下游信号途径激活,从而引起细胞转化、增殖、抗凋亡及促生存,最终形成肿瘤[18]。因此,酪氨酸激酶抑制剂是肿瘤治疗药物研发的一个热点。达沙替尼作为第2代BCR-ABL酪氨酸激酶抑制剂,是一种Src家族的淋巴细胞酪氨酸激酶(lymphocyte cell kinase,LCK)抑制剂,具有ABL和SRC激酶双重抑制作用,对SFK家族等多种激酶亦有抑制作用,可抑制下游目标基因的自动磷酸化,从而发挥抗肿瘤作用,是常用的慢性髓细胞白血病(chronic myeloid leukemia,CML)的靶向药物之一[19-21]。目前也观察到其对皮肤、乳腺、骨、肺、结肠及前列腺等部位的实体瘤也有抑制作用,能够抑制肿瘤细胞的酪氨酸激酶活性,破坏肿瘤细胞的信号传导,抑制肿瘤细胞增殖和新生血管形成,从而抑制肿瘤的生长[22-23]。本研究结果显示,达沙替尼对Raji细胞亦有增殖抑制作用,与对其他肿瘤细胞的作用相似。将达沙替尼单用或与干扰素联用处理Raji细胞,研究它们对细胞增殖及细胞周期的影响,结果发现达沙替尼能有效抑制细胞增殖且呈浓度依赖关系,且药物处理后S期细胞比例减少,G2/M阻滞,与细胞增殖受抑制相符。而达沙替尼与干扰素联用后细胞增殖抑制率提高,S期细胞比例减少及G2/M阻滞水平亦较达沙替尼单用时明显提高。结果显示,达沙替尼与干扰素之间具有明显的协同作用,这提示对于BL而言,联合应用达沙替尼和干扰素可能会有较好的疗效。
EBV感染有潜伏期和裂解期两种状态[7]。目前,临床常用阿昔洛韦和更昔洛韦等嘌呤核苷类似物抗病毒药物来治疗EBV感染,这类药物进入细胞后需要在病毒编码的激酶作用下三磷酸化,才能形成有活性的形式[24-25]。但是,处于潜伏期的EBV+淋巴瘤细胞不表达病毒编码的激酶,因此这类抗病毒药物在EBV+淋巴瘤中不能取得很好的抗病毒效果[7]。诱导EBV进入裂解期的始动基因有BZLF1和BRLF1这两种基因,裂解期复制的起始很大程度上依赖于BZLF1和BRLF1基因的表达[26]。BZLF1和BRLF1基因的翻译产物ZTA和RTA蛋白是EBV进入裂解期的关键蛋白,可作为基因转录的反式作用子引导病毒基因表达期的级联反应[27]。有研究表明,ZTA和RTA蛋白的表达能够促使Raji细胞进入S期[28],但也有研究发现,在药物作用下能减少Raji细胞的S期细胞比例,但同时上调BZLF1及BRLF1 mRNA的表达[29]。在本研究中,达沙替尼单用或与干扰素联用均能降低S期细胞比例,同时上调Raji细胞BZLF1和BRLF1 mRNA表达,促进ZTA和RTA蛋白的产生,与前述研究的后者相印证。有研究发现,ZTA和RTA蛋白的表达能够使细胞增殖阻滞在G2/M期[30-31],本研究的成果与之相符。另有文献报道,单纯疱疹病毒进入裂解期可阻断细胞进入S期[32-33],本研究的结果亦与之相似。在EBV感染导致的肿瘤细胞内,潜伏期基因通过激活细胞周期进程导致细胞无限增殖[34]。但当EB病毒被激活进入裂解期,立早基因BZLF1和BRLF1开始表达,基因产物ZTA、RTA蛋白可诱导细胞周期停滞[33-34]。
综上所述,本研究中,达沙替尼单用或联合干扰素均能抑制Raji细胞的增殖,这种抑制可能是通过干扰细胞周期,阻断Raji细胞进入S期并发生G2/M阻滞而发生的;达沙替尼单用或与干扰素联用能上调Raji细胞中BZLF1、BRLF1 mRNA和ZTA、RTA蛋白的表达,表明能够促使EBV+淋巴瘤中的EBV进入裂解期,这可能是干扰细胞周期从而抑制细胞生长的机制之一。因此,本研究有理由认为达沙替尼能够有效地抑制Raji细胞增殖,与干扰素联合使用效果更加显著,二者联用有可能为EBV+淋巴瘤临床治疗开辟一条新途径。
