大伙房水库细菌群落结构及其环境驱动因子研究
2021-06-30邵缨迪尹东鹏王美儒邹京京杨凤山
邵缨迪, 赵 文*, 尹东鹏, 王美儒, 邹京京, 杨凤山, 徐 锋, 王 欢
(1.大连海洋大学水产与生命学院 辽宁省水生生物学重点实验室,辽宁 大连 116023;2.辽宁润中供水有限责任公司,辽宁 沈阳 110166;3.辽宁省大伙房渔业有限责任公司,辽宁 抚顺 113003)
微生物作为水域生态系统极其重要的生物因子,除可作为重要的饵料资源外,还对水环境的变化具有较高的敏感性,如微生物种类、数量及产物均可反映水质的好坏[1-2],此外,还具有降解污染物、净化水体的功能。所以微生物群落结构及多样性与水质状况联系密切[3-5],在淡水水域生态系统中发挥了无可替代的作用[6]。因此,了解水体中微生物的群落分布特征具有重要意义,一方面可以用于阐明微生物群落与其生境的关系,另一方面可以对污染系统实施有效的生物修复措施[7]。然而在自然环境中,仅有1%的细菌类群可能通过传统的分离培养方法获得,人类对微生物菌群的认知仍然较少[8-9],虽然关于水库水体微生物群落分布特征的研究已有一些报道[10-11],但目前对水库微生物结构季节性变化特征的研究报道相对较少。因此,研究微生物群落结构的多样性,以及随着不同季节的变化差异具有重要意义,可以使人们更全面地了解以及评估生态环境[12]。大伙房水库不仅用于供水,还可以进行灌溉、养鱼、发电以及防洪[13-14]。截止2018年11月,大伙房水库输水工程已累计向7座城市和大型企业安全稳定供水40×108m3,占部分城市市政供水量的90%以上,有力地保障了居民的生活用水和经济社会的可持续发展[15]。由于大伙房水库肩负着饮用水安全以及社会发展的重任,其水质保护显得尤为重要。然而,由于近些年水库上游的矿业发展及各大小工厂的兴起,造成工业废水的流入[16],同时水库周边人们生活中大量使用农药、化肥、洗涤剂产生的废液,对大伙房水库整体流域也造成一定污染[17-18],因此,了解水库微生物细菌群落结构和多样性变化及其与环境因子的关系,可为水库生态功能研究提供参考,对促进水库水环境质量的改善也将起到重要作用[11]。本研究旨在为探究大伙房水库微生物多样性特点,为大伙房水库的生态环境提供有力的安全保障。
1 材料与方法
1.1 材料
1.1.1 样品采集地 水样采自辽宁抚顺大伙房水库现场,位于辽河支流、浑河中上游和抚顺市东郊浑河中游,汇集浑河、苏子河、杜河水源于一处。
1.1.2 仪器与设备 水生80型采水器;SHZ-D(Ⅲ)型循环水式多用真空泵(购自河南省予华仪器有限公司)用于水样抽滤,HQ30d型便携式多参数水质分析仪(购自美国Hach公司)用于现场测定,孔径0.45 μm的微孔滤膜(购自上海兴亚净化材料厂)。
1.2 方法
1.2.1 采样时间及站位设置 2015年5月至2016年4月,对大伙房水库4个季度进行水样采集,根据水库实际地形,设置6个断面、16个采样站位:上游浑河入河口采样站位用字母A1、A2表示,苏子河入河口采样站位用字母B1、B2表示;中游采样站位用字母C1、C2、C3表示;中下游采样站位用字母D1、D2、D3表示;下游坝前采样站位用字母E1、E2、E3表示,社河大沟采样站位用字母F1、F2、F3表示。水表、中、底共采样10次后混合,将所有样品密封在无菌容器中,送回实验室进行抽滤,微孔膜过滤后放入冷冻管中并添加DNA保存溶液,-80 ℃保存。调查范围及站位设置见图1。
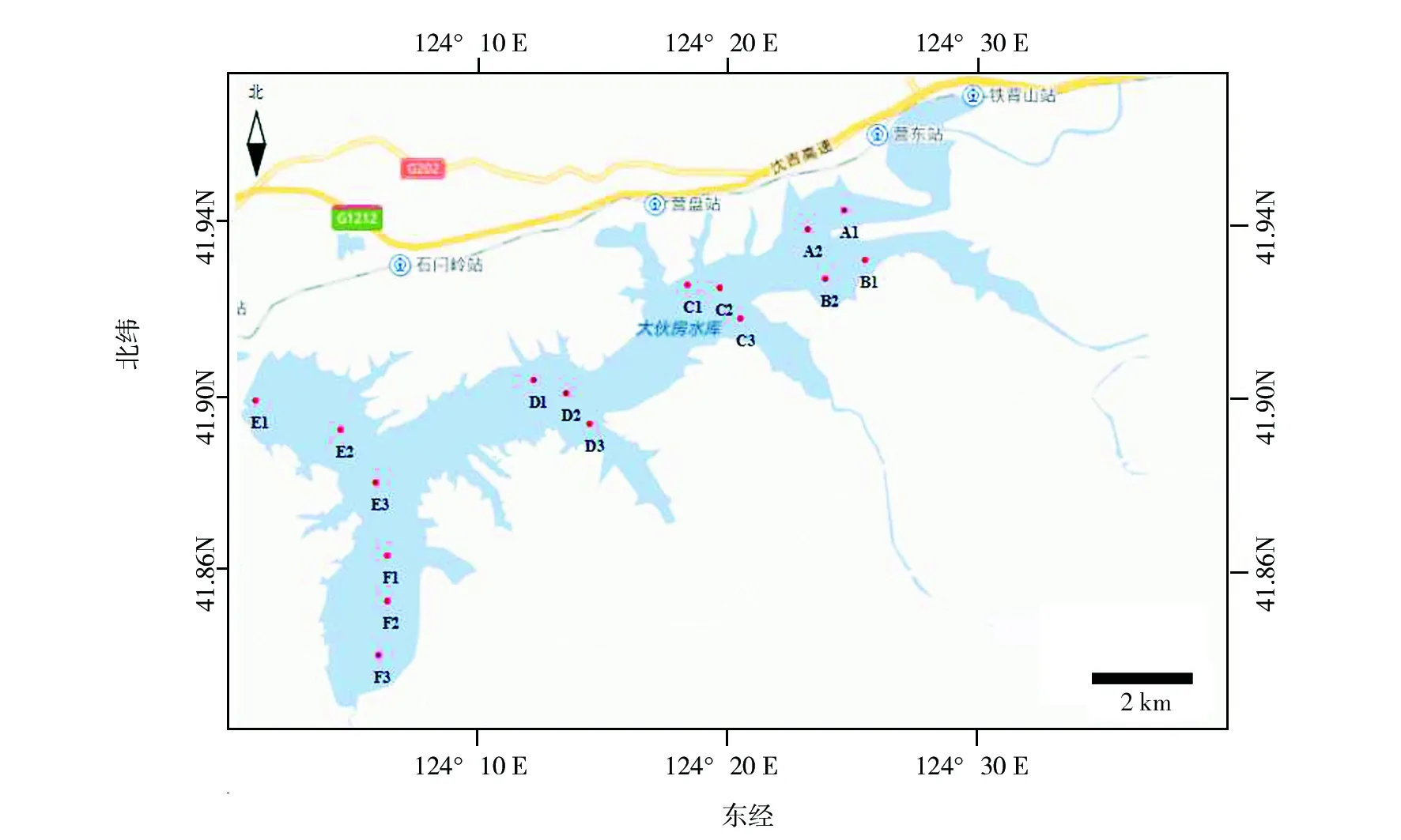
图1 大伙房水库采样站位Fig.1 Sampling station in Dahuofang Reservoir
1.2.2 样品名称设置 采集64个样品名称如图2横坐标所示,Ya1.1表示春季在A1站位采集的样品;Ya1.2表示夏季在A1站位采集的样品;Ya1.3表示秋季在A1站位采集的样品;Ya1.4表示冬季在A1站位采集的样品,以此类推。组别名称如图3横坐标所示,将上游入河口A1、A2、B1、B2站位归为1组用ab表示;C1、C2、C3站位归为1组用c表示;D1、D2、D3站位归为1组用d表示;E1、E2、E3站位归为1组用e表示;F1、F2、F3站位归为1组用f表示,如Yab1、Yab2、Yab3、Yab4 分别表示上游入河口在春、夏、秋、冬4个季节样品组别的各自名称,以此类推。

1.2.4 基因组DNA提取及16S rDNA PCR扩增 大伙房水库水样中的基因组DNA参照CTAB方法对其进行提取。16S rDNA PCR扩增条件:98 ℃预变性1 min; 98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,72 ℃ 5 min, 30个循环。之后凝胶回收。文库构建和上机测序以及测序数据处理等均由北京诺禾致源生物信息科技有限公司完成。
1.2.5 统计分析 使用Excel进行水体理化指标参数计算并分析,使用Qiime软件(Version 1.7.0)进行样品的Shannon-Wiener指数计算。使用CANOCO for window4.5进行CCA分析,并结合环境因素分析样品间的物种组成差异。
2 结果与分析
2.1 大伙房水库的细菌多样性分析
64个样品的细菌16S rDNA V4区的高通量测序共得到有效序列3 547 147个序列标签,平均数为55 424,平均长度为253.375 bp。97%相似性水平上进行聚类,平均聚成1 459个OTUs。对各样本中OTU多样性进行分析,利用Shannon-Wiener指数表对16个样点的细菌多样性进行比较分析,表1显示全年大伙房水库细菌群落Shannon-Wiener指数平均达7.312,由大到小的季节顺序为秋、春、夏、冬。大伙房水库水生细菌门水平上的物种相对丰度见图2,各样品相对丰度排名前10的细菌类群从高到低分别为变形菌门(Proteobacteria,36.11%)、蓝菌门(Cyanobacteria,27.37%)、拟杆菌门(Bacteroidetes,12.20%)、放线菌门(Actinobacteria,8.81%)、浮霉菌门(Planctomycetes,4.91%)、疣微菌门(Verrucomicrobia,4.36%)、1个未分类菌群(others,3.78%)、酸杆菌亚门(Acidobacteria,1.07%)、厚壁菌门(Firmicutes,0.69%)、绿弯菌门(Chloroflexi,0.46%)和栖热菌门(Thermi,0.24%),变形菌门、蓝菌门、拟杆菌门和放线菌门是大伙房水库水体中4个主要微生物菌群。除在各个分类地位下不明确的菌属外,共发现54门、135纲、220目、279科、412属,其中,优势菌属为Fluviicola(1.17%)、聚球藻属(Synechococcus,1.24%)、黄杆菌属(Flavobacterium,1.19%)、短波单胞菌属(Brevundimonas,1.14%)。春季A1样点最占优势的为变形菌门,占该样品总序列数的58.59%,A2样点最占优势的为变形菌门和蓝菌门,分别占该样本总序列数的35.04%和30.57%;B1样点蓝菌门占33.23%,变形菌门占31.81%;B2样点蓝菌门占22.32%,变形菌门占45.83%;C1样点蓝菌门占43.83%,变形菌门占30.06%;C2样点蓝菌门占13.23%,变形菌门占56.63%;C3样点蓝菌门占19.25%,变形菌门占47.16%;D1样点蓝菌门占18.38%,变形菌门占44.61%;D2样点蓝菌门占16.21%,变形菌门占46.25%;D3样点蓝菌门占10.89%,变形菌门占51.81%,拟杆菌门占15.36%;E1样点蓝菌门占16.17%,变形菌门占37.93%;E2样点蓝菌门占16.61%,变形菌门占42.74%;E3样点蓝菌门占17.17%,变形菌门占45.19%;F1样点蓝菌门占19.46%,变形菌门占42.66%;F2样点蓝菌门占26.51%,变形菌门占37.01%;F3样点蓝菌门占21.42%,变形菌门占43.19%。进一步分析表明,在春季除了C1样点中变形菌门所占比例小于蓝菌门所占比例,其他样点均为变形菌门所占比例大于蓝菌门。夏季、秋季和冬季,蓝菌门在各样点的比例增加明显,变形菌门在各样点的比例减少,拟杆菌门在各样点的比例增加。
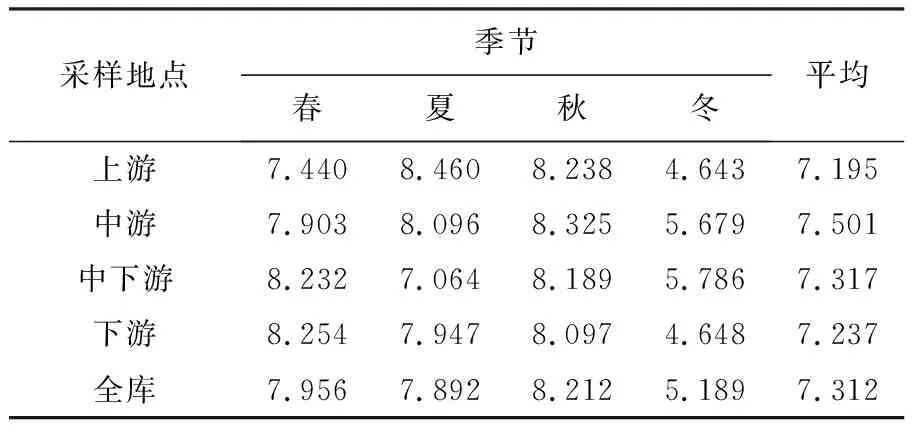
表1 大伙房水库细菌多样性指数

图2 大伙房水库微生物门水平上的物种相对丰度Fig.2 Relative abundance of species at microbial phylum level in Dahuofang Reservoir
在属水平上,选取排名前35的物种注释及丰度信息,从物种及样品组两个方面聚类,绘制成如图3的热图,并使用不同的颜色指示主要分类单元聚类的含量。发现4个季节这几个采样点在菌群结构组成上存在一定的差异,结果显示这四个季节中,春季和夏季菌群结构组成差异不大,夏季D点位的细菌种类明显增多,而秋季和冬季种群种类明显减少,说明不同季节的大伙房水库水体中微生物群落结构差异较大。夏季聚球藻属(Synechococcus)、不动杆菌属(Acinetobacter)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、链球菌属(Streptococcus)、红杆菌属(Rhodobacter)、异常球菌属(Deinococcus)、柄杆菌属(Caulobacter)、芽单胞菌属(Gemmatimonas)、短波单胞菌属(Brevundimonas)聚集较多;秋季涅瓦河菌属(Nevskia)、鲁丹内拉菌属(Rudanella)、芽单胞菌属(Blastomonas)、浮霉菌属(Planctomyces)、原绿发藻属(Prochlorothrix)、丰佑菌属(Opitutus)、拟柱孢藻属(Cylindrospermopsis)、假鱼腥藻属(Pseudanabaena)、多核杆菌属(Polynucleobacter)、古字状菌属(Runella)聚集较多;冬季黄杆菌属(Flavobacterium)、流感病毒(Fluviicola)、铁细菌属(Crenothrix)、假单胞菌属(Pseudomonas)聚集多;春季吞菌弧菌属(Peredibacter)、枝动菌属(Mycoplana)、墨氏菌属(Rheinheimera)、红长命菌属(Rubrivivax)聚集多。
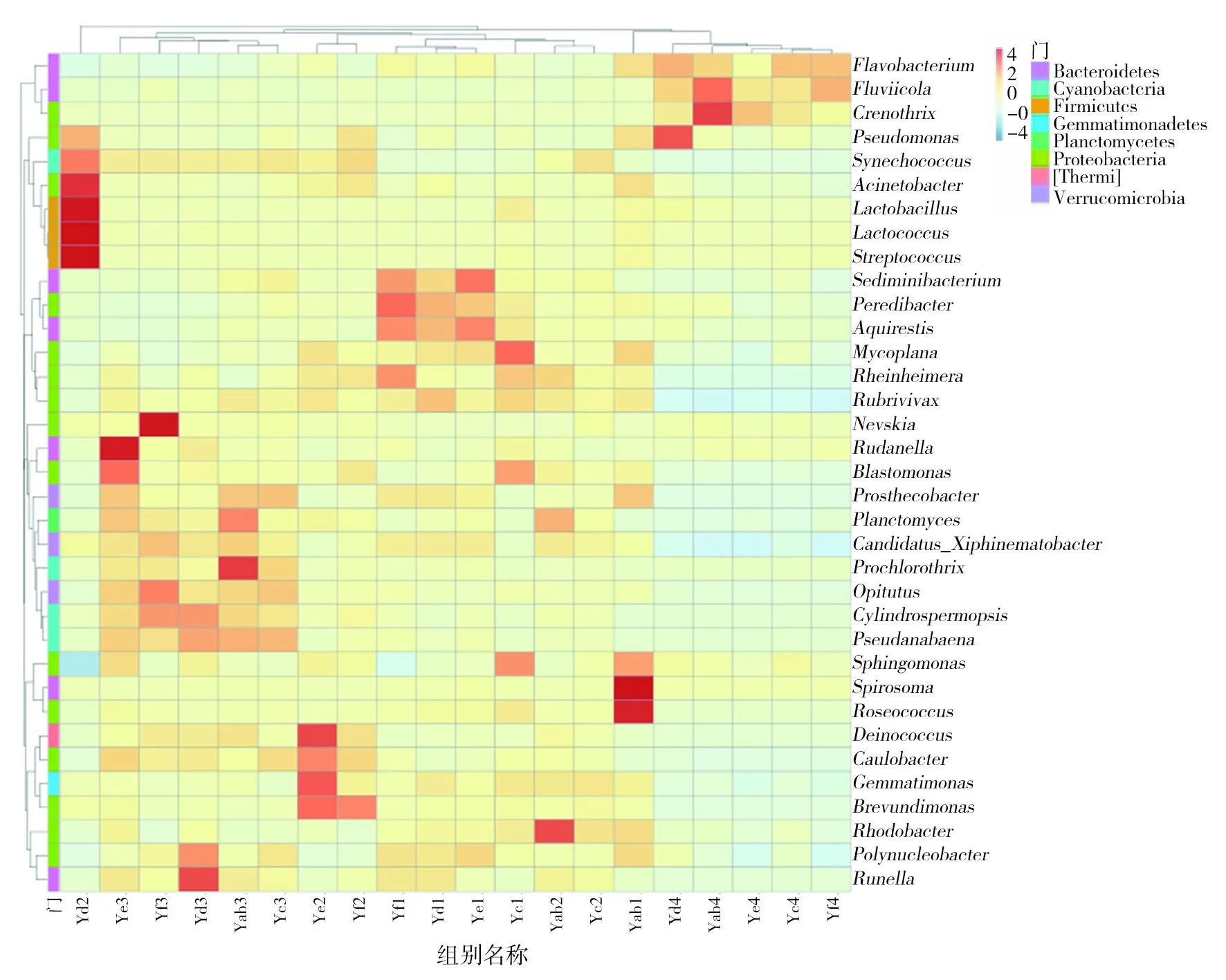
图3 细菌物种丰度聚类Fig.3 Bacterial species abundance clustering
2.2 微生物群落与环境因子之间的关系

图4 大伙房水库细菌VPA结果Fig.4 VPA results of bacteria in Dahuofang Reservoir


图5 大伙房水库细菌菌群与水体理化因子的CCA 分析Fig.5 CCA analysis of bacterial community and physical and chemical factors
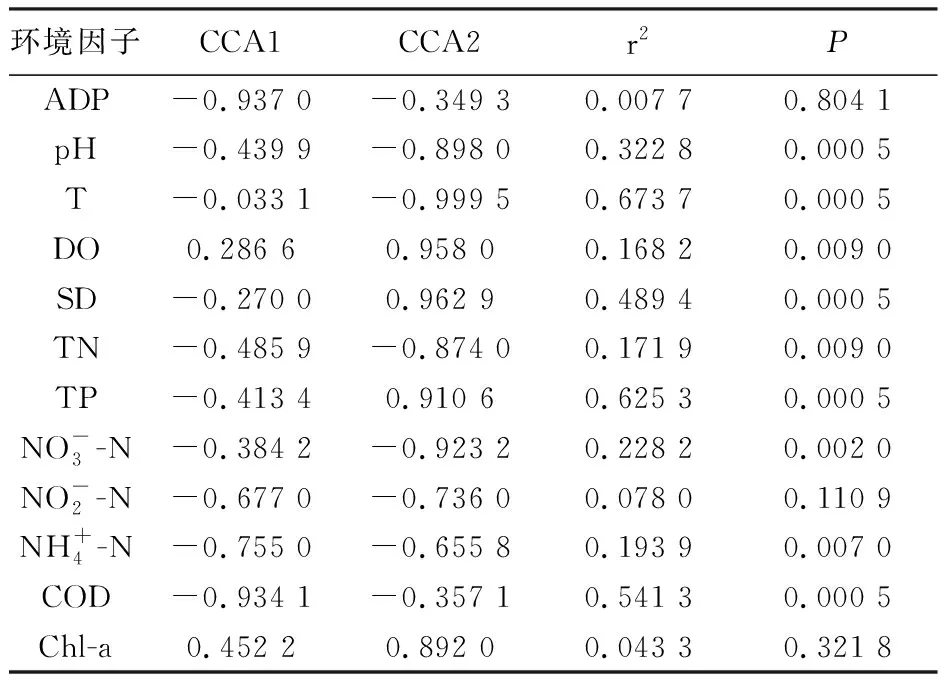
表2 水库细菌与环境因子的CCA envfit分析
2.3 环境因子与微生物物种丰度
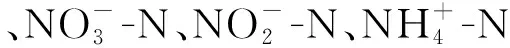
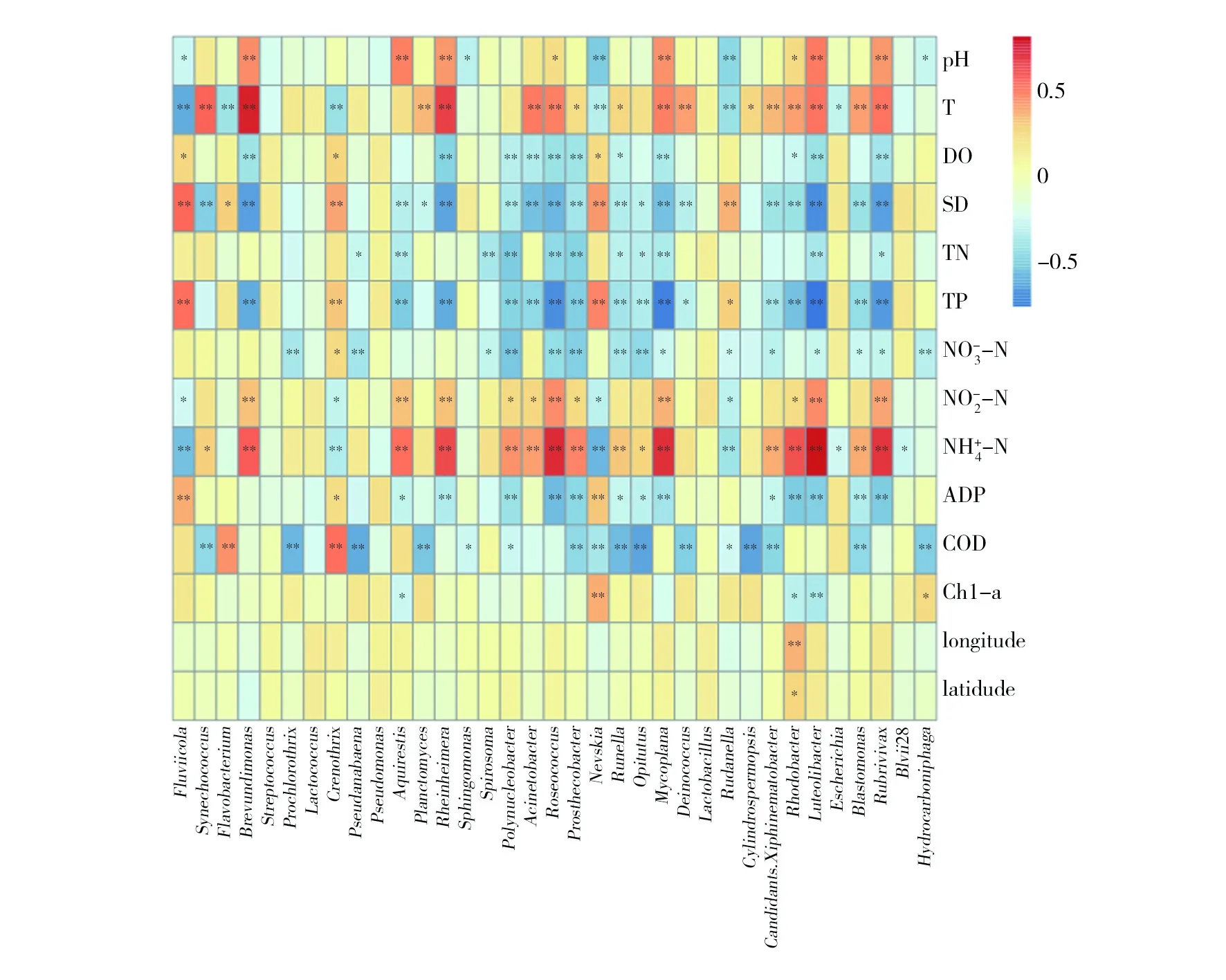
图6 大伙房水库细菌与环境因子的Spearman相关性分析Fig.6 Spearman correlation analysis of bacteria and environmental factors in Dahuofang Reservoir
2.4 大伙房水库不同样品差异基因分析
基于OTU水平的无度量多维标定法(Non-Metric Multi-Dimensional Scaling,NMDS)分析(图7),stress值为0.084表明结果稳定,具参考价值,从全年结果来看,冬季所有样本与其他3个季节所有样本中微生物组成差异性显著,春季的上游点位微生物与同季节其他点位微生物构成差异大,春季(除上游点位)与夏季和秋季各点位之间的距离较近表示差异性小。LDA的进化分支(LDA Effect Size)显示样品组间存在丰度差异显著的物种,由图8可以看出不同样品的差异微生物菌属,以门、纲、目、科、属水平信息表示。春季样品在大伙房水库中下游的门水平上浮霉菌门(Planctomycetes)有显著差异,在属水平上大伙房水库下游腐螺旋菌属(Saprospira)存在显著差异;夏季样品与秋季样品在门水平上上游点位浮霉菌门(Planctomycetes)有显著差异;冬季大伙房水库中游在门水平上放线菌门(Actinobacteria)细菌有显著差异,放线菌门的1个纲Actinomycetales和1个目ACK_M1存在显著差异。
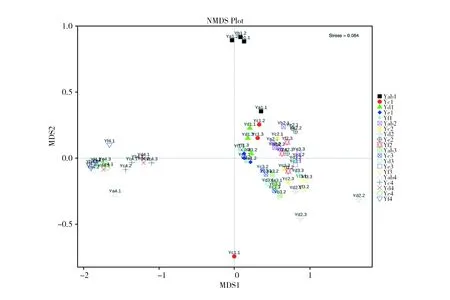
图7 大伙房水库NMDS分析Fig.7 Analysis of NMDS in Dahuofang Reservoir

图8 春(A)、夏(B)、秋(C)、冬(D)大伙房水库LDA的进化分支Fig.8 Spring(A), summer(B),autumn(C),winter (D) evolution of LDA in Dahuofang Reservoir
3讨 论
多样性指数是反映水域生态系统微生物群落结构特征的重要指标,大伙房水库的菌群结构随季节性变化特征是通过16S rDNA扩增子测序方法阐明的,采用Shannon-Wiener指数反映大伙房水库水体微生物的多样性,结果表明Shannon-Wiener指数平均达7.312,与其他水体相比,处于中间水平,且大伙房水库水中微生物多样性指数存在季节变化,这与张雅洁等[20]、沈烽等[21]研究结果相似。出现这样的现象可能是因为水体受不同季节温度的影响,冬季温度低,抑制了水中细菌的代谢,并减慢了生长速度[22],而秋季与夏季温度可能更适合菌群繁殖。排除温度这一影响因素外,秋季有机质丰富也是主要原因,赵海萍等[23]指出10月份的初级生产力影响渤海湾浮游细菌群落结构分布,水体中的浮游植物在秋季大量生长繁殖,且这过程中产生的有机物可作为细菌的主要营养来源之一,所以,细菌能在秋季出现大量繁殖的现象,进而导致其多样性增加。基于OTU的物种分类分析,序列比对结果显示,各样点间、不同季节各个样品的菌群组成在门级上相差不大,但仍具有规律性,在门水平上,优势菌门为变形菌门、蓝菌门和拟杆菌门,这与研究的大多数水体细菌群落结构结果相似,如万甜等[24]研究的渭河流域与张磊等[25]研究的巢湖水体细菌群落结构结果相似。
本研究中丰度排名前十的菌种在不同季节丰度有所不同,蓝藻门在冬季丰度最高为50%,在春夏秋季约为22%;变形菌门在春夏秋季丰度高为45%,冬季丰度为20%;拟杆菌门在冬季丰度高为18%,在秋季丰度低为8%。个别门级中的属种在其他季节丰度较高。如Fluviicola属于拟杆菌门在冬季的丰度高范围在0.03~0.08,在春夏秋季丰度范围在0.003~0.01。蓝细菌聚球藻属属于蓝菌门,在夏季和秋季丰度高(0.02~0.06),在春季较高(0.005~0.008),冬季最低(0.000 1~0.000 4)。黄杆菌属属于拟杆菌门在冬季丰度最高(0.01~0.04),在春夏秋季丰度较低(0.004~0.03)。短波单胞菌属属于变形菌门,在冬季丰度最低(0.000 2~0.000 6),在夏季丰度最高(0.01~0.06)。在大伙房水库中这些优势菌属的丰度较低,微生物种类却非常丰富,可能在其他水域中,部分低丰度菌种在竞争中成为优势种,这些差异可能是由于地理形势上或气候条件等不同的环境因素造成的,也可能是在研究手段或数据采集量上存在差异造成的。
大伙房水库不同样品差异基因分析的结果表明,微生物群落结构在同一季节各采样点之间存在一定的地理差异,在不同季节时存在一定的季节差异,在冬季时最低,秋季最高,春季和夏季微生物群落结构较为相近。
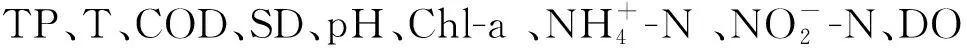
环境因子的变化影响着微生物丰度的变化,本研究揭示了大伙房水库中,各环境因子与各微生物群落丰度的关系。同时发现除红杆菌属(Rhodobacter)与经度和纬度呈显著正相关外,其余各菌群与经度、纬度无显著性差异。这与前面分析的不同季节属水平的丰度结果相符合,聚球藻属(Synechococcus)等细菌富集在夏季,正是因为夏季温度高,适宜生长。Fluviicola等与温度呈显著负相关,所以在冬季聚集。Wu等[38]指出湖泊沉水植物的分布显著影响细菌多样性。而无机氮与可溶解活性磷显著影响俄亥俄河菌群分布[39]。王萃等[40]发现总有机碳影响土壤中氨氧化细菌的分布。综上所述,微生物物种丰度与环境因子存在相关性,具体的相互作用机制尚需进一步探究。本研究运用高通量测序法分析了大伙房水库细菌群落组成与环境因素之间的关系,为大伙房水库水质管理提供参考。
