气球菌的分类及临床感染
2021-06-30周万青谷盼盼
周万青, 谷盼盼, 沈 瀚*
(南京大学医学院附属鼓楼医院 检验科,江苏 南京 210008)
气球菌属(Aerococcus)建立于1953年,随着蛋白水平和分子技术的广泛应用,目前已有8个菌种归属该菌属,分别为绿色气球菌(A.viridans)[1]、脲气球菌(A.urinae)[2]、柯氏气球菌(A.christensenii)[3]、血气球菌(A.sanguinicola)[4]、人脲气球菌(A.urinaehominis)[5]、马脲气球菌(A.urinaeequi)[6]、猪气球菌(A.suis)[7]和阴道气球菌(A.vaginalis)[8]。气球菌属广泛存在于空气、土壤、植物、医疗环境中,是潜在的机会性感染病原菌。由该菌属细菌造成的临床感染报道越来越多[9-10]。而对于其分类学的研究也在不断深入,虽然16S rRNA测序是该菌属不同菌种的鉴别标准,但在某些菌种的鉴别能力上仍存在缺陷[6]。现有的生化鉴定,即便是应用质谱技术仍很难实现菌属内所有菌种的准确鉴定[9-10]。临床微生物检验迫切需要常规的生化鉴定、质谱鉴定技术应用于该类感染病原菌的菌种鉴定。而一直以来的错误鉴定造成该菌属的检出率被低估,使得在临床上对该菌属的关注度不高。因此,本文将从气球菌属的建立过程、各种鉴定技术在菌种鉴定上的优势、临床感染类型、主要菌种的药敏监测数据以及指导临床治疗等方面进行阐述,以期为临床诊断和诊疗提供参考。
1 种属建立及鉴定
自1953年A.viridans菌种建立以来,先后已有8个菌种归属到气球菌属,菌种建立信息见表1。8个模式菌种分离自4种临床患者样本,动物来源样本3种,环境来源样本1种。该菌属的GC含量为37.5%~47.6%,6株模式菌株已获得全基因组测序(whole genome sequencing,WGS)序列。其中6株有相关临床感染报道[10],畜牧养殖业动物也有报道[11-12]。
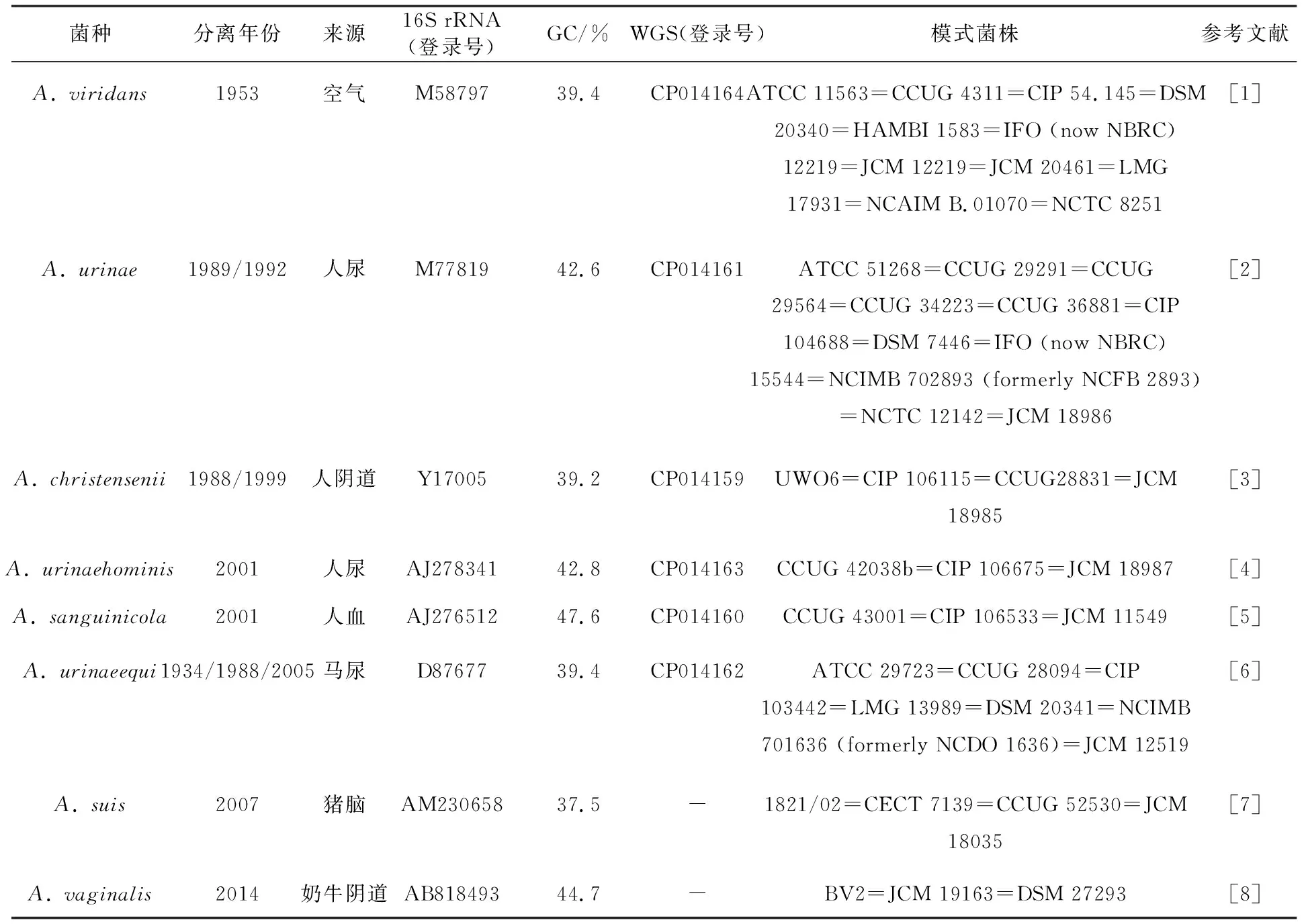
表1 气球菌属菌种的命名
1.1 表型特征
气球菌属在血琼脂平板培养24 h后呈草绿色溶血、半透明的小菌落,与链球菌、肠球菌、片球菌等菌属较难区别;革兰染色显微镜观察可见成双、四联或成簇状革兰阳性球菌,可与上述易混淆菌属鉴别;该菌属触媒阴性、氧化酶阴性,需氧、微需氧条件下,6.5 g/L NaCl均可生长。
1.2 生化鉴定
气球菌属菌种主要通过API、Vitek 2、BBL-Crystal-GP鉴定系统等进行鉴定。在脲气球菌的鉴定上API系统和BBL-Crystal-GP优于Vitek 2系统[9];而上述系统对于绿色气球菌的鉴定结果较多,属内血气球菌也可被鉴定为绿色气球菌[13];本科室分离马脲气球菌经现有API和Vitek 2生化鉴定系统也被鉴定为绿色气球菌[14]。现阶段API 20 Strep和Vitek 2 Compact GP鉴定系统中仅包括绿色气球菌和脲气球菌鉴定数据库,缺乏其他菌种数据。因此,对于商品化鉴定系统在属内菌种的鉴别上还有待数据库的扩充,以实现属内各菌种的准确鉴定。其中亮氨酸氨基肽酶、焦谷氨酸芳酰胺酶在菌属内各菌种的辨别具有重要指向性[1-8],例如绿色气球菌上述2个反应结果为-+,而脲气球菌则为+-,见表2。但现行商品化鉴定系统所采用的模式菌株个别生化反应可能与临床菌株生化反应存在差异,从而也可能造成菌种鉴定的不同。因此对于生化反应为基准的鉴定仍需要其他鉴定技术的验证。
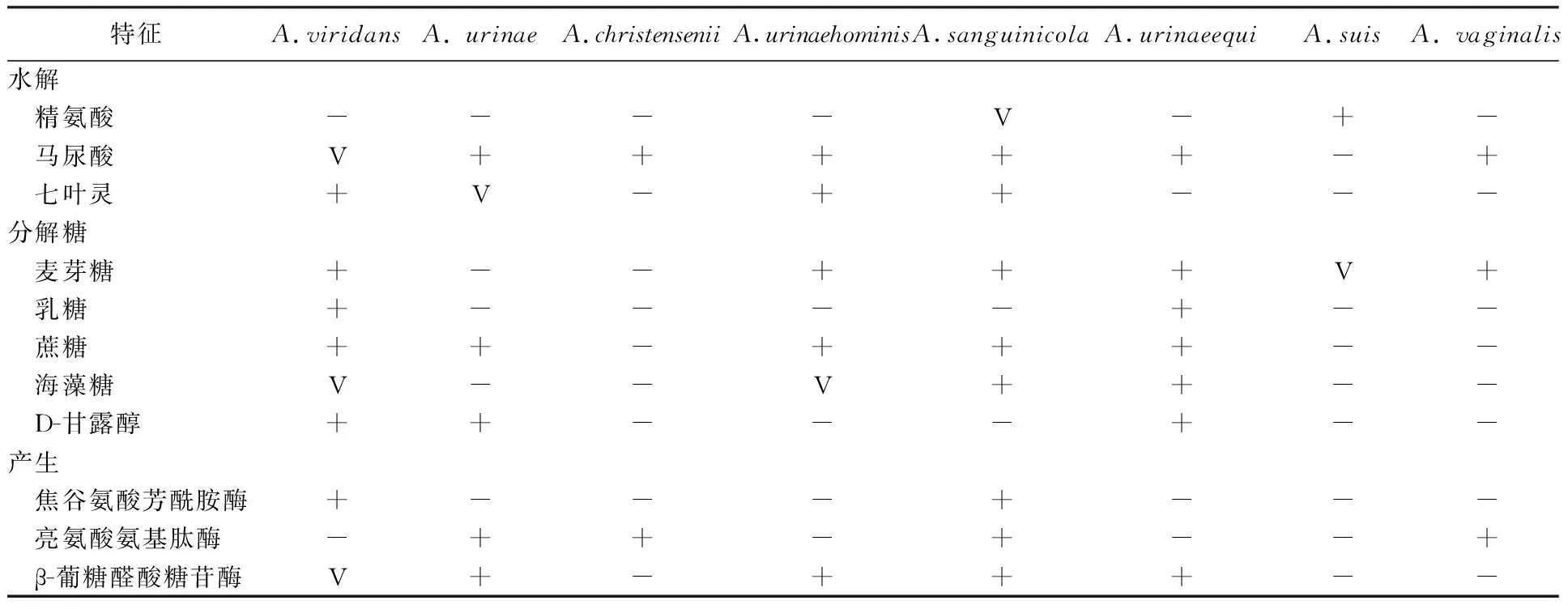
表2 气球菌属菌种主要生化反应[1-8]
1.3 质谱鉴定
蛋白水平的鉴定可规避不同分离株间分解化合物的差异性,在菌种鉴定上具有很好的应用。目前商品化质谱鉴定系统中进口品牌主要为布鲁克和梅里埃,当然也出现了国产品牌。两家进口质谱数据库中均包括绿色气球菌和脲气球菌2个种[15]。据研究显示,布鲁克公司质谱可实现血气球菌的准确鉴定[16]。而由于数据库的缺陷,仍无法实现其他菌种准确鉴定。
1.4 分子鉴定
16S rRNA序列分析一直被认为是细菌菌种鉴定的金标准,但对气球菌属马脲气球菌16S rRNA分析时发现,其与绿色气球菌间存在两个碱基差异[6];而本科室临床分离到的马脲气球菌的核酸序列分析显示,其与绿色气球菌只存在一个碱基的差异[14]。根据临床实验室标准协会(Clinical and Laboratory Standards Insitute,CLSI) MM18文件对于种属的鉴别标准[17],其比对符合率未达到种的鉴别,仅能确定为属水平。因此,16S rRNA在鉴别绿色气球菌和马脲气球菌中有一定的局限。核酸杂交(DNA-DNA hybridization,DDH)是菌种鉴定最为经典的方法,但操作繁琐,一般实验室无法实现。而基于WGS的应用,衍生出很多类似的核酸比对技术,例如平均核酸一致性分析(average nucleotide identity,ANI)技术可实现DDH的鉴别功能[18]。通过对临床分离的马脲气球菌进行ANI分析,更好地确定了临床分离菌株的菌种信息[14]。目前已有6个模式菌株的WGS序列可在网络查询[19],一些临床菌株的WGS序列也在不断地扩充该菌属的WGS数据库[14,20-21]。
2 临床感染
气球菌属可造成人类多个部位感染,临床分离到的常见菌种为脲气球菌、绿色气球菌、血气球菌等,可引起尿路感染、血流感染、心内膜炎、骨和关节感染、软组织感染、脑膜炎、腹膜炎、脓肿等[9-10]。一些菌种也是动物感染的机会病原菌,例如绿色气球菌引起牛乳腺炎、猪关节炎、猪脑膜炎、猪肺炎等[11-12]。在临床感染报道中,常见的为尿路感染和心内膜炎。调查显示,脲气球菌致尿路感染的分离率在0.31%~0.44%,每年其致血流感染率为3人/1 000 000人;血气球菌每年致血流感染率为1.4人/1 000 000人[9-10]。
2.1 尿路感染
大量报道显示气球菌属菌株可引起临床患者尿路感染,确切的感染数量可能因目前的生化等鉴定技术的不足而被低估。因此,仍需提高该类细菌鉴定的准确性。脲气球菌、绿色气球菌、血气球菌等均可造成患者尿路感染[9-10,15,22],老年女性有基础尿路障碍的患者居多。对于一些无症状患者的检出,提示该菌属可能存在一定的定殖,在一定条件下可引起患者的感染[15]。
2.2 感染性心内膜炎
研究发现,气球菌属可引起患者严重的侵袭性感染,其中心内膜炎最为多见。患者年龄一般超过65岁(平均年龄72岁),并伴有基础尿路感染,极少数感染患者的年龄小于42岁[23]。脲气球菌和血气球菌可引起有尿路疾患的老年患者继发性心内膜炎[9,24]。
3 药敏试验及监测数据
2016年之前,检出的气球菌属菌株进行药敏结果判断多以草绿色链球菌的判断折点为依据。随着该类细菌感染检出数量的递增,对该菌属引起感染的认识也逐渐加强 ,基于现有的监测手段和治疗经验,CLSI[25]和欧洲药敏试验联合委员会(The European Commitlee on Antimicrobial Susceptibility Testing,EUCAST)[26]分别在2016年和2017年对其中个别菌种的药敏试验及判断进行了文件规定。CLSI M45-A3文件中对气球菌属3个种(脲气球菌、绿色气球菌和血气球菌)对青霉素、头孢噻肟、头孢曲松、美罗培南、万古霉素、环丙沙星、左氧氟沙星、四环素、复方磺胺、利奈唑胺药物最小抑菌浓度(Minimum inhibitory Concentration,MIC)方法判断折点,需基于添加马血并调节阳离子的MH肉汤培养基进行药敏试验。建议青霉素、头孢曲松和万古霉素为首要检测药物,尤其建议对分离自无菌部位(血液、深部组织),特别对分离自免疫缺陷患者样本中的菌株进行检测。EUCAST文件也在2017年对气球菌属中的血气球菌和脲气球菌进行了折点设定。
临床报道较多的菌种及药敏监测数据显示,绝大多数气球菌对β内酰胺类药物敏感[13,27-34]。例如脲气球菌和血气球菌对青霉素和阿莫西林的MIC50在0.032 g/mL以下;对头孢他定的MIC50在0.25 g/mL以下;对喹诺酮类如左氧氟沙星的MIC50分别在0.5 g/mL和1 g/mL以下;对万古霉素、利奈唑胺敏感;脲气球菌对复方磺胺类药物的MIC存在一定的差异性,可能与药敏试验方法的差异或者培养基成分的差异性有关。虽然大多数菌种对β内酰胺类药物敏感,但在绿色气球菌中已出现青霉素不敏感临床分离报道,需要引起重视。大范围药敏监测数据[13,27-34]见表3和表4。
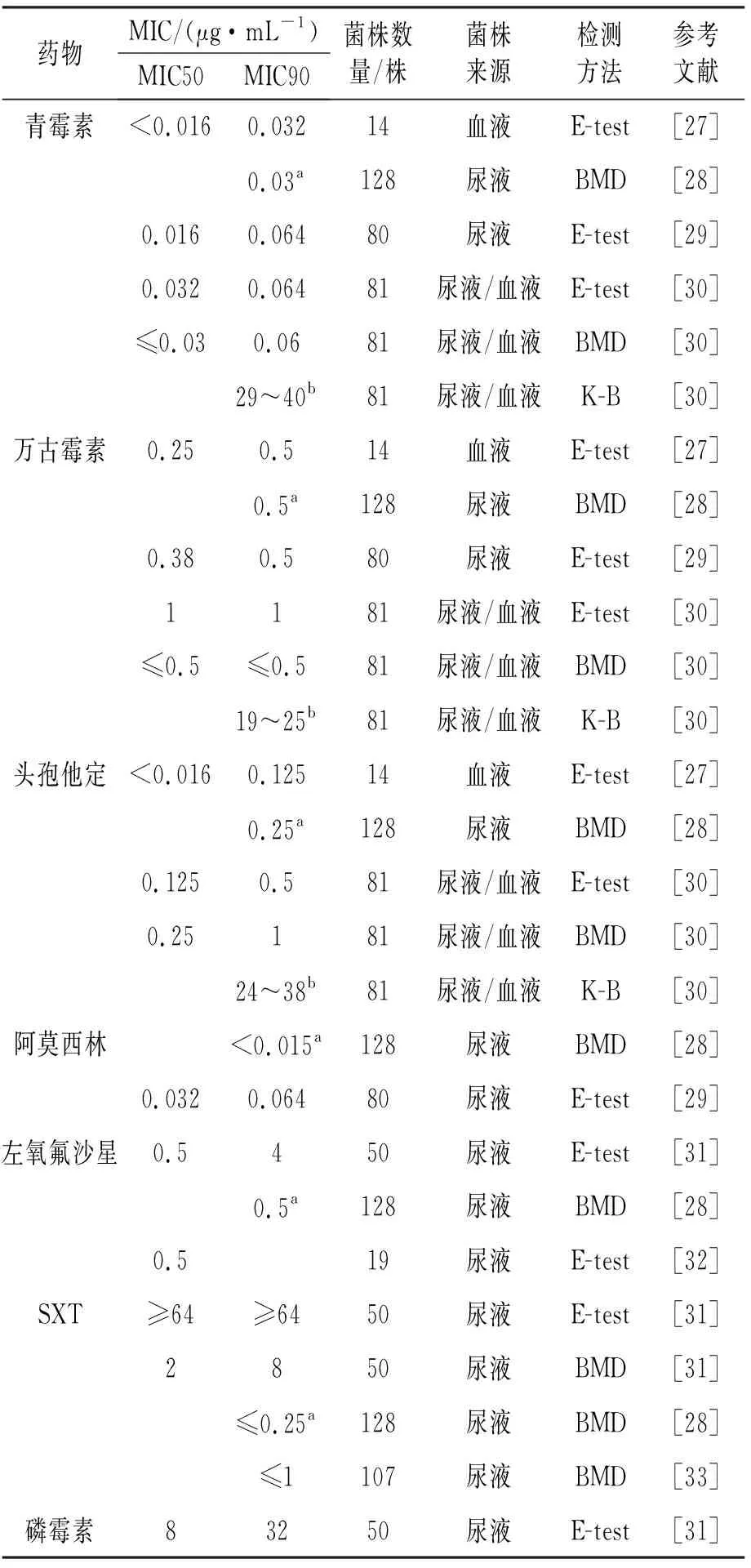
表3 脲气球菌药敏监测数据
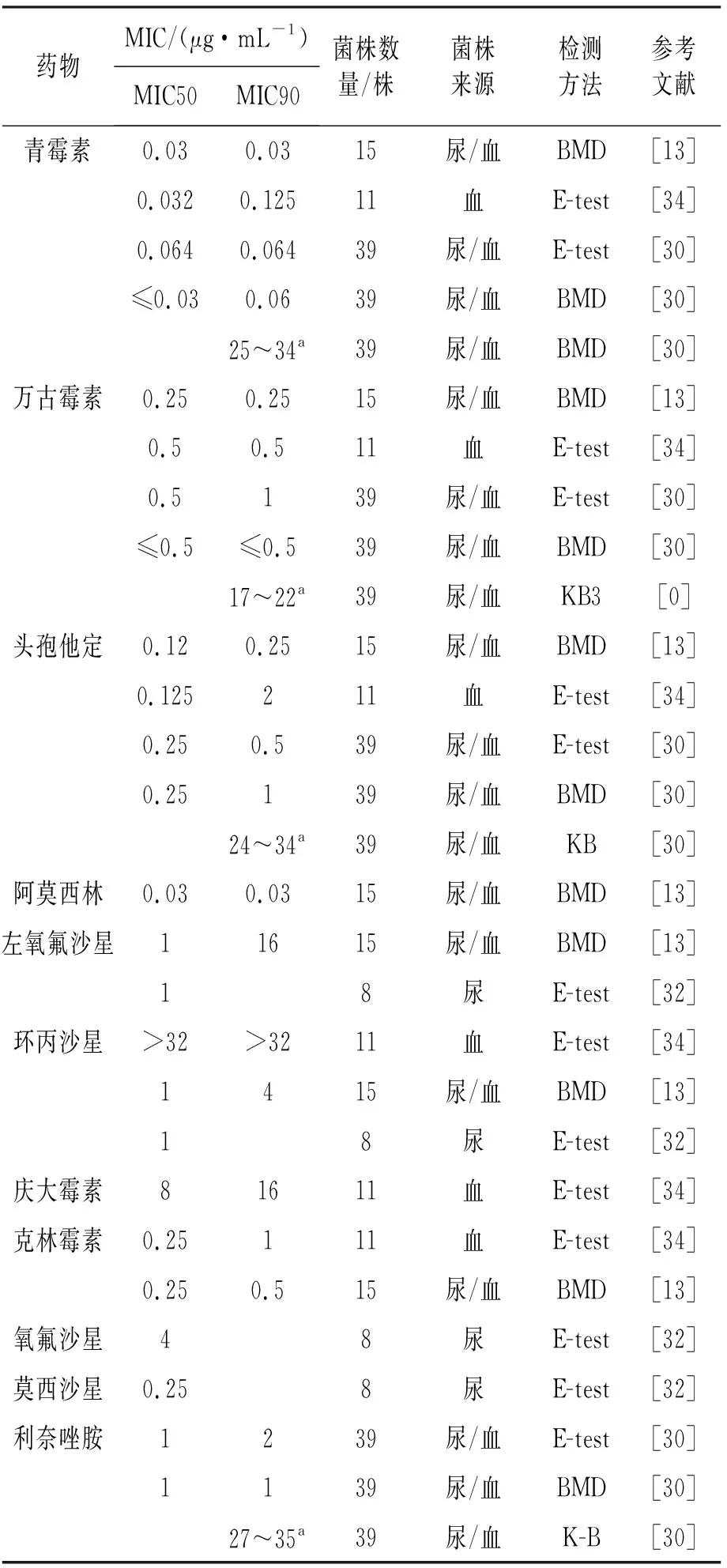
表4 血气球菌药敏监测数据
监测结果表明较多的分离于尿路的脲气球菌和血气球菌,其对喹诺酮类药物的敏感度较高[13,28,31-32],可经验性选用;虽然磷霉素的MIC50为8 g/mL[31],但鉴于该类药物特殊的分布特点仍可选用;对复方磺胺类药物检测结果的差异性[33],可能与检测方法和培养基中的成分有很大关系。提示进行临床药敏试验时,必须采用统一的方法和培养基,这样其结果才具可比性。对于脲气球菌引起的非复杂性尿路感染,呋喃妥因和磷霉素是很好的选择[9,31],对复杂性尿感,可选择阿莫西林和喹诺酮类进行治疗[9]。对血气球菌引起的尿路感染,经验性药物选择不考虑呋喃妥因和磷霉素,阿莫西林可能是较好的选择。上述观点还需要更多的临床数据支持[9]。感染性心内膜炎患者首选药物为青霉素,可联合氨基糖苷类。青霉素联合氨基糖苷无论是体外协同试验还是一些临床治疗结果,均显示具有较好的协同作用[9]。
对气球菌属耐药机制的研究也在不断进行中。例如喹诺酮类耐药基因gyrA、gyrB、gyrC、pacE及突变与菌株耐药相关性研究等[32]。糖肽类抗生素作为革兰阳性球菌的最后防线,同样也适用于气球菌属。一些案例报道万古霉素非敏感气球菌菌种和菌株的检出[11,35]。据推测,上述耐药菌株可能为马脲气球菌。由于马脲气球菌临床感染报道很少,人们对于该菌的认识不足,2005年该菌由马脲片球菌重新归类为马脲气球菌[6],该菌对糖肽类抗生素应为天然耐药,这已经在临床分离菌株中得到证实[14],但还需更多数据的支持。
4 毒力及致病性
造成心内膜炎的病原菌大多可形成生物膜。对心内膜炎患者血流检出的脲气球菌研究显示,该菌可在体外形成生物膜,而且当人类血浆存在时,生物膜形成更为显著[36]。生物膜的形成可有效抵抗抗生素的渗透治疗。研究还显示,这些感染患者一般在之前有导尿管插管经历,因此,导尿管处的细菌定殖或生物膜形成是造成后续血流感染的危险因素[23]。研究发现脲气球菌对人类血小板具有聚集诱导和激活功能,更加验证了感染性心内膜炎患者致病机制中血小板凝集的作用[36]。深入研究显示,脲气球菌可通过补体系统激活、纤维蛋白原和IgG分子依赖的途径激活血小板[36]。相似的研究在血气球菌也有发现[34]。借助WGS的应用,对于菌株毒力基因的研究也在不断深入。通过WGS数据中细菌黏附相关基因预测发现,血气球菌和脲气球菌基因组中均存在一些毒力基因(htpB、lmb、ilpA)[21]。表达荚膜多糖抗原是细菌抵抗免疫吞噬的毒力因子。在绿色气球菌菌株中发现荚膜多糖的存在;相对于无毒力菌株,有毒力的绿色气球菌具有较高水平的Hsp60分子的表达[21]。通过WGS预测比对分析,发现血气球菌和脲气球菌基因组中均存在荚膜多糖抗原成分[21],这对于后续菌株毒力相关研究提出一个全新的研究思路。
5 菌株克隆研究
气球菌菌株克隆研究的技术方法包括16S rRNA序列分析、Rep-PCR技术、RAPD、PFGE技术,以及基于WGS数据的进化分析。采用Rep-PCR技术[37]或PFGE技术[1,38]对临床分离气球菌菌株进行克隆分析,数据显示临床分离菌株具有遗传多样性。因此,提示气球菌造成的临床感染仍为散发性,并未造成克隆播散性感染。
6 展 望
随着临床气球菌的不断分离,以及对于该菌属菌种鉴定技术的不断提升,人们越来越认识到该菌属临床感染的重要性,但由于鉴定技术的不足,急需改善鉴定技术中的缺陷,扩充鉴定数据库使其更加完整,为临床准确鉴定提供支持。更多规范化药敏试验和数据的积累,为更好地指导临床经验性用药至关重要。认识和理解细菌毒力基因及其致病性,为更好地预防和治疗奠定基础,尤其对于气球菌造成的心内膜炎和尿路感染的治疗。全基因组测序技术的应用为上述研究提供精准的基因分析。虽然目前气球菌造成的临床感染为散发性,但仍不可忽视其造成播散性感染的可能。因此,需尽快实现该类菌的准确鉴定并加强药敏监测力度,深入研究其致病机制,为临床诊疗提供数据参考。
