富硒青钱柳-黄精复方降血糖及抗氧化作用的研究
2021-06-25陈丹罗丹白曦晨向极钎樊建元刘卫
陈丹,罗丹,白曦晨,向极钎,樊建元,刘卫,5※
(1.武汉百思凯瑞生物科技有限公司,湖北 武汉 430075;2.华中科技大学生命科学与技术学院,湖北 武汉 430074;3.恩施州农业科学院,湖北 恩施 4450993;4.恩施思慧益臣生态农业发展有限公司,湖北 恩施 445099;5.华中科技大学国家纳米药物工程技术研究中心,湖北 武汉 430075)
糖尿病是临床常见的代谢性疾病。据统计,在我国糖尿病患者人群中,Ⅱ型糖尿病占据糖尿病总人数的90%以上[1]。Ⅱ型糖尿病与机体氧化损伤有着密切关联,Ⅱ型糖尿病患者机体的抗氧化水平显著低于正常人体[2,3]。因此,提高机体抗氧化能力,降低氧化应激损伤可预防或延缓Ⅱ型糖尿病及相关并发症的发生。青钱柳[Cyclocarya paliurus(Batal)Ijinskaja]为我国特有的单种属植物,民间多将其制成茶叶饮用,用于防御疾病。现代药理学研究结果表明,青钱柳具有降血糖、降血脂和抗氧化等功效;另外,青钱柳叶中也含有抗氧化活性的微量元素,如有机锗、硒[4]。硒是人体必需的重要营养元素,是谷胱甘肽过氧化物酶的重要组成部分,可以有效清除自由基[5]。黄精(Polygonatum sibirifum Red.)为百合科黄精属植物,药理实验表明,黄精具有抗病原微生物、抗疲劳、抗氧化和抗病毒等作用,对于血糖的控制也有一定作用[6]。本研究以中医药理论为指导,遵循配伍理论与原则,在前期富硒青钱柳多糖降血糖研究工作基础上[7],将富硒青钱柳提取物和黄精提取物进行复配制成的富硒青钱柳-黄精复方(Selenium-enriched Cyclocarya paliurus and Polygonatum sibirifum combined extract,Se-CPPS)作为受试样品,通过建立Ⅱ型糖尿病大鼠模型,研究Se-CPPS的体内降血糖和抗氧化作用,同时探究其体外抑制糖代谢相关酶和清除自由基的能力,为Se-CPPS的研究和开发提供理论及实验依据。
1 材料与方法
1.1 动物及饲料
SPF级雄性SD大鼠60只,体质量225~258 g,许可证号:SCXK(鄂)2015-0018。实验动物、普通维持料及高脂饲料由湖北省疾病预防控制中心提供;自制高脂高糖饲料(普通维持料52.6%、胆固醇1.2%、猪油10%、酪蛋白5%、蔗糖15%、蛋黄粉15%、胆酸钠0.2%、Ca(HCO3)2 0.6%、石粉0.4%)。
1.2 药物与试剂
Se-CPPS(湖北恩施思慧生物科技有限公司);消渴丸(广州白云山中一药业有限公司);阿卡波糖片(拜耳医药保健有限公司);维生素C(VC)片(浙江瑞新药业股份有限公司);链脲佐菌素(STZ)[上海阿拉丁生化科技股份有限公司,溶解于0.1 mol/L(pH4.4)柠檬酸盐缓冲液,临用前配制];超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)检测试剂盒,总抗氧化能力检测试剂盒(南京建成生物工程研究所);鱼跃血糖试纸(上海鱼跃医疗设备有限公司);-淀粉酶、-葡萄糖苷酶、4-硝基苯--D-吡喃葡萄糖苷(pNPG)(美国Sigma公司);1,1-二苯基-2-三硝基苯肼(DPPH)(梯希爱上海化成工业发展有限公司)。
1.3 主要仪器
血糖仪(上海鱼跃医疗设备有限公司);BS 124S分析天平(Sartorius公司);SHJ-A6水浴恒温磁力搅拌器(金坛市亿能实验仪器厂);TG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);紫外-可见分光光度计(上海精密仪器仪表公司);多标记分析仪(美国Perkin Elmer)。
1.4 实验分组及给药
将60只雄性SPF级的SD大鼠适应性喂养,设置正常组(灌胃蒸馏水)、模型组(灌胃蒸馏水)和Se-CPPS低、中、高剂量组(给药剂量根据人体推荐剂量换算得到,分别为0.27、0.81、2.43 g/kg),阳药组(0.36 g/kg消渴丸)作为阳性对照组,各组大鼠均为10只。实验期间,正常组给予普通饲料喂养,其余各组给予高脂饲料喂养。以蒸馏水配制各样品,根据大鼠的体质量,按每1 mL/100g体重进行给药,每天给药1次,连续给药42 d。
1.5 糖尿病大鼠模型建立
喂养第21天,各组均禁食不禁水过夜。模型组、阳药组和Se-CPPS低、中、高剂量组大鼠腹腔注射1%STZ(无菌pH 4.4的柠檬酸缓冲溶液配制,剂量为45 mg/kg),正常组腹腔注射等体积的0.1 mol/L柠檬酸缓冲溶液。3 d后,测定大鼠空腹血糖,空腹血糖在11.1~33.3 mmol/L之间的大鼠选为造模成功的大鼠。造模未成功的大鼠待血糖稳定后补打一次STZ,方法同上,并于3 d后再次测其空腹血糖。
1.6 标本采集及指标检测
给药后,每周测定大鼠的体质量,自由摄食,自由饮水,观察大鼠状态。腹腔注射STZ造模后,于第3、7、14、21天,大鼠禁食不禁水过夜,尾端采血测定空腹血糖(FBG)。末次灌胃给药后,各组大鼠禁食12 h,大鼠称重,腹主动脉取血后处死,3 000 r/min离心15 min取血清,测定SOD、GSH-Px和MDA指标。解剖取大鼠肝脏、肾脏、脾脏和胸腺,称重,计算脏器指数。
1.7 糖代谢相关酶活性的检测
1.8 体外氧化指标的检测
1.8.1 DPPH自由基清除率测定 将0.25 mmol/L DPPH溶液2.0 mL和不同浓度的Se-CPPS乙醇溶液2.0 mL依次加入到试管中,摇匀后,避光30 min,以无水乙醇作空白对照,于517 nm波长测定吸光度值,平行测定5次。DPPH自由基清除率=(A0 As)/A0 100%,其中A0是空白对照吸光度,As为样品吸光度。
1.8.2 OH清除率测定 将4 mmol/L硫酸亚铁和4 mmol/L水杨酸醇溶液各取2.0 mL加入试管内,依次加入2.0 mL不同浓度的Se-CPPS乙醇溶液摇匀,继续加入4 mmol/L双氧水2.0 mL,混合摇匀,于37℃水浴加热30 min后,以纯化水作空白对照,于510 nm波长测定吸光度值,计算羟基自由基清除率。羟基自由基清除率=(A0 As)/A0 100%,其中A0是空白对照吸光度,As为样品吸光度。
1.8.3 总抗氧化能力测定 采用南京建成生物工程研究所试剂盒测定。将1 mL试剂1和0.1 mL不同浓度的Se-CPPS水溶液加入试管中,作为测试管,依次加入2 mL试剂2和0.5 mL试剂3应用液,充分混匀,37℃水浴30 min,加入0.1 mL试剂4,混匀,放置10 min。另设对照管,对照管中0.1 mL Se-CPPS水溶液于水浴后加入。于520 nm波长处测定各管吸光度,计算总抗氧化能力。定义:在37℃时,每分钟每毫升样品使反应体系的吸光度每增加0.01时,为一个总抗氧化能力单位(U),总抗氧化能力(U/mL)=(As A0)/(0.01 30),其中As为测定管吸光度,A0为对照管吸光度。
1.9 统计学方法
采用SPSS 20.0软件对实验数据进行统计学分析,对实验数据进行分析,结果以表示。先进行方差齐性检验,方差齐则进行单因素方差分析,差异显著后采用LSD法进行组间多重比较,P<0.05差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 大鼠生长状况和体质量的变化
大鼠体质量变化的结果见表1。大鼠糖尿病造模前,除正常组大鼠外,其他组大鼠采用高脂饲料饲养。饲养3周后,注射STZ造模前,模型组和给药组大鼠体质量明显高于正常组(P<0.01或P<0.05)。给药3周后,注射STZ建立大鼠Ⅱ型糖尿病模型,随着病程进展,造模组体质量较正常减轻明显,且毛发无光泽,而阳药组大鼠症状随实验进程体质量下降逐渐减轻,给药42 d大鼠体质量明显高于模型组(P<0.05)。在实验后期,模型组有3只大鼠下肢出现水肿,可能为糖尿病并发症,其他给药组大鼠未出现水肿症状。

表1 Se-CPPS对糖尿病大鼠体质量的影响Table 1 The effect of Se-CPPS on the weight change of diabetic rats
2.2 各组大鼠空腹血糖的比较
实验过程中,大鼠空腹血糖变化见表2。造模前,所有大鼠空腹血糖均小于6.0 mmol/L。造模组大鼠腹腔注射STZ的第3天后,空腹血糖均大于11.1 mmol/L,提示此次造模成功。STZ通过选择性破坏动物胰岛细胞,阻断胰岛素分泌,使血糖升高,常用来建立糖尿病动物模型[9]。造模后第3天和第7天,模型组和给药组大鼠空腹血糖明显高于正常组(P<0.01)。造模后第14天和第21天,造模组大鼠空腹血糖仍明显高于正常组(P<0.01),但阳药组和Se-CPPS低、中、高剂量组大鼠空腹血糖明显低于模型组(P<0.01)。与造模后第14天相比,造模后21 d阳药组和Se-CPPS低、中、高剂量大鼠空腹血糖下降更明显。综上所述,阳性药消渴丸对降低Ⅱ型糖尿病大鼠空腹血糖有显著效果,而Se-CPPS各剂量组也可有效降低Ⅱ型糖尿病大鼠空腹血糖水平。

表2 Se-CPPS对糖尿病大鼠空腹血糖的影响Table 2 The effect of Se-CPPS on the FBG in diabetic rats
2.3 各组大鼠血清抗氧化指标的比较
高糖环境使机体内多种抗氧化酶活性减弱,发生氧化应激而导致脏器细胞凋亡及组织病理损伤。Se-CPPS对Ⅱ型糖尿病大鼠血清抗氧化指标的影响,见表3。结果显示,模型组大鼠血清中SOD的活性和GSHPx的活性较正常组显著降低(P<0.01)。与模型组相比,各给药组SOD的活性和GSH-Px的活性明显升高(P<0.01),Se-CPPS不同剂量组之间没有明显差异。Ⅱ型糖尿病大鼠血清中的丙二醛(MDA)水平较正常组升高(P<0.01),给药组血清中的MDA水平较模型组降低,其中阳药组有显著差异(P<0.05),Se-CPPS低、中、高剂量组与模型组差异极显著(P<0.01)。综上所述,Se-CPPS可提高血液中SOD和GSH-Px的活性,显著降低血液中脂质过氧化物MDA的水平,增强机体抗氧化能力。
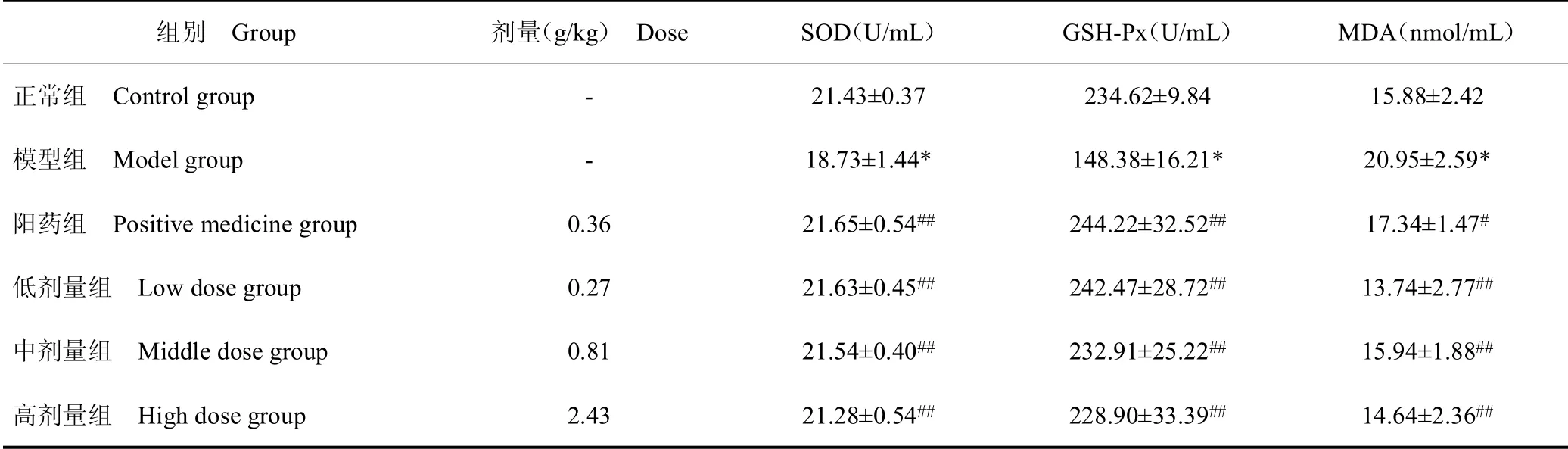
表3 Se-CPPS对糖尿病大鼠血清中SOD、GSH-Px、MDA的影响Table 3 The effect of Se-CPPS combined extract on the SOD,GSH-Px and MDA in serum of diabetic rats
2.4 各组大鼠脏器指数的比较
脏器指数可用来衡量和反映动物的功能状态[10]。Se-CPPS对Ⅱ型糖尿病大鼠脏器指数的影响见表4。结果显示,与正常组相比,Ⅱ型糖尿病大鼠肝脏指数明显上升(P<0.01),各给药组之间肝脏指数没有明显差异。正常组大鼠和糖尿病大鼠肾脏指数和脾脏指数没有明显差异。模型组大鼠胸腺指数较正常组下降(P<0.05),Se-CPPS低剂量组大鼠胸腺指数较模型组明显增高(P<0.05),提示Se-CPPS可改善糖尿病大鼠的免疫功能。
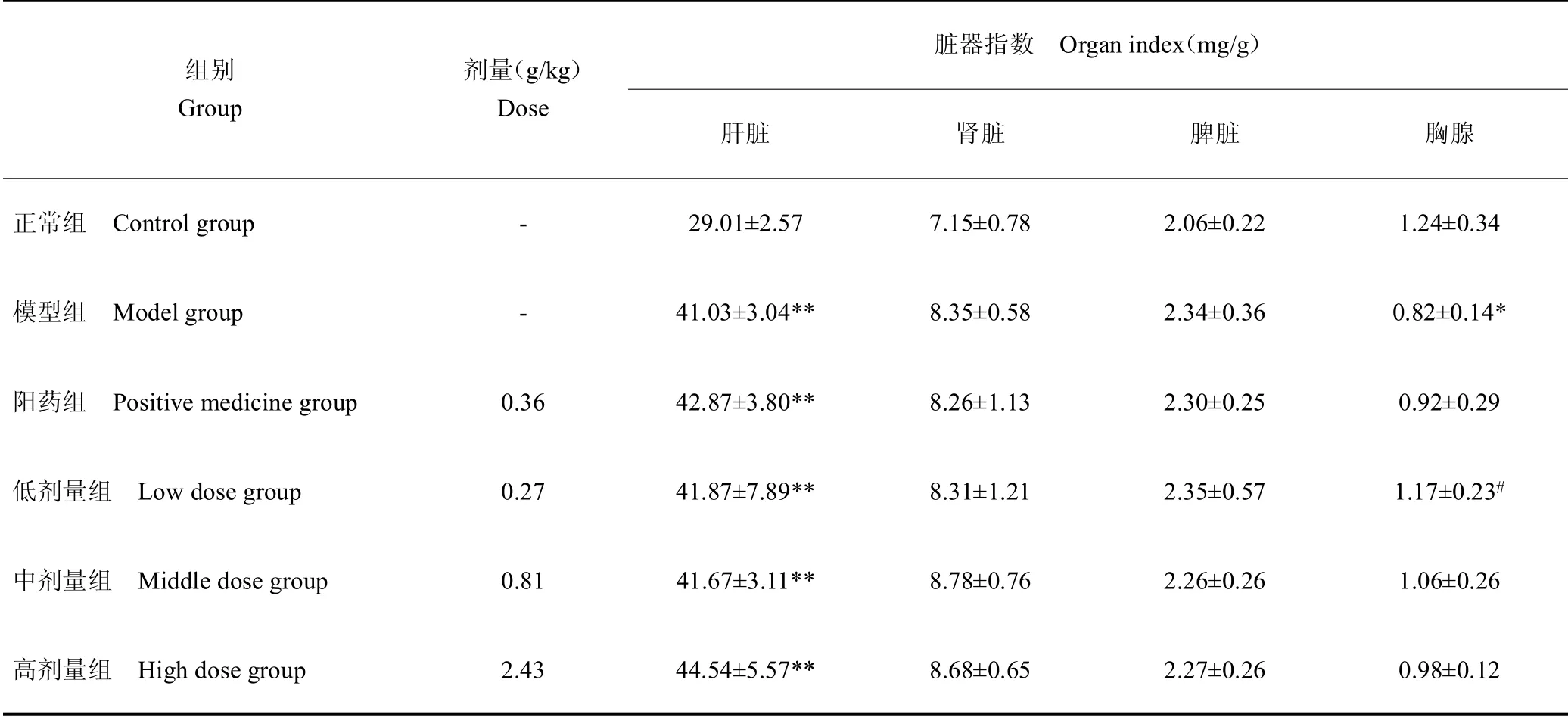
表4 Se-CPPS对糖尿病大鼠脏器指数的影响Table 4 The effect of Se-CPPS on the organ index of diabetic rats
2.5 糖代谢相关酶活性的检测
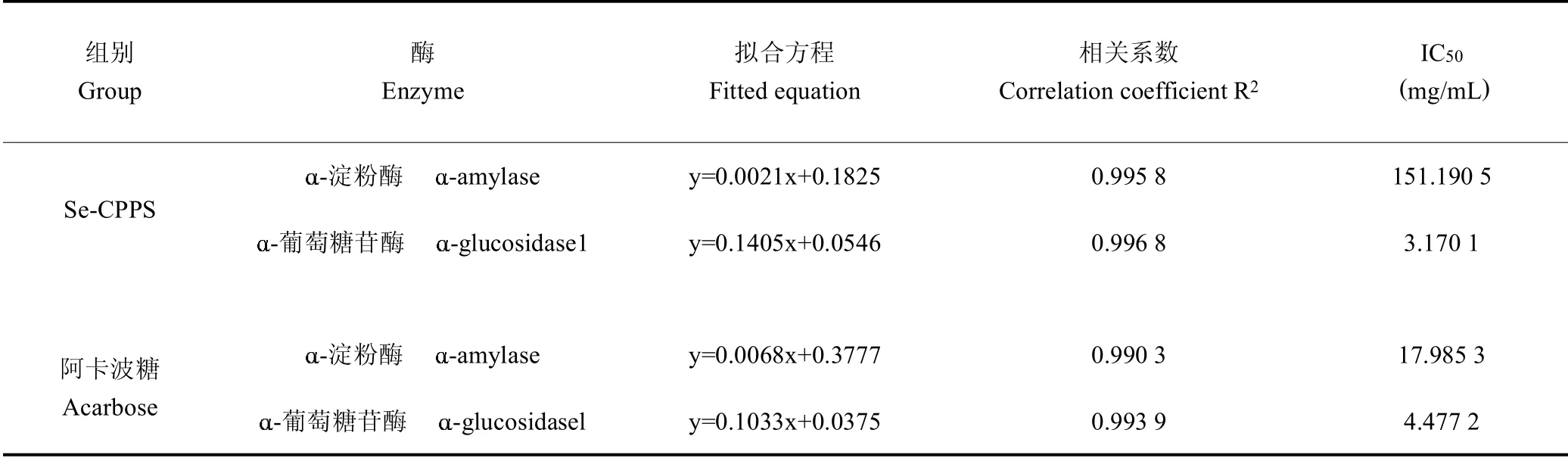
表5 Se-CPPS对-淀粉酶和-葡萄糖苷酶的抑制作用及其量效关系数学模型Table 5 Inhibitory activities agains-amylase and-glucosidase and mathematical model of dose-effect relationship of Se-CPPS
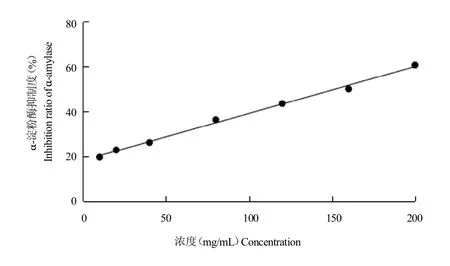
图1 Se-CPPS对-淀粉酶的抑制作用Fig.1 The inhibitory activity of Se-CPPS against-amylase

图2 Se-CPPS对-葡萄糖苷酶的抑制作用Fig.2 The inhibitory activity of Se-CPPS against-glucosidasel
2.6 体外抗氧化作用的结果
Se-CPPS和VC清除DPPH自由基和OH的拟合方程、相关系数和IC50值,见表6。
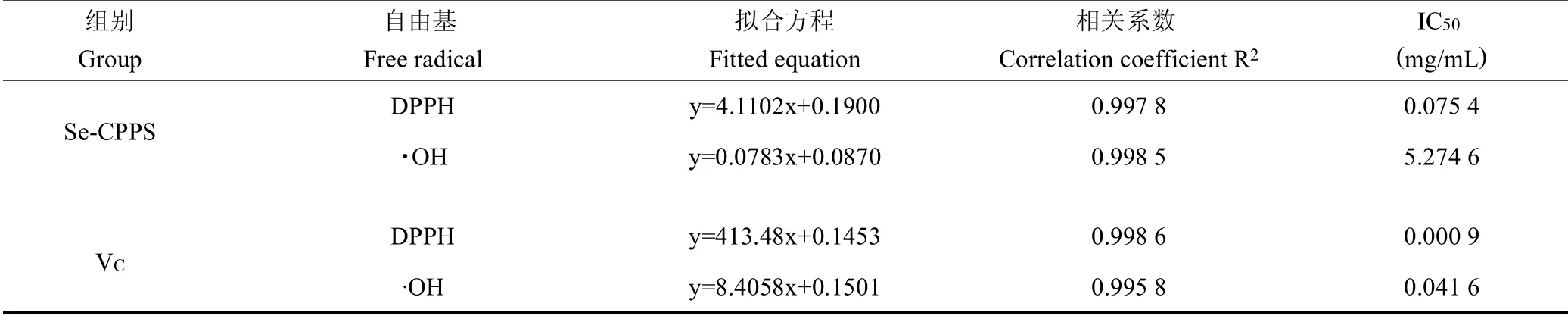
表6 Se-CPPS的抗氧化作用及其量效关系数学模型Table 6 The antioxidant activity and the mathematical model of dose-effect relationship of Se-CPPS
2.6.1 对DPPH自由基清除率的影响 由图3可见,Se-CPPS显示出一定的DPPH自由基清除能力,并且其清除活性具有剂量依赖性。当提取物浓度为0.2mg/mL时,Se-CPPS的DPPH自由基清除率可达到99.39%,表现出良好的DPPH自由基清除能力。由表6可知,Se-CPPS和VC的IC50分别为0.075 4和0.000 9 mg/mL。
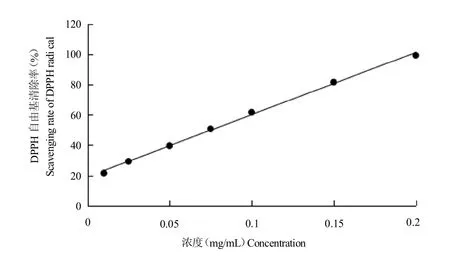
图3 Se-CPPS的DPPH自由基清除能力Fig.3 The DPPH radical-scavenging activity of Se-CPPS
2.6.2 对OH自由基清除率的影响 由图4可见,Se-CPPS具有清除OH的能力。在试验浓度范围内,随着Se-CPPS浓度的增大,OH清除率逐渐升高。当提取物浓度为10 mg/mL时,Se-CPPS的OH清除率可达到85.89%,表现出良好的OH清除能力。由表6可知,Se-CPPS和VC的IC50分别为5.274 6和0.041 6 mg/mL。

图4 Se-CPPS的OH清除能力Fig.4 The OH radical-scavenging activity of Se-CPPS
2.6.3 对总抗氧化能力的影响 总抗氧化能力是评价抗氧化剂能力的综合性指标,可反应出生物体抗氧化酶系统和非酶系统的抗氧化能力,在总体上反映机体防御体系抗氧化能力的强弱[11]。当Se-CPPS的浓度为0.1、1.0和10.0 mg/mL时,总抗氧化能力分别为9.62、22.69和57.23 U/mL。
3 讨论
糖尿病是由于人体内缺乏胰岛素所引起的以血糖升高为主要特征的慢性代谢性疾病,并可伴有蛋白质、脂肪、水及电解质的代谢紊乱[12]。糖尿病与人体内硒元素的缺乏具有一定的关系,适量补硒对于糖尿病的预防与治疗具有重要意义,本课题前期研究结果表明,富硒青钱柳具有较好的降血糖效果[13]。本研究选取高脂高糖饲料加低剂量STZ腹腔注射的方法构建Ⅱ型糖尿病模型大鼠,初步考察Se-CPPS对Ⅱ型糖尿病大鼠降血糖作用。阳性药选取消渴丸作为供试药,该药对降低Ⅱ型糖尿病大鼠空腹血糖有显著效果,而Se-CPPS各剂量组也可有效降低Ⅱ型糖尿病大鼠空腹血糖水平。糖尿病导致机体血糖利用不足,脂肪过多消耗,体重下降,Se-CPPS对糖尿病引起的体重下降有一定的改善作用。体外研究发现,Se-CPPS降血糖的机制可能与抑制-淀粉酶和-葡萄糖苷酶作用相关。另外,模型组大鼠出现下肢水肿症状,而阳药组和Se-CPPS组大鼠未发生此并发症,说明Se-CPPS可降低糖尿病的血糖水平,同时减少并发症的发生。
糖尿病的发生也与体内过量活性氧物质有关,氧化应激是Ⅱ型糖尿病发生发展的重要危险因素[14]。高血糖引起氧化应激,体内过量的活性氧物质破坏胰岛细胞,加重胰岛素抵抗,降低体内胰岛素水平,使血糖升高,形成恶性循环,同时累及其他脏器,如肝脏、肾脏等[15]。糖尿病模型组血清中SOD、GSH-Px的活性下降,MDA的含量上升。Se-CPPS可有效提高Ⅱ型糖尿病大鼠血清中SOD、GSH-Px的活性,清除血清中MDA的水平堆积,从而有效提高糖尿病动物机体抗氧化能力,降低氧化应激程度。体外抗氧化结果发现,Se-CPPS浓度越大,自由基的清除率愈高,提示Se-CPPS的体、内外作用具有一定关联性。脏器指数能衡量疾病和药物对脏器功能的影响,本研究中糖尿病模型组大鼠肝脏指数增加,胸腺指数下降。胸腺和脾脏作为中枢及外周免疫器官,其质量变化反应了机体细胞免疫功能[16]。糖尿病大鼠经Se-CPPS给药后,胸腺指数有上升趋势,且低剂量有统计学意义,说明Se-CPPS可预防与改善高血糖导致的机体氧化应激,对于缓解糖尿病脏器损伤具有重要意义。
本研究以我国特有植物青钱柳为原材料,采用叶面喷施有机硒肥的方式使青钱柳富集硒元素[5]。从富硒青钱柳叶中提取分离获得富硒青钱柳多糖,可降低糖尿病小鼠餐后血糖,增强糖尿病小鼠SOD和GSHPx的活性[7,13]。此外,黄精多糖可降低糖尿病小鼠血糖,纠正血清和肝脏中T-SOD和GSH-Px的活性以及MDA的含量异常变化,帮助恢复机体正常的抗氧化能力[17]。本研究在中医药理论指导下,按照配伍的原则,将富硒青钱柳提取物和黄精提取物进行科学复配,得到的Se-CPPS可有效降低Ⅱ型糖尿病大鼠血糖,增强机体的抗氧化能力,减轻活性氧对脏器的损伤,提高免疫器官的脏器指数。体外研究证明,Se-CPPS可抑制糖代谢相关酶-淀粉酶和-葡萄糖苷酶的活性,且有效清除DPPH自由基和OH。总之,Se-CPPS降血糖和抗氧化作用显著,是具有开发潜力和研究价值的保健食品新原料。
