橡胶合酶基因TkCTP1异源表达对杜仲胶合成的影响
2021-06-25陈湖芳姚新转王璐张宝会吕立堂
陈湖芳,姚新转,王璐,张宝会,吕立堂,※
(1.贵州大学生命科学学院/农业生物工程研究院山地植物资源与种质创新省部共建教育部重点实验室,贵州 贵阳 550025;2.贵州大学茶学院,贵州 贵阳 550025;3.贵州省农业科学院,贵州 贵阳 550025)
杜仲(Eucommia ulmoides Oliver)是中国特有植物,属于杜仲科杜仲属落叶乔木,原产黄河以南,目前主要分布在我国中纬度地区,在医药、工业和绿化等方面有重要作用[1-3]。杜仲胶是一种天然高分子聚合物,其主要成分为反式-l,4-聚异戊二烯。天然橡胶主要成分为顺式-l,4-聚异戊二烯,杜仲胶化学成分与天然橡胶相同,但分子结构不同,它们互为同分异构体,且杜仲胶合成过程与天然橡胶合成过程区别为反式异戊二烯转移酶(TPT)负责引发底物的合成,所掺入的C5单体呈反式构型,形成杜仲胶;顺式-异戊烯转移酶(CPT)负责催化异戊二烯单体(IPP)多聚化,形成橡胶,所掺入的C5单体呈顺式构型。我们在很多植物中发现了异戊烯类化合物,它在植物代谢过程中有重要作用,例如IPPS(异戊烯基二磷酸合酶,又称异戊烯基转移酶)催化IPP与DMAPP(二甲基烯丙基焦磷酸)缩合反应,形成GPP(牻牛儿基焦磷酸),合成各种异戊烯类的化合物[4]。
天然橡胶主要由顺式-1,4-异戊二烯组成的高分子量的生物聚合物,它们由紧密结合在橡胶粒子上的酶定向运输IPP而形成橡胶分子[5,6]。顺式-异戊烯基转移酶是天然橡胶合成的关键酶,催化IPP多聚化,形成长链橡胶,是橡胶生物合成的最后一步;此外,它还决定橡胶分子的大小、产胶量和橡胶的理化性质等[7]。据文献记载,最早被人们分离出来的CPT是拟南芥的ACPT(顺式-异戊烯基转移酶),研究表明该酶虽然可以催化合成聚异戊二烯(大小为5.4 103~6.8 103Da),但无法形成分子量大于1 106Da的天然橡胶[8]。通过Northern blot杂交,结果显示克隆的基因能够在胶乳中大量地表达,但在橡胶树的叶片中不表达,也不受乙烯的诱导。Schmidt等从蒲公英橡胶草(T.brevicorniculatum)克隆了TkCPT1-3基因,在酿酒酵母和烟草中实现了表达,结果为TkCPT1-3催化T.brevicornicu橡胶合成过程中IPP的多聚化过程,且TkCPT1-3的功能可能基本相同[9,10]。Post等[11]通过RNAi实验干涉T.brevicornicu中TkCPT1-3基因,发现转基因植株橡胶含量变低,形成橡胶粒子的数量减少,同时三萜含量和菊糖合成量增加明显,HMGR蛋白活性下降。
CPT与UPPS(十一异戊烯基二磷酸合酶)属于IPPS[4]。IPPS有2种,即催化合成反式双键的E-IPPS(反式异戊烯基转移酶)和催化合成顺式双键的Z-IPPS(顺式异戊烯基转移酶)。CPT属于Z-IPPS[Cis(Z)-Isoprenyl Diphosphate Synthases]超级家族。在原核生物中,橡胶转移酶是天然橡胶合成的重要参与者,催化IPP多聚化过程。根据产物链长度,CPT分为3个亚家族:短链(C15)、中链(C50-C55)和长链(C70-C120)。据文献报道,橡胶草和其他产橡胶植物的CPT具有强烈的保守性,所以TkCPT1、TkCPT2和TkCPT3有助于橡胶草中的橡胶生物合成。虽然各种产胶植物物种之间有一定差异,但天然橡胶生物合成的基本机制是相似的,都涉及了酶与胶乳中的橡胶粒子结合的过程,橡胶粒子是植物体内天然橡胶的生物合成发生的场所,是一个非常繁杂的生物合成过程,因此,研究橡胶转移酶的性质及其生物学功能,对揭示橡胶生物合成的分子机理及橡胶分子量大小的决定机制具有重要意义[12]。本实验尝试通过超量表达TkCPT1基因使合成反式-1,4-聚异戊二烯橡胶的杜仲合成顺式-1,4-聚异戊二烯橡胶。
1 实验材料与方法
1.1 实验材料
外植体:杜仲(Eucommia ulmoides Oliver)下胚轴,由无菌的杜仲苗得到,用于遗传转化材料。遗传转化菌株:农杆菌(菌株LBA4404)、大肠杆菌(菌株DH5E);双子叶植物表达载体pSH737,报告基因为gus::nptII。
1.2 实验方法
1.2.1 农杆菌介导杜仲遗传转化体系的建立 用无菌刀片将杜仲无菌苗下胚轴切成0.5 cm左右茎段备用,重悬液重新悬浮农杆菌,使菌液与下胚轴充分接触,侵染30 min。
将杜仲下胚轴从菌液中迅速取至无菌滤纸,吸干菌液,置于共培养培养基中,25℃黑暗培养2~3 d。转移至筛选培养基中培养,待抗性芽形成。
对照组:未浸染农杆菌下胚轴,置于WT培养基中,WT培养基中不添加抗生素,其他条件都相同。
1.2.2 转基因杜仲炼苗与移栽 选取长势良好的杜仲抗性芽,与无菌苗嫁接,25℃培养1个月,待有新芽长出,进行7 d的炼苗处理(期间保证叶片不能失水),洗净嫁接苗根部培养基,移栽至温室(相对湿度:80%~90%,温度:20~28℃)中培养,并搭建透气透光的遮阳网对其进行遮阳保护。
1.2.3 转基因植株GUS组织化学染色 剪取杜仲叶片、茎、根和愈伤组织,放入离心管中,添加适量GUS染色液使其完全浸没,真空泵真空5min;37℃培养箱中放置过夜;倒掉GUS染液,用乙醇溶液对染色组织进行梯度脱色至绿色褪去(梯度:50%-70%-95%-99.99%的无水乙醇)。体式显微镜下观察GUS染色情况,并拍照。
1.2.4 杜仲植株DNA提取与PCR鉴定 杜仲基因组DNA提取参照DNA提取试剂盒说明书(天根生化科技有限公司)。
1.2.5 转基因杜仲与野生型杜仲代谢组
1.2.5.1 样品信息 待测样本信息:转基因组和野生型组,每组选用1个株系,6份生物学重复,样本见表1,具体方法参考Benton的研究[13],表1。

表1 样品信息Table 1 Sample informations
1.2.5.2 样本预处理方法 80℃取出杜仲转基因苗,液氮研磨至粉末,称取60 mg,1 mL甲醇乙腈水溶液(2:2:1,体积比)涡旋60s,低温2次超声,30min/次,20℃沉淀蛋白1 h,过滤管过滤,14 000 rcf,4℃离心20 min,取上清液,冷冻干燥,80℃保存样本。
1.2.5.3 色谱-质谱分析
(1)色谱分析
色谱系统:Agilent 1290 Infinity LC超高效液相色谱系统(UHPLC);色谱柱:HILIC;柱温25℃;流速0.3 mL/min。
流动相:A相:水+25 mM乙酸铵+25 mM氨水;B相:乙腈。
梯度洗脱程序:测量样品和QC样品队列随机混合进行分析,QC样品用于监测评价系统的稳定性及实验数据可靠性。进样温度为4℃,具体步骤见表2。
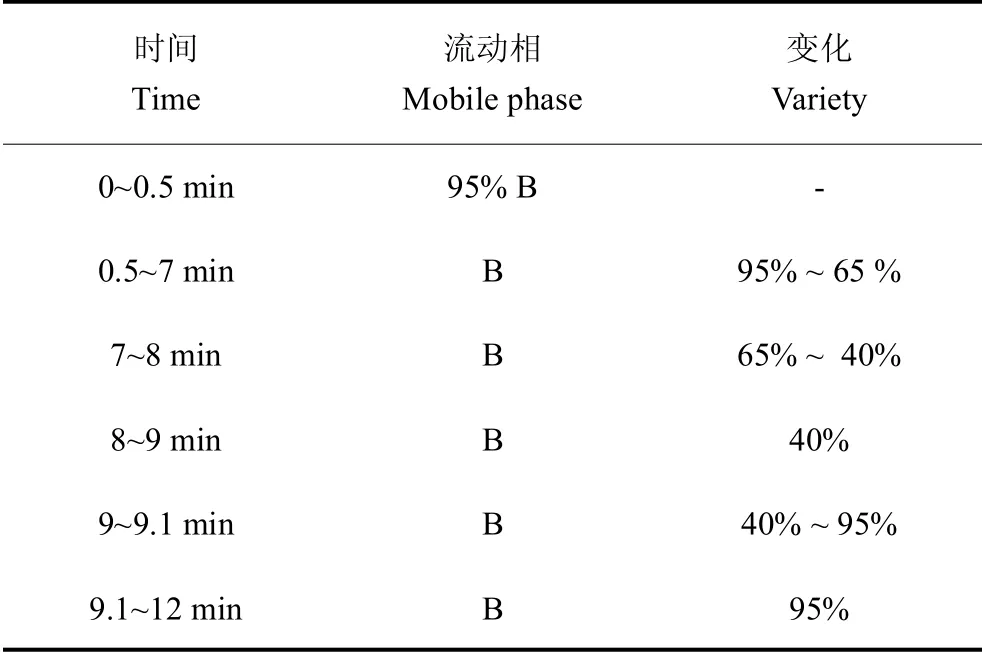
表2 色谱条件Table 2 Chromatographic conditions
(2)Q-TOF质谱分析:
采用电喷雾电离(ESI)正离子和负离子模式进行检测。样品经UHPLC分离后用Agilent 6550质谱仪进行质谱分析,具体参数见表3。
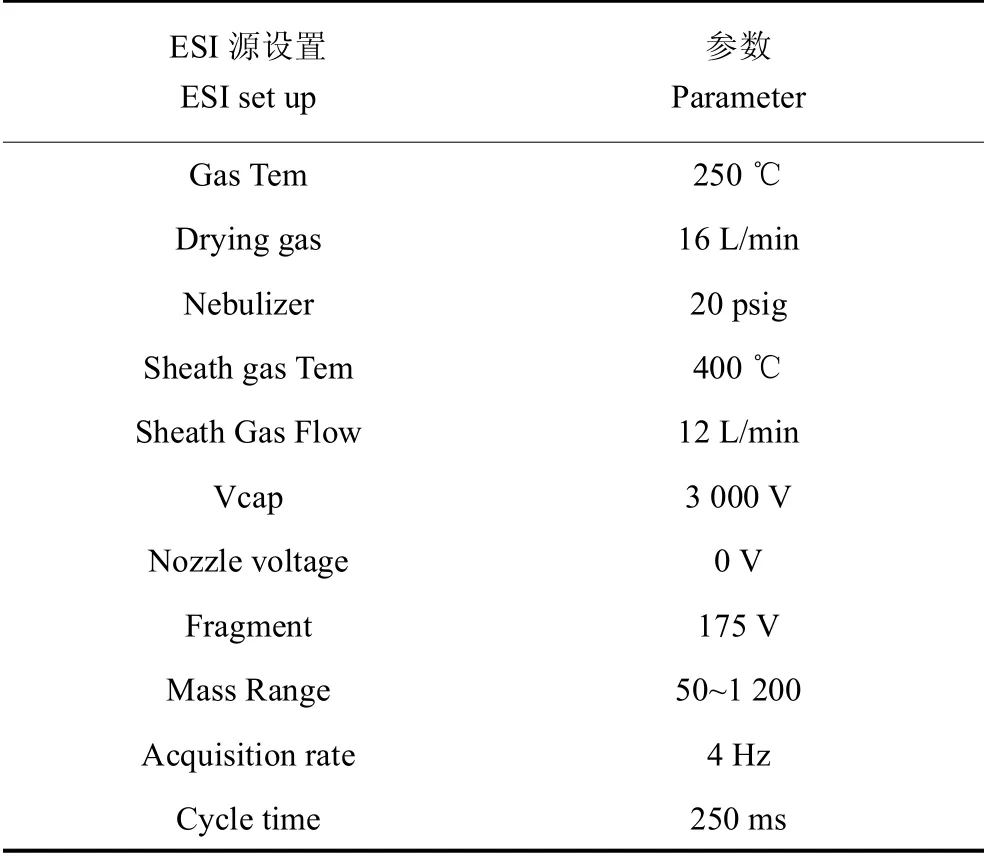
表3 质谱条件Table 3 Mass spectrometry conditions
代谢物鉴定:样本检测完毕后,采取AB Triple TOF 6600质谱仪对代谢物进行鉴定,采集QC样品的一级、二级谱图。ESI源条件见表4。

表4 ESI源条件Table 4 ESI source conditions
二级质谱分析:二级质谱采用information dependent acquisition(IDA)的high sensitivity模式,具体条件见表5。

表5 二级质谱条件Table 5 Secondary MS conditions
数据采集按质量范围进行分段,每个方法每段采集4个重复。所采集获得的数据,使用自建MetDDA和LipDDA方法,进行代谢物的结构鉴定。
1.2.6 杜仲胶结构的测定
1.2.6.1 杜仲胶的提取 采用多个株系混样提取:本实验是由12个株系的转基因杜仲进行混样提胶,野生型同转基因方法一致,杜仲胶采用传统碱煮法提取橡胶[14]:将干燥的杜仲茎叶放入0.1%的NaOH溶液中,置于磁力搅拌器上于50℃搅拌浸煮3 h,筛洗后干燥,粉碎后过60目筛,取5 g样品在索氏提取器中石油醚回流提取2 h,得到橡胶。
1.2.6.2 实验方法 红外光谱法测定:用丙酮从样品中提取抽提物,在室温下用氯仿将足量的抽提后的橡胶溶解,得到浓缩溶液。在碘化钾盐片上滴几滴浓缩溶液,让溶剂挥发完全,红外光谱仪记录4 000~600 cm-1范围内的红外光谱。确认光谱图中没有溶剂吸收带存在,同时谱带没有偏差或者吸收太弱,以野生型杜仲为对照组,转基因杜仲为实验组。
2 结果分析
2.1 农杆菌介导杜仲遗传转化体系的建立
外植体采用杜仲无菌苗叶片和茎,通过农杆菌介导下胚轴转化法遗传转化杜仲,在对杜仲遗传转化体系优化后,确定统一的遗传转化方法进行转基因杜仲抗性芽的获得,嫁接到杜仲无菌苗上,嫁接后的杜仲在无菌环境下25℃培养1个月,待嫁接接穗的再生芽有新叶长出且杜仲苗生长稳定后,将稳定的嫁接苗植株进行炼苗处理,使其适应外在环境,炼苗过程中应避免叶片水分散失。炼苗3~4 d,将根部培养基洗净,移栽到温室土壤中培养,具体培养过程如图1所示。

图1 转基因杜仲的遗传转化Fig.1 Genetic transformation of Oliver with gene
杜仲苗移栽植株成活后剪取嫩叶和茎进行-葡糖苷酶(-glucosidase,Gus)组织化学染色,初步鉴定转基因情况(图2 A和2 F),选取Gus染色结果为蓝色的植株,提取基因组DNA进行PCR鉴定(图2 G),最终获得杜仲转基因植株76株。

图2 转基因杜仲的鉴定Fig.2 The identification of Oliver with gene
2.2.1 偏最小二乘判别分析(PLS-DA)为了探究WT和转基因株系之间的次生代谢物差异情况,对转基因株系(TP-2)和野生型杜仲进行代谢组检测,选择偏最小二乘判别分析(Partial Least Squares Discrimination Analysis,PLS-DA)来实现对样品类别的预测。用PLS-DA对TP组与WT组进行模型分析,建立PLSDA模型进行7次循环交互验证,PLS-DA模型评价参数结果:正离子模式参数R2X、R2Y和Q2分别为0.513、0.99和0.757;负离子模式参数R2X、R2Y和Q2分别为0.74、0.996和0.927。R2Y和Q2接近1,表明此模型稳定可靠。得分图结果表明,TP组与WT组分布在2个不同的区域,因此当前建立的PLS-DA模型揭示了两组之间存在明显的代谢差异,见图3。
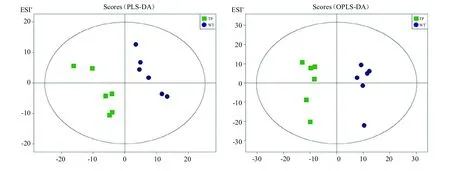
图3 样品PLS-DA得分图Fig.3 Sample PLS-DA score charts
2.2.2 差异代谢物的筛选 过滤掉与模型分类无关的信息,采用单维检验P值与OPLS-DA模型差异贡献值(VIP:Variable importance in the projection)寻找差异性表达代谢物(显著差异代谢物:P<0.05且VIP>1)。对转基因样品(TP)和野生型样品(WT)进行分析,共鉴定出58种显著性差异代谢物,TP相对于WT上调的物质有43种,下调的物质有15种,其中氨基酸类物质占显著差异代谢物总量的36.21%,且都为上调。表6为部分重要差异代谢物的鉴定结果(倍数FC:TP/WT的比值)。结果表明,差异代谢物集中分布在蛋白质的转运、消化吸收和嘌呤嘧啶代谢以及氨基酸代谢等生物反应过程中。我们检测与橡胶合成相关的差异代谢物倍半萜化合物(脱落酸)、三萜化合物(山楂酸和齐墩果酸)呈下调趋势,而存在两个单萜物质(紫苏醇和7,8-二氢--紫罗兰酮)上调,这些萜类代谢物和橡胶有相同的合成前体物质IPP。此外,还有两个IPP合成前体物质(D-赤藓糖-4-磷酸和甲羟戊酸)含量也有所下降,见图4。
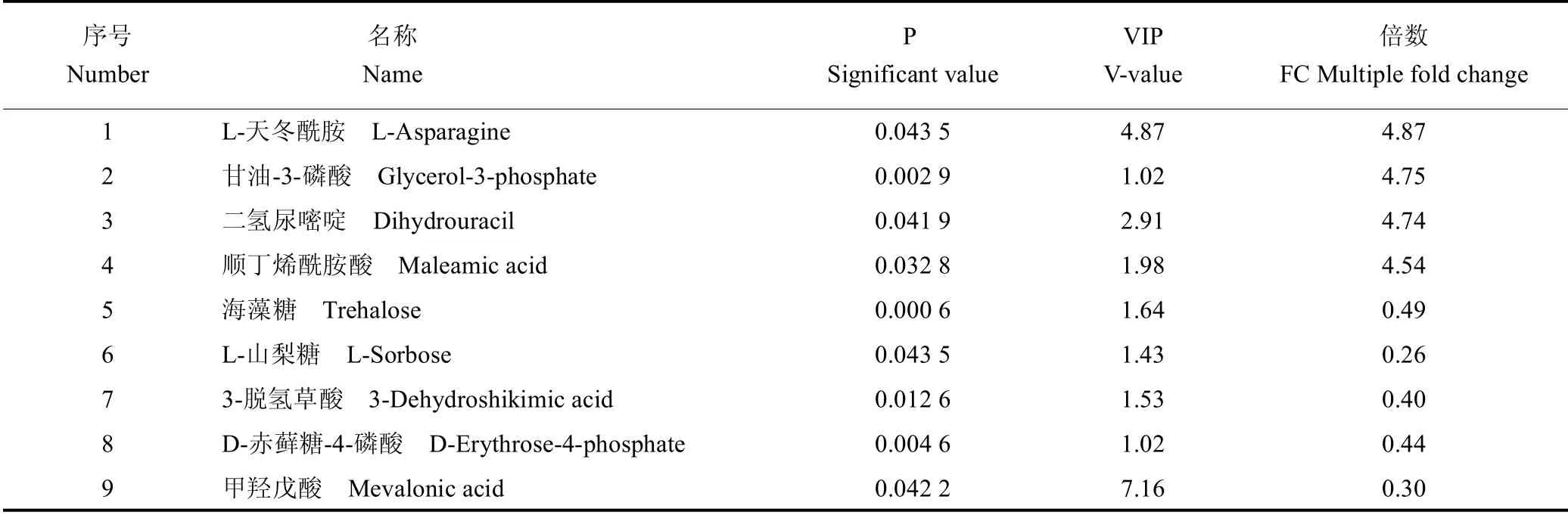
表6 部分重要显著差异代谢物的鉴定结果Table 6 Identification results of some important and significant metabolites

图4 橡胶合成通路Fig.4 Rubber synthesis pathways
2.3 红外光谱检测转基因杜仲与野生型杜仲胶的结构
为进一步确定转TkCPT1基因是否影响杜仲所产生橡胶的结构,使用红外光谱测定橡胶中聚异戊二烯的结构,检测结果如图5所示。不同结构分子吸收峰的位置不同,图5 A为野生型杜仲的红外光谱,图5 B为转基因杜仲的红外光谱,波长数841 cm-1、842 cm-1为异戊二烯的反式-1,4-结构双键上碳-氢键变角振动吸收峰,波长数1 385cm-1为异戊二烯的反式-1,4-结构双键碳上甲基结构的弯曲振动吸收峰,而转基因反式-1,4-结构的峰附近都有一个区别于野生型的峰,波数也极 为相近,分别是1 351 cm-1和830 cm-1。
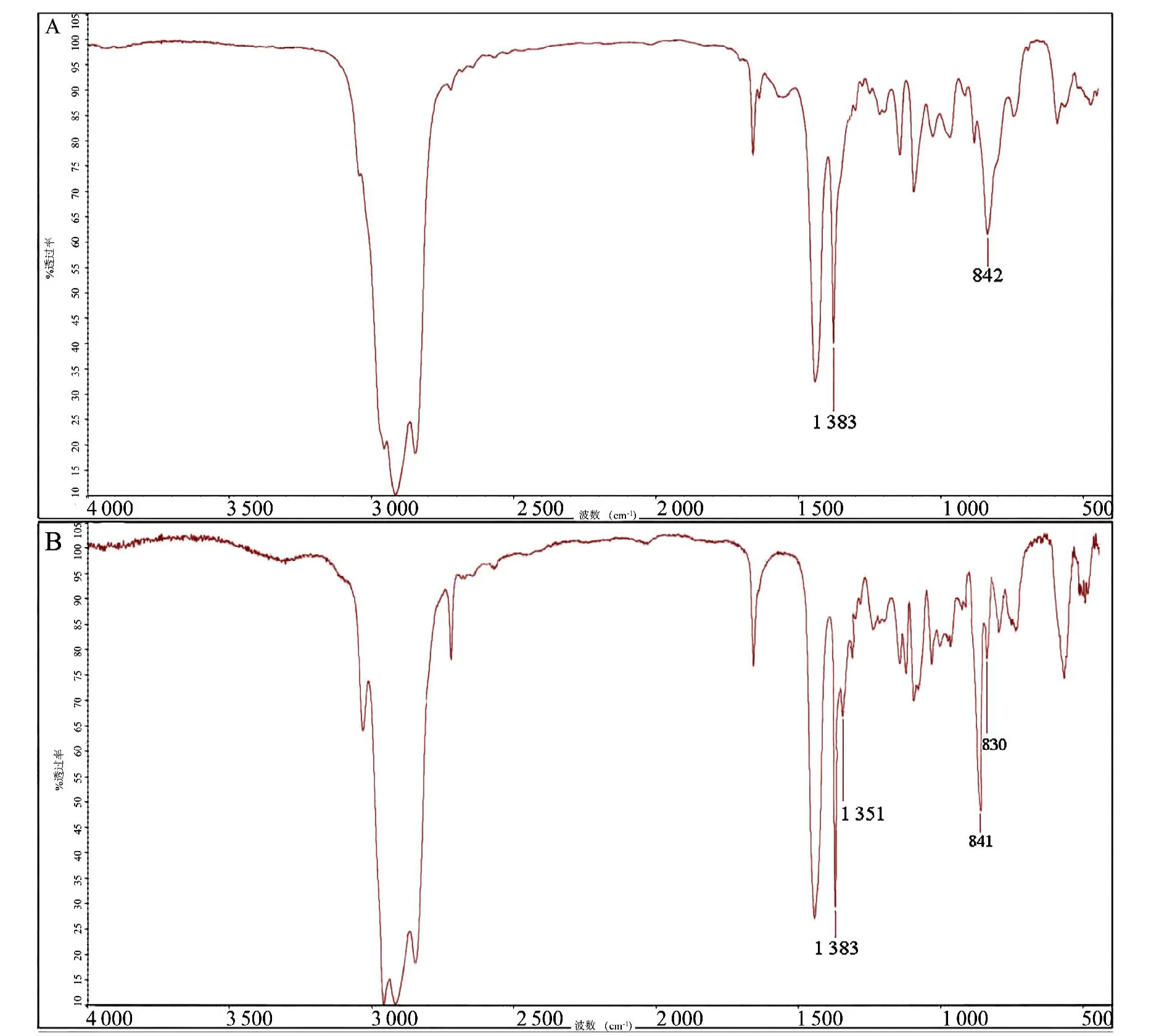
图5 杜仲胶的红外光谱图Fig.5 The Infrared spectrum of Eu-rubber
3 讨论
根据Canli[15]和Barbulova[16]的报道,我们选择了农杆菌LB4404来介导杜仲的遗传转化,通过PCR验证获得76株抗性杜仲,炼苗移栽共存活45株。
采用LC-MS/MS检测分析转基因杜仲与野生型杜仲代谢物差异,结果显示,两者之间存在58个显著性差异代谢物,其中43个上调、15个下调。上调的显著性差异代谢物主要为氨基酸,占总比的36.21%,说明转基因与野生型样品之间氨基酸组成存在显著差异。在显著性下调物质中,海藻糖是一种对植物有保护作用的糖类,研究显示海藻糖在细胞内的积累更有助于植物体抵抗外界恶劣环境[17],而转基因杜仲中海藻糖下降反映出转基因杜仲相对于野生型杜仲更难存活。代谢组检测到与杜仲胶生物合成相关的代谢物总共有7种,其中甲羟戊酸和D-赤藓糖-4-磷酸分别是MVA与MEP途径中的关键物质,MVA与MEP途径是IPP合成的前体物[18,19],IPP异构化或聚合进一步形成各种萜类物质、橡胶,转基因植株中甲羟戊酸和D-赤藓糖-4-磷酸的下调,推测为生成IPP,进一步转入CPT从而使消耗增加,导致甲羟戊酸和D-赤藓糖-4-磷酸消耗增加。5种萜类差异物质中两个单萜(紫苏醇和7,8-二氢--紫罗兰酮)出现含量上升,一个半倍萜(脱落酸)、两个三萜(山楂酸和齐墩果酸)含量下降,说明TkCPT1对杜仲的萜类含量产生了影响。脱落酸是一种植物抵抗外界不良环境的调节激素,脱落酸含量的下降体现出植物的自我保护能力减弱。
红外光谱检测异戊二烯的反式-1,4-结构特征峰位于1 385 cm-1、843 cm-1,顺式-1,4-结构特征峰位于1 376 cm-1、836 cm-1[20](异戊二烯顺式结构与反式结构的吸收峰十分接近),在转基因杜仲的红外光谱图中我们发现两个与反式结构十分接近的峰,与顺式-1,4-结构的波数相差25个和6个单位,推测原因为超量表达TkCPT1基因使原本产生反式橡胶的杜仲中产生了顺式的橡胶[21],代谢组中IPP合成前体减少,IPP向橡胶合成的方向变化则进一步验证了这个结果。由于橡胶与杜仲胶分子结构式相同导致检测难度大,目前还没有明确的检测方法,还有待进行更深入细致地研究,采用更灵敏、分辨率更高的方法来对其进行检测,结合转基因植株中基因表达量的高低来推测杜仲中是否合成了顺式聚异戊二烯(橡胶)。
转基因杜仲TkCPT1基因的表达,引起了杜仲中原有的代谢物发生变化,红外检测转基因杜仲植株产生了2个区别于野生型的特征峰,且与顺式-1,4-异戊二烯特征峰距离接近,推测超量表达TkCPT1基因可能在杜仲中产生顺式聚异戊二烯,具体还需要进一步探索检测方法。通过后续深入研究,继续证实在转基因杜仲植株产生顺式-1,4-聚异戊二烯以及对杜仲胶颗粒大小进行对比,对阐明杜仲的产胶机制具有重要意义。
