肝脏神经内分泌肿瘤35例临床病理分析
2021-06-23刘少儒黄贻培裴晓珊许磊波
刘少儒,黄贻培,裴晓珊,许磊波
肝脏神经内分泌肿瘤(neuroendocrineneoplasm,NEN)发病率较低,属罕见肿瘤,其中原发性肝脏神经内分泌肿瘤更为少见。神经内分泌肿瘤患者可出现内分泌紊乱的症状,但肝脏神经内分泌肿瘤常仅表现为肝脏占位的症状及体征,而无内分泌紊乱的表现[1]。随着诊断技术和认识水平的提高,近年来文献报道逐渐增多,但仍以个案报道及病例回顾为主[2-4]。本研究收集了中山大学孙逸仙纪念医院35例肝脏神经内分泌肿瘤患者资料,总结患者的诊治经过和随访结果,并结合相关文献报道探讨其发病情况和诊治要点。
1 资料与方法
1.1 病例选择及一般资料
选取2003-01-01至2019-08-27中山大学孙逸仙纪念医院诊治的35例肝脏神经内分泌肿瘤患者:男19例,女16例;年龄27~72岁,中位年龄56岁;仅3例患者有肝炎病毒感染史;8例患者为原发性肝脏神经内分泌肿瘤,27例患者为继发性肝脏神经内分泌肿瘤;18例患者起病时无任何症状,经体检发现肝占位;17例患者主要临床表现为腹痛、腹胀、乏力、厌油和体质量下降等。所有患者经肝脏切除标本或肝脏穿刺活检标本确诊为神经内分泌肿瘤。根据消化系统肿瘤WHO分类(2010)神经内分泌肿瘤分级标准,分为G1、G2和G3级。其中G1和G2级为神经内分泌瘤(neuroendocrine tumor,NET),G3级为神经内分泌癌(neuroendocrine carcinoma,NEC)。
1.2 辅助检查
行甲胎蛋白(AFP)、神经元烯醇化酶(NSE)、CA125和CA19-9检测。肝脏病灶5例为单发,均在肝右叶;多发30例,分布在肝脏左右叶,其中伴巨块型肿块(最大径≥10 cm)2例,伴淋巴结转移2例,骨转移2例,脑转移1例,伴门静脉主干癌栓形成1例。
1.3 病理检查
所有肿瘤标本均用4%中性甲醛固定,常规HE染色,免疫组化采用EnVision法,包括AFP、突触素(synaptophysin,Syn)、嗜铬素A(chrome A,CgA)、CD56、Ki-67、Villin、TTF-1和CK7等指标。
1.4 生存随访与统计学方法
所有患者均进行随访,至2020-10-30。随访开始时间定义为明确诊断肝脏神经内分泌肿瘤,随访截止时间定义为患者死亡或末次随访时间。生存分析采用SPSS 25.0软件,用Kaplan-Meier法绘制生存曲线。检验水准ɑ=0.05。
2 结果
2.1 病理和免疫组化及血清肿瘤标志物
如表1所示,其中21例经肝脏切除标本,14例经肝脏穿刺活检标本,病理明确诊断,原发性NET G2 3例(图1),原发性NEC 5例(图2)。继发性NET G2 4例(图3),继发性NEC 23例(图4)。AFP阳性率为11.4%(4/35),NSE阳性率为88.6%(31/35),CA125、CA10-9阳性率均为14.3%(5/35)。
2.2 治疗和生存
如表1和图5所示,8例原发性肝脏神经内分泌肿瘤患者中死亡5例、生存3例,1年生存率为75.0%,3年生存率为50.0%。3例原发性肝脏NET G2患者均接受肝切除手术,其中1例患者术后残余病灶行射频消融及无水酒精消融术,治疗完全,2例患者至末次随访仍存活,中位生存期60个月。1例原发性肝脏NET G3患者行肝部分切除术,术后行依托泊苷+顺铂(EP)方案化疗,化疗6周期后复查,未见转移和复发,继续行抗乙肝病毒治疗,生存期22个月。1例原发性肝脏NETG3患者行射频消融治疗5次,生存期超过10年。1例原发性肝脏NETG3患者出现梗阻性黄疸,肝门区病灶侵犯肝外胆管、胆囊、十二指肠、胰头,并且伴有多发骨转移,行经内镜逆行性胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)胆管支架置入术,生存期仅11个月。
如表1和图5所示,27例转移性肝脏神经内分泌肿瘤中死亡23例,生存4例,中位生存期20个月;1年生存率为63.0%,3年生存率为18.5%。继发性肝脏NEN中,17例原发于胃肠胰腺组织,3例原发于支气管肺组织,2例原发于乳腺组织,3例原发于食管组织,1例原发于胆囊,1例原发于宫颈组织。
17例来源于胃肠胰腺组织的NEN患者中15例已死亡,仅2例仍生存。5例患者接受根治性手术治疗,4例死亡,生存期5~36个月;仅1例存活,截至末次随访时生存期为70个月;3例患者接受姑息性手术治疗,术后生存期分别为11、20、23个月;7例患者未行手术治疗,仅接受全身化疗,化疗方案包括吉西他滨+替吉奥(GS)方案、吉西他滨+紫杉醇(GT)方案、卡培他滨+替莫唑胺(CAPTEM)方案等,生存期最长为44个月;2例患者分别仅接受射频消融或生长抑素治疗,生存期分别为11、36个月。
3例来源于支气管肺组织的肝脏NEN患者,1例确诊时已有脑转移,行多帕菲+奥先达+依托泊苷方案化疗4周期,生存期24个月;1例行EP方案及长春新碱+放线菌素D+环磷酰胺(VAC)方案化疗,生存期15个月;1例患者确诊时已出现肺门、纵隔淋巴结、肝脏转移,左侧阻塞性肺炎并左侧胸腔积液,未接受治疗,生存期仅6个月。
2例来源于乳腺组织的肝脏NEN患者,分别于术后2年、5年出现肝脏转移瘤,其中2年后出现肝脏转移灶患者接受手术治疗,随访23个月未复发,至末次随访仍存活;5年后出现肝脏转移瘤患者同时伴有胸腔积液,行胸腔灌注化疗,出现Ⅳ度骨髓抑制、肝肾功能不全,转移后生存期仅3个月。
3例来源于食管组织的NEN患者,1例患者食管肿瘤术后14年出现肝脏转移,同时伴有肺部可疑结节,未接受治疗,出现肝脏转移后24个月死亡;1例来源于食管组织患者确诊后行EP方案化疗5周期,生存期11个月;1例来源于食管组织患者确诊时已有全身多发转移,行EP方案化疗4周期后肝脏出现新病灶,行伊立替康单药治疗3周期,3周期后予CAPTEM方案及紫杉醇每周方案等进行化疗,患者出现骨髓抑制、难以耐受,停止化疗,最终因恶液质死亡,生存时间8个月。
来源于胆囊的继发性肝脏NEN患者,体检发现胆囊占位,考虑胆囊肿瘤,行胆囊切除+肝中叶切除+胆总管切除+肝门部淋巴结清扫+肝管空肠Roux-en-Y吻合术治疗,至末次随访仍存活,生存期57个月。
来源于宫颈组织的继发性肝脏NEN患者,行腹腔镜全子宫+双附件切除+盆腔淋巴结清扫术,术后行EP方案化疗2周期,7月后出现肝脏转移,行肝脏转移瘤射频消融治疗,消融治疗后生存期2个月。
3 讨论
神经内分泌肿瘤是一种起源于神经内分泌细胞和肽能神经元的异质性肿瘤,主要发生在支气管肺组织和胃肠胰腺组织,乳腺组织及食管组织来源的神经内分泌肿瘤也有报道。原发性肝脏神经内分泌肿瘤极为罕见,仅占所有NEN的0.8%[5]。
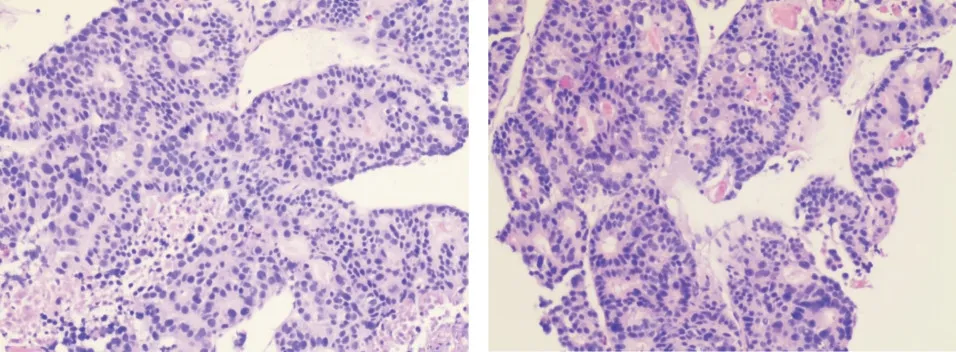
图2 肝脏转移性神经内分泌肿瘤病理表现(HE×100)

图3 原发性肝脏神经内分泌肿瘤影像学表现(2号患者)A:平扫见稍低密度肿块影;B:增强扫描动脉期及门脉期边缘环形强化(白色箭头处),中央可见大片状不强化或低强化区;C:三维重建;D、E:T2WI呈稍高及高信号,弥散明显受限,病灶边缘清楚;F:动态增强扫描病灶呈持续性强化
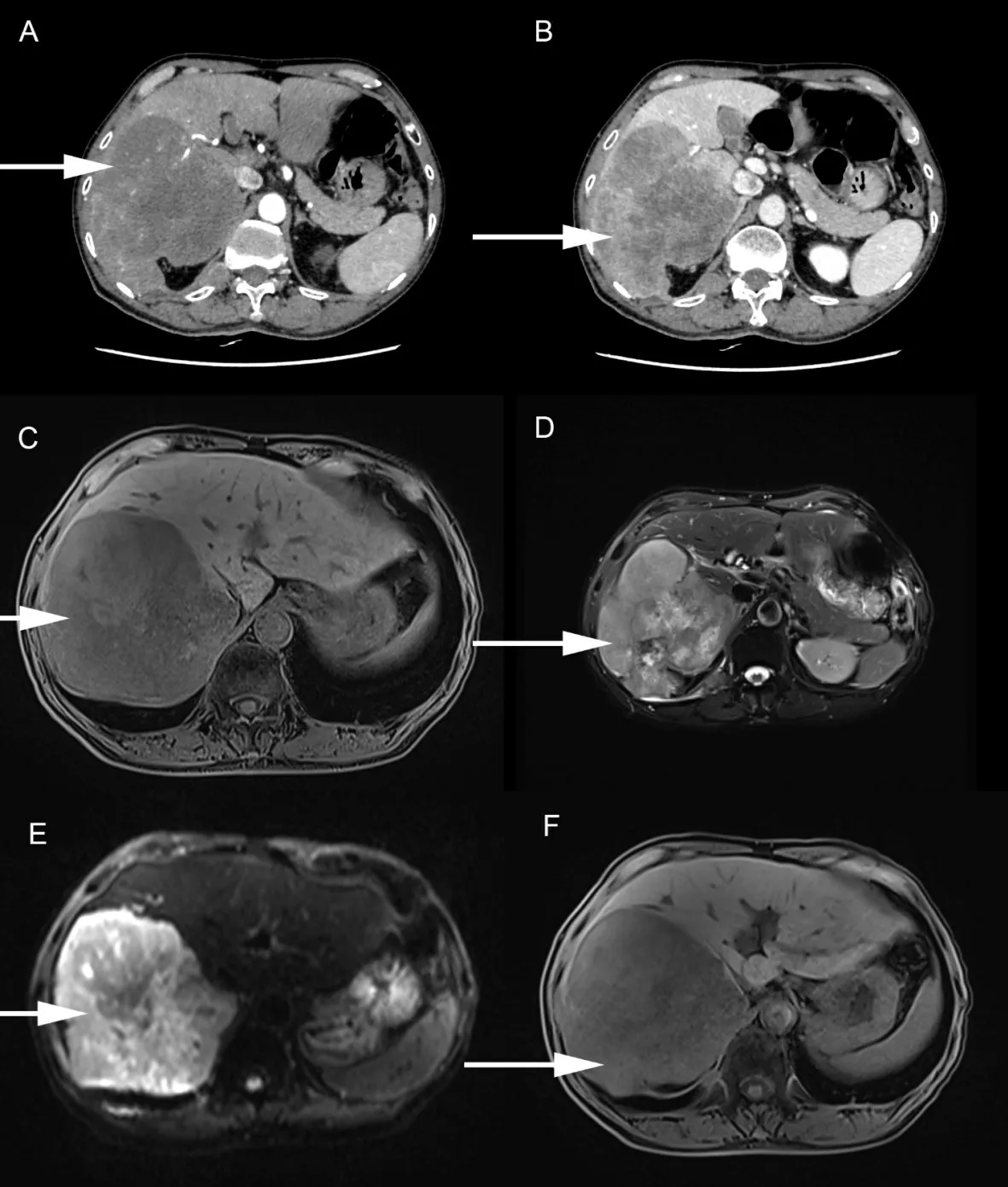
图4 转移性肝脏神经分泌肿瘤影像学表现(30号患者)A:巨大分叶状肿块,边界清晰,周围见假包膜征,增强扫描呈明显不均匀强化,动脉期病灶见结节状强化;B:门脉期强化减弱;C、D:长T1稍长T2信号影,增强扫描呈“快进快出”强化特征,动脉期病灶可见结节状强化;E:弥散加权成像(diffusion-weighted imaging,DWI);F:普美显未见摄取
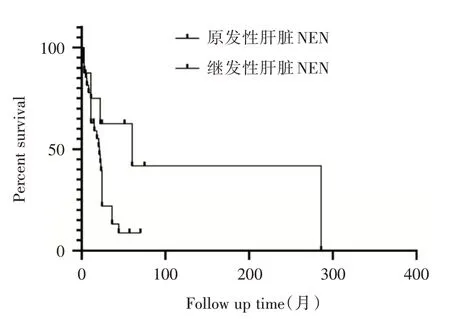
图5 肝脏神经内分肿瘤生存曲线
原发性肝脏神经内分泌肿瘤可发生于任何年龄段,以成人居多,中位发病年龄63岁[5]。目前文献报道的最小患者年龄为6岁7个月[6]。一项回顾性研究显示,女性发病人数多于男性(59.4%vs.40.6%)[1]。本文原发性肝脏NEN患者中也以女性居多(男女之比为1∶3)。原发性肝脏神经内分泌肿瘤的常见转移部位为肝内转移,其次是肝门部、胆囊颈、肝十二指肠韧带淋巴结转移和骨转移等,近年来有报道脑转移的罕见病例[7]。肝脏是最常见的神经内分泌肿瘤转移部位,本组中,继发性肝脏内分泌肿瘤17例原发于胃肠胰腺组织,3例原发于支气管肺组织,2例原发于乳腺组织,3例原发于食管组织,1例原发于胆囊,1例原发于宫颈组织。
肝脏神经内分泌肿瘤的临床表现多为上腹不适、黄疸、右上腹包块、体重下降和腹泻等非特异性症状,主要由于肿瘤本身或压迫邻近脏器所引起,仅少部分患者出现类癌综合征表现,如发作性腹泻、皮肤潮红、高血糖和心律失常等。其原因可能是虽然在细胞水平存在神经内分泌产物,但其数量不足或质量缺陷,通常不能激活靶器官而发挥生物学作用。可分泌激素并导致临床症状的神经内分泌肿瘤为功能性神经内分泌肿瘤,对于功能性神经内分泌肿瘤,在外科干预前应当先治疗内分泌功能紊乱相关症状,如通过减小肿瘤体积或控制低血糖来控制胰岛素瘤低血糖症状,采用两倍剂量PPI控制进展期胃肠神经内分泌肿瘤症状。肿瘤切除后酸分泌过多状态可能并未完全恢复正常,也需要长期应用低剂量抑酸治疗。一旦确诊为功能性神经内分泌肿瘤,在治疗干预前后,均需对患者的特异性肿瘤神经内分泌激素进行监测,联合影像学检查,有助于监测肿瘤进展、复发以及患者对治疗的反应等[8]。本组35例患者中18例无任何临床症状,其余17例患者表现为原发肿瘤症状或非特异性临床症状,如便血、腹痛、腹胀、乏力等,均未合并类癌综合征表现。
原发性肝脏神经内分泌肿瘤的术前诊断较困难,需要与原发性肝癌、血管瘤、转移性肿瘤等相鉴别,病理检查学和免疫组化是确诊的主要方法。该病患者多无肝炎病史,肿瘤标志物如AFP、CEA和CA19-9等多为阴性,常规检查方式如B超、CT和MR等影像学检查均不能确诊肝脏NET。原发性和继发性肝脏神经内分泌肿瘤影像学表现无明显差异(如图3、4所示)。由于原发性肝脏NET较为罕见,存在其他部位原发性NEN时,多考虑肝脏为继发性转移。由于CgA、NSE、S-100蛋白及Syn标志物的高度特异性和敏感性,免疫组化分析是诊断肝脏NET最准确的方法,其中CgA最具特异性。近来有学者提出可用生长抑素受体免疫组化诊断NET[9]。胰岛素瘤相关蛋白1(INSM1)可作为神经内分泌标志物,有助于诊断NECs,具有较高的敏感性和特异性[10,11]。本组患者中免疫组化CgA阳性率为77.1%(27/35),Syn阳性率为94.3%(33/35),血清AFP阳性率仅11.4%(4/35),NSE阳性率为91.4%(32/35),提示应联合多项标志物的检测,有助于明确此类患者诊断。但有指南并不推荐在胰腺神经内分泌肿瘤(pancreatic NET,pNET)治疗中常规检测非特异性肿瘤标志物如CgA、胰抑制素(PcSt)等,因其结果对调整治疗方案的作用不大[8]。
Ki-67是反映细胞增殖能力的标志,Ki-67表达率高的患者普遍生存期较短。2019年世界卫生组织消化系统肿瘤分级综合了Ki-67增殖指数和有丝分裂计数对肿瘤进行分类。有学者同时对103例患者的原发灶和转移灶进行Ki-67免疫组化测定,发现有1/3的患者原发灶与转移灶的Ki-67增殖指数不相同,24%的患者中转移灶Ki-67更高,而10%的患者中原发灶Ki-67更高。原发病灶为G1而转移灶为G2的患者预后与原发灶为G2的患者相似。当转移灶的分级增高时,患者的无病生存率(PFS)和总体生存率(OS)均显著降低。同时测定原发灶和转移灶的分级对患者预后评估有较大意义,可指导临床治疗[12]。
肝脏NEN在CT上常表现为肝脏内多发不均匀低密度影,内常有坏死液化区,肿瘤广泛出血坏死时可形成巨大囊实性肿块;动态增强扫描早期肿瘤为不均匀增强,扫描后期肿瘤逐步转变为等密度或低密度,常难以与血管瘤鉴别。肝脏NEN在MR上,T1W1表现为边界清楚的不均匀低信号,T2W1表现为等高信号,中心可见规则高信号区,弥散加权成像呈不均匀高信号,动态增强表现为病灶边缘厚壁强化及结节状强化,较大病灶中心可见低信号无强化区。目前在影像学上尚难区分NET和NEC,若MR显示血管侵犯及淋巴结肿大或坏死征象,则倾向于NEC诊断[13,14]。肿瘤分级越高,包膜完整性越差,肿瘤表观扩散系数(ADC)值下降[15]。本组患者的影像学表现绝大多数呈多发性(26/35),部分表现为巨块型或弥漫型(2/35),可能与诊断时病期较晚有关。本组有4例患者曾行18F-FDG PET/CT检查,在PET上表现为肝脏低密度结节影伴代谢活性增高,FDG摄取仅相对略高于周围肝实质,而囊性区在PET上无FDG摄取,病灶分隔FDG摄取亦增高不明显。因此,PET的优势在于了解全身肿瘤情况及肿瘤的代谢活性,但对于囊性病灶的诊断价值有限。另3例患者曾行ECT检查,有助于了解骨转移情况。
许多研究表明,68Ga-DOTATOC/DOTATATEPET/CT(SSTR-PET)成像比生长抑素受体闪烁显像(SRS或OctreoScan)具有更高的诊断精确性[16,17]。Binnebeek等[18]研究了53例转移性NETs(8 pNETs)患者,结果显示PET/CT的灵敏度为99.9%(95%CI:99.3~100.0),而单光子发射计算机断层成像术灵敏度仅有60%(SPECT;95%CI:48.5~70.2);肝脏和骨转移往往只有PET/CT可以检测出来。另一项研究[17]报道68Ga-DOTATATE成像灵敏度为96%(95%CI:86%~100%),SRS-SPECT成像灵敏度为72%(95%CI:58%~84%),111In-pentetreide SPECT/CT灵敏度为83%(95%CI:64%~94%)。这些研究表明,功能成像中SSTR真正阴性的pNET很少(<5%),若SRS-SPECT结果阴性,应通过SSTR-PET成像证实。通常来讲,68Ga-DOTATOC/DOTATATE摄取与分级成反比[16,18]。SSTR PET检查阴性时应考虑行病理学检查排除G3或其他诊断不明确的形态学表现。
外科手术切除是治疗NETG1和G2原发病灶的首选方法,术前评估应包括肿瘤大小、非特异性症状、内分泌功能、原发灶位置及局部侵袭情况等。肝叶切除术是治疗肝脏NEN最有效的治疗方式,部分病例经手术可完全治愈,预后良好。肝部分切除术也可用于治疗转移性肝脏神经内分泌肿瘤,可减轻转移性神经内分泌肿瘤患者的肿瘤负担,从而提高患者的生活质量和生存期,但总体预后仍取决于原发肿瘤恶性程度[19],原发肿瘤治疗同样重要[20]。对于无症状的转移性胰腺神经内分泌肿瘤,特别是体积较小的,可每3~4个月进行随访,无需进行特殊治疗[8]。Huang等[21]报道11例肝脏原发性NEN患者,接受手术切除后1年生存率为100%,1年复发率为45.5%,无病生存最长高达98个月。本组患者中,乳腺原发NEN,肝脏转移后行肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)治疗8次,生存时间超过3年。肝移植可作为部分原发性肝脏神经内分泌肿瘤患者的选择[22]。1例患者肝移植术后生存10年之久[23]。分化良好的NET(Ki-67<10%),年龄<55岁,无肝外病变,移植前切除原发肿瘤,肝移植前至少6个月病情稳定,肝受累<50%,符合以上等条件的患者也可从肝移植中获益[24-27]。由于神经内分泌肿瘤富血管且对缺血敏感,对于不能切除的肝脏NEN,TACE有一定疗效[13]。本组1例胰腺中等级别神经内分泌肿瘤伴肝、脾、结肠多发转移患者,术后2年复发,再次行胰腺断端肿瘤切除+肝转移瘤切除术,4月后肝脏出现复发灶,行2次TACE治疗,病情较稳定,生存期超过5年,提示TACE治疗具有一定疗效。
有报道,NET(G1和G2)组平均生存期明显高于NEC组(分别为63.4和17.6个月)[3]。本组绝大多数患者确诊时肝脏肿瘤负荷较大,原发肿瘤出现多处转移,且恶性程度较高,因此总体生存期较短。转移性肝脏NEN预后较差,治疗困难,近年来生长抑素类似物(somatostatin analogue,SSA)奥曲肽[28]、蛋白酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)舒尼替尼[29,30]及哺乳动物雷帕霉素靶蛋白(mam-malian target of rapamycin,mTOR)抑制剂依维莫司[31]在部分胰腺和胃肠神经内分泌肿瘤(G1、G2)中取得较好疗效,推荐使用生长抑素类似物作为进展期pNETs延缓疾病进展的一线方案,奥曲肽和兰瑞肽具有相同的作用机制,均通过结合生长抑素受体2和5发挥作用[32],但对肝脏NET的疗效有待进一步研究证实。近年来PD1/PD-L1抑制剂已被用于治疗某些肿瘤,有学者提出1%~8%GEP-NETs中PD1/PD-L1表达阳性,并与肿瘤进展相关(P<0.01),可尝试使用PD1/PD-L1抑制剂进行治疗[33]。对于本组1例胰十二指肠神经内分泌癌并肝、腹膜转移患者曾短期口服舒尼替尼治疗,但患者也曾行EP方案,CAPTEM,GT方案等方案治疗,难以评价该药的疗效。EP方案是小细胞肺癌的标准化疗方案,同时该方案也常用于肺外低分化神经内分泌癌。本研究观察到9例患者曾接受EP方案化疗,在接受化疗期间肿瘤均无明显进展,疗效达到部分缓解(partial response,PR),提示EP方案对此类患者有一定疗效。
1例胰十二指肠神经内分泌癌并肝、腹膜转移患者经EP方案化疗6周期后获得部分缓解,化疗结束后口服舒尼替尼治疗;7个月出现进展,行CAPTEM化疗2周期;病情再次出现进展后予GT方案结合奥曲肽治疗,生存期11个月,提示化疗、分子靶向药物、生长抑素类似物对肝脏NEC有一定疗效,而综合运用多种治疗方案可明显延长患者生存期。对于胰腺神经内分泌肿瘤复杂肝转移,即转移灶位于单叶,伴有对侧肝叶卫星病灶或两叶弥漫性转移的,适合在全身治疗的基础上联合肝脏局部治疗,如肝动脉栓塞术(trans-arterial embolization,TAE)、TACE或放射性微球栓塞术(trans-arterial radioembolization,TARE)等[34]。以上三者均属于动脉内治疗(intra-arterial therapy,IAT)的范畴,Ohio州立大学及Louisville大学两大医学中心[35]共选取了2000~2018年248例神经内分泌肿瘤肝转移(neuroendocrine liver metastases,NELM)患者,比较TACE与TARE的优劣,结果显示TACE和联合γ-90的TARE治疗不可切除的NELM患者耐受良好,并发症无明显差异,均安全有效。接受TARE治疗的患者住院时间更短,但TACE治疗能有效改善短期DCR,两者的长期预后具有可比性,TACE和TARE都是NELM可接受的IAT治疗方式。
高表达生长抑素受体(somatostatin receptor,SSTR)的NEN,SSA是一线治疗的选择,特别对于体积较小、侵袭性较低的肿瘤。并且,非常有必要使用SSA控制少见的内分泌紊乱症状,如血管活性肠肽、胰高血糖素分泌过多。生长抑素类似物可改善50%患者的低血糖症状,但过量用药又可导致低血糖症状,所以应仅在SSTR阳性的肿瘤患者中应用。临床经验表明SSA可以改善pNETs的激素分泌症状,尤其在血管活性肠肽瘤(VIPomas)中,奥曲肽已被FDA批准用于具有腹泻症状的VIPomas中[36]。一项包括了191例胰腺十二指肠NET的大型单中心回顾性研究分析显示SSA可以改善全身症状[37]。虽然缺乏在pNETs中使用SSA控制症状的前瞻性研究证据,但仍推荐在pNETs一线治疗中使用SSA[8]。高表达SSTR的NEN还可采用多肽-受体介导的放射性核素治疗(peptide receptor radionuclidetherapy,PRRT),以90Y或177Lu等放射性核素标记SSA,然后通过结合其受体被肿瘤细胞内吞,进入细胞的核素再释放射线杀伤肿瘤细胞。研究表明PRRT对转移性NET具有良好疗效,客观反应率可达30%~55%[38,39]。
由于缺乏前瞻性随机临床试验(RCTs)的数据,尚无支持NET G1/G2辅助治疗的证据。有研究报道依维莫司可改善胰岛素分泌过多导致的临床症状,并可抑制细胞生长[40-42]。北美胰腺神经内分泌肿瘤随访及内科治疗指南推荐对于体积较大、侵袭性较强的肿瘤和临床进展的G3 pNETs,可选择卡培他滨和替莫唑胺作为一线治疗方案。细胞毒药物化疗是新近诊断肺外NEC患者的标准治疗。虽然小细胞肺癌和肺外NEC实际上是不同的疾病,但由于两者在组织学上的相似性,既往肺外NEC治疗方案的选择多基于小细胞肺癌相关研究的证据。除小细胞肺癌相关研究外,还有一些小规模的前瞻性和回顾性研究将顺铂或卡铂联合依托泊苷作为一线治疗的方案[43,44]。推荐铂类和依托泊苷作为一线治疗方案,也可使用伊替立康替代依托泊苷[45,46]。以替莫唑胺为主的化疗方案应在G3 NETs中使用,也可用于胰腺原发神经内分泌癌的二线治疗。但事实上,在整个治疗过程中,许多患者都已接受多种药物的治疗,难以具体评价各种药物的疗效。
综上所述,NEN是一种高度异质性肿瘤,临床表现多无特异性,大多无肝炎病史,免疫组化指标如CgA、Syn等具有高度特异性和敏感性,病理学检查是确诊本病的主要依据,Ki-67可提示预后,影像学检查具有一定的特征性,诊断时应注意其他部位如消化道、肺来源的原发肿瘤,多数患者最终出现肝转移。手术切除是早期患者的首选治疗方式,对于SSTR阳性的NEN可采用SSA治疗,对于SSTR阴性或SSA治疗失败的NEN,可选择TKI、mTOR抑制剂和PRRT等全身系统性治疗,TAE、TACE和TARE等对于不能手术的患者也有一定价值,化疗对晚期或转移性肝脏NEC具有一定疗效,但疗效维持时间较短。综合治疗可延长晚期肝脏NEN患者的生存期。未来将探讨更敏感便捷的方法用于早期诊断,深入了解此类肿瘤的生物学行为有利于找到更加有效的治疗方法。
