长链非编码RNA TSI抑制TGF-β1介导的乳腺癌细胞MCF-7和BT474转移
2021-06-23谭梓聪张洋璠黄晓燕杨浩杰曹铭辉
谭梓聪,张洋璠,黄晓燕,杨浩杰,曹铭辉*
乳腺癌是目前全世界发病率最高的恶性肿瘤,其死亡率在世界范围排名第五位[1]。近年来不少针对乳腺癌治疗的研究都把关注点放在乳腺癌的转移方面,因为乳腺癌的转移和患者的生存期密切相关,乳腺癌的转移会加大治疗的难度,不利于延长患者的生存期[2,3]。因此,阐明乳腺癌转移的机制对治疗乳腺癌至关重要。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是黏附性的上皮细胞相互分离并转化为单个迁移性细胞的过程,是肿瘤发生局部侵犯和向远隔器官播散的关键步骤[4,5]。此外,EMT也与肿瘤的耐药和免疫抑制微环境的维持有关[6,7]。因此,EMT在包括乳腺癌在内的多种肿瘤的进展中起着重要作用[8]。TGF-β1是EMT的主要诱导因子之一,在癌症进展、迁移、侵袭中发挥关键作用,TGF-β信号通路被视为肿瘤EMT进展的关键通路之一[9]。已有研究表明TGF-β信号通路在乳腺癌转移中发挥着重要的作用,与乳腺癌的EMT进展息息相关[10]。除此之外,近年越来越多研究发现细胞内的非编码RNA能通过TGF-β通路调控细胞EMT过程,从而调控肿瘤细胞的转移,在乳腺癌中也有相关报道[11,12]。
长链非编码RNA(Long non-coding RNAs,LncRNAs)是指长度大于200 nt、参与多种生物学功能的不编码蛋白质的RNA分子[13,14]。LncRNAs能通过多种手段发挥生物学功能,例如,lncRNA LETN与NPM1蛋白直接结合在核仁里调控细胞增殖,Linc-SCRG1能作为microRNA miR26a的ceRNA加快肿瘤增殖,LINC00665甚至能编码肽段来影响三阴乳腺癌的进展[15-17]。Lnc-TSI在肾癌和肾脏纤维化中被报道TGF-β信号通路密切相关,在TGF-β信号通路介导的肾癌转移中发挥重要作用,但是Lnc-TSI在乳腺癌中的作用尚未被报道[18,19]。
本研究着重探讨了Lnc-TSI和TGF-β1促进乳腺癌细胞MCF-7和BT474转移之间的关系,发现TGF-β1诱导乳腺癌细胞MCF-7和BT474发生EMT的同时上调Lnc-TSI水平,敲除和过表达Lnc-TSI分别促进和抑制TGF-β1介导的乳腺癌细胞MCF-7和BT474转移。
1 材料与方法
1.1 材料
1.1.1 细胞系 MCF-7和BT474购于ATCC。
1.1.2 试剂细胞因子 TGF-β1购于培谱生物公司。E-cadherin、N-cadherin和Vimentin抗体购于CST公司。Lnc-TSI引物购于艾基公司。反转录试剂购于瑞真公司。RNA荧光定量试剂购于Takara公司。CRISPR-Cas 9敲除Lnc-TSI的慢病毒和过表达Lnc-TSI的慢病毒由南方医科大学王鹏博士赠予。
1.2 方法
1.2.1 细胞培养乳腺癌细胞 MCF-7和BT474均在含10%胎牛血清的高糖DMEM培养基中培养,其中添加浓度100 U/mg的青霉素和浓度100 mg/mL的链霉素。细胞均在条件设定为37℃、5%CO2的培养箱里培养。TGF-β1处理无特殊说明均为10 ng/mL浓度的TGF-β1连续刺激72 h。
1.2.2 Western blot 使用添加1%蛋白酶抑制剂和1%磷酸酶抑制剂的RIPA试剂冰上裂解细胞,裂解完全后在12 000 r/min速度下4℃离心30 min,用分光光度计测定浓度后在95℃下加热5 min使蛋白完全变性。变性后的蛋白样品在SDS-PAGE凝胶系统中电泳,然后使用甲醇激活的0.45μm PVDF膜转膜,按抗体说明书孵育相应一抗、二抗,在检测化学发光的显影仪器中显影。
1.2.3 qRT-PCR 细胞的总RNA通过TRIZOL提取,在Roche 480平台上按照说明书使用逆转录和荧光定量扩增试剂检测Lnc-TSI表达水平。Lnc-TSI引 物 序 列 为Forward:5′AATCTGGTGTGGACAAACGC3′,Reverse:5′AACAGATGCTTCCGAATGCC3′。
1.2.4 CRISPR-Cas9 为了利用CRISPR-Cas9基因编辑构建敲除Lnc-TSI的细胞,两个靶向Lnc-TSI的sgRNA被克隆到U6-multiple(sgRNA)-SV40-EGFP载体中。表达Cas9的载体为Lenti-Cas9-Puro载体。靶向Lnc-TSI的第一个CRISPR-Cas9系统两个sgRNA序列如下:sgRNA1,5′TTCCAGCCAGG TATCAGAGT3′,sgRNA2,5′CACTGTGGGCATCTCAACCC3′。靶向Lnc-TSI的第二个CRISPR-Cas9系统两个sgRNA序列如下:sgRNA1,5′GAGCTAATGCTGGTGCCGTG3′;sgRNA2,5′GGCTGTCGAGGCTGCAGCGA3′。根据说明书对靶细胞进行sgRNA慢病毒和Cas9慢病毒的共转染。
1.2.5 过表达Lnc-TSI 用PCR技术扩增Lnc-TSI的全长cDNA并克隆到pCDH-EF1-MCS-Puro载体中,由此合成过表达质粒。空载的pCDH-EF1-MCSPuro载体和pCDH-EF1-MCS-Puro-lnc-TSI过表达载体在含有pMD2.BSBG和PSPAX2质粒的HEK293T细胞中包装成慢病毒。按转染慢病毒试剂的说明书给细胞转染慢病毒,并且在转染后72 h用嘌呤霉素对细胞进行筛选。
1.2.6 迁移实验和侵袭实验 迁移实验时在transwell上室加入含有1×105个细胞的无血清培养基细胞悬液。TGF-β1处理组的上室细胞悬液中含有浓度为10 ng/mL的TGF-β1,PBS处理组的上室细胞悬液中含有与TGF-β1相同体积的PBS。Transwell下室添加含10%胎牛血清的高糖DMEM培养基。上下室共同孵育8 h后将细胞用4%多聚甲醛室温固定15 min,用0.1%结晶紫染色15 min。在显微镜下的五个随机视野中对穿透膜的细胞进行计数。行侵袭实验时把transwell上室用50 mL基质胶4℃包被过夜,其余步骤同迁移实验。
1.3 数据分析
利用IBMSPSSstatistics 25对本实验的数据进行统计分析,qRT-PCR和transwell实验的组间对比选用t检验。结果的P值若小于0.05则被认为有统计学差异。*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果
2.1 TGF-β1可诱导乳腺癌细胞MCF-7和BT474发生上皮-间充质转化
首先建立TGF-β1诱导乳腺癌细胞MCF-7和BT474发生EMT的细胞模型。在10 ng/mL TGF-β1处理后72 h后,乳腺癌细胞MCF-7和BT474的形态对比PBS处理组从类圆形向梭形改变(图1-A),western blot结果显示细胞中的EMT相关蛋白Ecadherin下调,N-cadherin和Vimentin上调,并且随着处理时间的增加蛋白水平变化程度加大(图1-B)。Transwell实验说明TGF-β1处理过后的乳腺癌细胞MCF-7和BT474侵袭能力增强(图1-C,1-D)。这说明MCF-7和BT474在TGF-β1刺激下发生EMT改变。
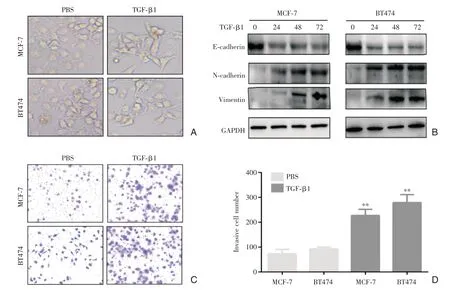
图1 TGF-β1促进乳腺癌细胞MCF-7和BT474的转移 A:用TGF-β1(10 ng/mL)处理MCF-7和BT474细胞72 h后,对比PBS处理组,细胞形态明显拉长呈纺锤形;B:用TGF-β1(10 ng/mL)处理MCF-7和BT474细胞0、24、48、72 h后,western blot检测细胞中E-cadherin、N-cadherin和Vimentin水平;C:Transwell检测用TGF-β1(10 ng/mL)处理MCF-7和BT474细胞72 h后对比PBS处理组细胞侵袭数目;D:统计transwell实验的结果(**与PBS组相比P<0.01)
2.2 TGF-β1上调乳腺癌细胞MCF-7和BT474中的Lnc-TSI表达
TGF-β1诱导乳腺癌细胞EMT细胞模型建立以后,要利用这一细胞模型探究Lnc-TSI在其中发挥的作用。首先我们研究了Lnc-TSI在乳腺癌细胞EMT过程中表达量是否发生变化。在没有TGF-β1刺激的条件下,对比正常乳腺上皮细胞MCF-10A,乳腺癌细胞MCF-7和BT474中的Lnc-TSI水平更高(图2-A),而TGF-β1处理能显著上调乳腺癌细胞MCF-7和BT474中的Lnc-TSI表达(图2-A)。在证实乳腺癌细胞EMT过程中Lnc-TSI表达上调后,通过敲除和过表达来探究Lnc-TSI在这个细胞模型中的功能。在乳腺癌细胞MCF-7和BT474中敲除Lnc-TSI,发现Lnc-TSI表达显著下调(图2-B)。在乳腺癌细胞MCF-7和BT474中过表达Lnc-TSI后,Lnc-TSI表达显著上调(图2-C)。
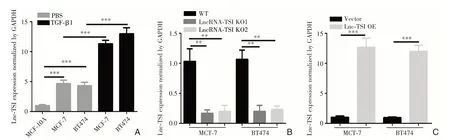
图2 Lnc-TSI在TGF-β1介导的乳腺癌细胞EMT中上调 A:qRT-PCR检测正常乳腺上皮细胞MCF-10A和TGF-β1处理后乳腺癌细胞MCF-7、BT474的Lnc-TSI表达水平(***与PBS组相比P<0.001);B:qRT-PCR检测敲除Lnc-TSI后乳腺癌细胞MCF-7、BT474中的Lnc-TSI表达水平(**与PBS组相比P<0.01);C:qRT-PCR检测过表达Lnc-TSI后乳腺癌细胞MCF-7、BT474中的Lnc-TSI表达水平(***与PBS组相比P<0.001)
2.3 Lnc-TSI抑制TGF-β1介导的乳腺癌细胞MCF-7和BT474转移
上述实验已经证明乳腺癌细胞MCF-7和BT474中敲除和过表达Lnc-TSI的效率,在此基础上通过transwell实验探究Lnc-TSI表达的改变在TGF-β1介导的乳腺癌细胞EMT模型中是否会引起表型的变化。敲除乳腺癌细胞MCF-7和BT474的Lnc-TSI后,在没有TGF-β1刺激的条件下,MCF-7和BT474细胞的侵袭迁移数目明显增加,这个现象在TGF-β1处理后的EMT模型中更加明显(图3-A)。相反,过表达Lnc-TSI能显著降低MCF-7和BT474细胞的侵袭迁移数目,在TGF-β1处理的EMT模型中更加明显(图3-B)。由此证实了在TGF-β1介导的乳腺癌细胞EMT模型中改变Lnc-TSI的表达能引起侵袭迁移表型的改变,Lnc-TSI能抑制TGF-β1介导的乳腺癌转移。
3 讨论
乳腺癌是常见于女性的恶性肿瘤,其转移的机制尚未被完全阐述清楚。已有研究报道TGF-β信号通路在乳腺癌的EMT进展中起重要作用[10]。TGF-β1是激活TGF-β信号通路的关键分子之一,因此,本研究选择使用TGF-β1作为构建乳腺癌EMT细胞模型的刺激分子[18]。Lnc-TSI在肾癌中已经被报道能通过TGF-β信号通路调控肾癌细胞EMT进展,最终影响肾癌细胞的转移。但乳腺癌的转移与Lnc-TSI的相关性尚未被报道[19]。基于上述基础,本研究在使用TGF-β1构建的乳腺癌细胞EMT模型中探究了Lnc-TSI与乳腺癌转移之间的关系。
为了说明TGF-β1能成功构建乳腺癌细胞EMT模型,本研究使用10 ng/mL的TGF-β1处理乳腺癌细胞MCF-7和BT474 72 h。从细胞形态的梭形改变,western blot检测EMT相关蛋白E-cadherin下调和N-cadherin、Vimentin上调,细胞侵袭数目增加三个方面证实MCF-7和BT474细胞发生EMT改变。在乳腺癌EMT细胞模型构建成功的前提下,实验证实Lnc-TSI的表达在TGF-β1介导的EMT过程中上调,说明TGF-β信号通路的激活会导致乳腺癌细胞MCF-7和BT474中Lnc-TSI水平升高,Lnc-TSI和TGF-β信号通路之间存在相关性。为了进一步探究Lnc-TSI是否能通过调控TGF-β信号通路对细胞的侵袭迁移表型产生影响,在MCF-7和BT474细胞中分别敲除和过表达Lnc-TSI,transwell实验证实敲除和过表达Lnc-TSI会分别增加和减少乳腺癌细胞MCF-7和BT474的侵袭迁移数目,在TGF-β1处理72 h后的MCF-7和BT474细胞中这个现象会更加明显,这反映了Lnc-TSI能抑制腺癌细胞MCF-7和BT474的EMT进程,而这种作用很大程度上又依赖于TGF-β1刺激活化的TGF-β信号通路。Lnc-TSI通过TGF-β信号通路实现了对乳腺癌MCF-7和BT474的EMT和侵袭迁移的调控。然而,本研究尚未揭示Lnc-TSI与TGF-β信号通路之间的分子联系,Lnc-TSI在乳腺癌中影响TGF-β信号通路的分子机制是否与在肾癌中报道的抑制,这些问题都将是我们下一步研究的关键。
研究普遍认为TGF-β1介导的EMT与smad蛋白家族有关,TGF-β1结合TGF-β受体激活胞内段激酶磷酸化smad2和smad3蛋白,磷酸化的smad2和smad3与smad4结合形成转录因子复合体,入核通过调控下游靶基因的表达介导细胞的EMT进程[20]。然而,TGF-β1还能通过多种其他途径调控EMT,比如MAPK通路和PI3K/AKT通路等[21]。本研究证明了长链非编码RNA Lnc-TSI与参与了TGF-β1对EMT的调控,说明非编码RNA在TGF-β1信号通路中也能发挥重要的作用。然而,包括Lnc-TSI在内的非编码RNA是否能跟通路其他下游蛋白产生联系?这个问题尚有待我们探究。
综上所述,Lnc-TSI在TGF-β1促进乳腺癌细胞MCF-7和BT474的侵袭迁移的过程中表达上调,Lnc-TSI能抑制TGF-β1介导的乳腺癌细胞MCF-7和BT474的侵袭迁移的增加。
