PDIA4基因沉默对胶质瘤细胞凋亡的影响
2021-06-23朱传华谢琳刘安民
朱传华,谢琳,刘安民
胶质瘤是神经中枢系统最常见的原发恶性肿瘤,且传统手术、化疗、放疗及目前已有的靶向治疗对胶质瘤的治疗效果不佳。目前对于胶质瘤的病因仍不清楚,因此探讨其发病机制对于胶质瘤的诊疗具有重要意义[1]。蛋白二硫键异构酶家族成员4(protein disulfide isomerase family a member 4,PDIA4)定位于细胞内质网发挥功能,参与蛋白质折叠、硫醇-二硫键交换反应和内质网应激反应。近些年来越来越多研究表明,PDIA4基因是肿瘤诊断和治疗的潜在靶标[2],但其在胶质瘤发生发展中的作用机制不明。本研究利用RNAi技术沉默PDIA4表达,探索其对胶质瘤增殖和凋亡的影响。
1 材料和方法
1.1 研究对象
人胶质瘤细胞系U251、U87、HA1800由中山大学孙逸仙纪念医院医学研究中心提供。DMEM高糖培养基、胎牛血清、细胞用青霉素/链霉素和EDTA胰酶购自美国Gibco公司;星形胶质细胞培养基购自ScienCell公司;alarma blue试剂购于Sigma公司;LipofectamineTM3000、BCA蛋白定量试剂盒、ECL化学发光试剂盒购自美国Invitrogen公司;RNA-Quick Purification Kit购自上海奕杉生物;cDNA Synthesis SuperMix和SYBR Green Master Mix购自上海翊圣生物;4%多聚甲醛、结晶紫染液购自上海碧云天生物技术有限公司;蛋白提取RIPA裂解液购自康为世纪公司;cleaved-caspase-3、cleavedcaspase-7单克隆抗体、羊抗兔二抗购自CST公司。引物由苏州泓迅生物科技公司合成,靶向PDIA4的小干扰RNA及阴性对照购自上海吉玛制药技术有限公司,siRNA序列:si-PDIA4#768 5′-GCAAGCGUUCUCCUCCAAUTT-3′,si-PDIA4#1829 5′-GCCUGGUCAUCGCCAAGAUTT-3′,siNC 5′-UUCUCCGAACGUGUCACGUTT-3′。
1.2 CGGA数据库分析
从CGGA(中国脑胶质瘤基因组图谱计划)网 站(http://cgga.org.cn/)下 载mRNAseq_693[3]和mRNAseq_325[4]的RNAseq数据及相应临床数据,使用R语言的“sva”和“limma”包进行批次校正,应用kruskal检验分析基因表达量和肿瘤级别的相关性,利用“survival”和“survminer”u语言包进行生存分析并作图,基因高表达组和低表达组通过中位值划分。
1.3 细胞培养
将胶质瘤细胞U87和U251与正常星形胶质细胞HA1800于培养箱(37℃恒温,5%CO2)中培养,U87和U251使用含100 U/mL青霉素和100μg/mL链霉素和10%胎牛血清的DMEM高糖培养基,HA1800使用星形胶质细胞培养基。每3 d消化传代一次。
1.4 RT-qPCR法检测胶质瘤细胞的PDIA4表达
将各组细胞抽提总RNA,按试剂盒说明书逆转录,获得的cDNA稀释10倍后作为模板,以GAPDH为内参,按照qPCR试剂说明书指示在BIO-RAD实时荧光定量PCR仪进行qPCR检测。PCR引物序列:
qPCR反应条件:95℃30 s;95℃5 s、60℃30 s,共40个循环。RT-qPCR的结果以2-△△Ct表示目的基因mRNA的相对表达量,△△Ct=(处理组Ct靶基因-处理组CtGAPDH)-(阴性对照组Ct靶基因-阴性对照组CtGAPDH)。
1.5 细胞转染
将5×104个/孔数目的细胞接种在6孔板上,待细胞融合度达到70%时,按照转染试剂说明书转染细胞。将未转染细胞、转染siNC、转染siPDIA4 768、转染siPDIA4 1829的细胞分别称为:空白组、阴性对照组、si#768组和si#1829组。
1.6 蛋白免疫印记实验检测细胞蛋白水平
收集各组转染48 h后的细胞,使用RIPA裂解液冰上裂解15 min,离心后取上清使用BCA试剂盒蛋白定量,校准蛋白浓度后与蛋白上样缓冲液混匀于100℃孵育10 min,凝胶电泳后通过电泳转膜至PVDF膜,5%脱脂牛奶封闭1 h,加一抗(1∶1000)于4℃孵育过夜;TBST洗膜后加二抗(1∶5000)室温孵育1 h,TBST洗膜后用ECL荧光发光试剂盒显影,凝胶成像系统拍摄分析,使用Image J软件分析条带灰度值。
1.7 阿尔玛蓝(alarma blue)实验检测胶质瘤细胞的增殖能力
收集转染8 h后的细胞,以2×103个/孔的细胞密度分别接种于96孔平底细胞培养板中。细胞分别继续培养1 d、3 d、5 d后用每孔换alarma blue工作液100μL,37℃细胞培养箱孵育1 h后,在酶标仪上检测吸收波长530 nm,发射波长590 nm的荧光强度。
1.8 克隆形成实验检测细胞克隆集落形成数目
收集转染8 h后的细胞,以2×103个/孔的细胞密度分别接种于6孔细胞培养板中,细胞培养14 d后,4%多聚甲醛溶液固定15 min,500μL结晶紫染液染色15 min,清洗烘干后拍照计数。
1.9 流式细胞术检测细胞凋亡率
各组细胞转染24 h后换完全培养基培养48 h,收集细胞和上清,PBS重悬后离心收集细胞,用含5μL Annexin V-FITC和10μL PI染料的凋亡染色缓冲液重悬细胞,室温避光孵育20 min,流式上机检测FITC和PI通道相应的信号值。
1.10 统计学方法
以上所有实验均重复3次。使用Graphpad Prism 8.0及SPSS 25.0对实验数据进行统计分析和图片绘图。数据用均数±标准差表示,组间均数比较用单因素方差分析,两组之间比较采用t检验,生存分析应用Log-rank检验。检验水准α=0.05。
2 结果
2.1 CGGA数据分析验证PDIA4基因与胶质瘤级别和不良预后相关
PDIA4表达水平在WHOⅡ-Ⅳ级胶质瘤中分别为4.37±0.77、4.80±0.83和5.60±0.94,差异有统计学意义(F=140.58,P<0.05),kruskal检验分析PDIA4表达量和胶质瘤级别的具有相关性(P<0.05)。用LSD-t法进行两两比较WHOⅡ级与WHOⅢ级相比、WHOⅢ级与WHOⅣ相比(均P<0.05),差异有统计学意义(图1A)。Kaplan-Meier生存分析PDIA4高表达组5年生存率16.23%,PDIA4低表达组60.20%,Log-rank检验(Log-rank=264.32,P<0.001),两组生存差异有统计学意义(图1B)。
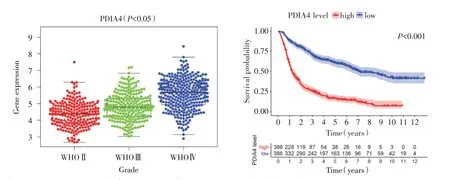
图1 CGGA胶质瘤数据中PDIA4的表达水平与胶质瘤级别和总体生存期的关系 A:各级别胶质瘤PDIA4的表达水平;B:PDIA4高表达和低表达组的总生存曲线
2.2 在胶质瘤细胞系中验证PDIA4表达差异
胶质瘤细胞株U251和U87相对于正常星形胶质细胞株HA1800的2-△△Ct值分别是3.03±0.38和1.87±8.35,差异具有统计学意义(F=58.44,P<0.05)。多重比较显示,U251和U87的PDIA4表达水平均高于HA1800(均P<0.05),且U251要高于U87(P<0.05),故选择U251进行后续实验。
2.3 PDIA4沉默效果验证
相比于空白组和阴性对照组,si#768组和si#1829组细胞PDIA4蛋白表达量降低(F=92.63,P<0.001)(图2,表1),差异有统计学意义。多重比较显示si#768组和si#1829组的PDIA4蛋白表达量均低于空白组和对照组(均P<0.001),且si#768组和si#1829组之间,空白组和阴性对照组之间的差异均无统计学意义(均P>0.05)。
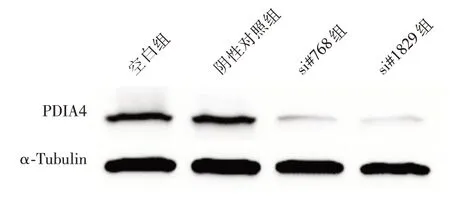
图2 蛋白免疫印记实验检测siRNA沉默效果

表1 PDIA4在细胞株中敲降效果验证(n=3)
2.4 沉默PDIA4抑制胶质瘤细胞增殖
si#768组和si#1829组细胞增殖速度均低于空白组和阴性对照组(图3),第5d各组的荧光强度:空白组(300.00±4.53)、阴性对照组(282.33±2.71)、si#768组(108.67±8.45)、si#1829组(42.00±.0.65)(F=487.59,P<0.01)。多重比较显示si#768组和si#1829组的荧光强度均低于空白组和对照组(均P<0.01),且空白组和阴性对照组之间的差异无统计学意义(P>0.05),si#768组和si#1829组之间差异有统计学意义(P<0.05)。
2.5 沉默PDIA4抑制胶质瘤细胞克隆集落形成
si#768组(158.00±55.15)和si#1829组(110.50±11.92)的克隆集落形成数目明显低于空白组(393.00±96.15)和阴性对照组(382.50±82.84)(F=49.34,P<0.05),差异具有统计学意义(图4A,B)。多重比较显示si#768组和si#1829组的克隆集落形成数目均低于空白组和对照组(均P<0.001),且si#768组和si#1829组之间,空白组和阴性对照组之间的差异均无统计学意义(均P>0.05)。

图3 阿尔玛蓝实验检测各组细胞的增殖水平 与空白组和阴性对照组比较,**P<0.01,***P<0.001)
2.6 沉默PDIA4促进胶质瘤细胞凋亡
空白组、阴性对照组、si#768组和si#1829组凋亡率分别为(3.72±7.11)%、(6.53±0.13)%、(7.67±0.11)%、(19.50±9.30)%,si#768组和si#1829组细胞凋亡比例高于空白组和阴性对照组(F=51.06,P<0.05),差异具有统计学意义(图5)。多重比较显示si#768组和si#1829组的细胞凋亡比例均高于空白组和对照组(均P<0.05),且si#768组和si#1829组之间,空白组和阴性对照组之间的差异均无统计学意义(均P>0.05)。

图4 克隆形成实验检测各组细胞克隆形成能力 A:各组细胞克隆集落扫描图;B:各组细胞克隆形成集落计数统计图(mean±SD,n=3,**与空白组和阴性对照组比较,P<0.01,***与空白组和阴性对照组比较,P<0.001)

图5 流式细胞仪检测各组细胞的凋亡情况
2.7 沉默PDIA4后Caspase通路激活
相比于阴性对照组,si#768组和si#1829组cleaved-caspase 3、cleaved-caspase 7表达量均有升高(图6,表2),cleaved-caspase 3表达水平差异有统计学意义(F=19.58,P<0.05),cleaved-caspase7表达水平差异有统计学意义(F=12.61,P<0.05)。多重比较显示,si#768组和si#1829组cleaved-caspase 3和cleaved-caspase 7表达水平均高于阴性对照组(均P<0.05),差异有统计学意义。
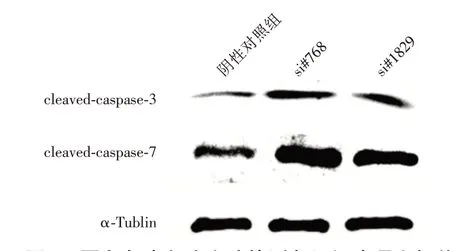
图6 蛋白免疫印迹实验检测各组细胞凋亡相关蛋白表达情况

表2 不同处理组凋亡相关蛋白相对表达量(n=3)
3 讨论
本研究分析CGGA数据库,发现PDIA4表达水平胶质瘤级别相关,且其表达水平越高,患者预后越差,这与先前研究报道的结果相符[5]。胶质瘤的发生是一个多因素参与的病理过程,因其分子机制多样性[6],导致治疗和预后不理想。作为在多种肿瘤中均高表达的蛋白,PDIA4能发挥分子伴侣的功能[7],促进蛋白质合成,这恰是肿瘤细胞快速增殖所需要的,提示PDIA4在肿瘤的发生和发展中可能具有重要作用。后续实验发现PDIA4在胶质瘤细胞中高表达,表明PDIA4可能是胶质瘤的特异性分子标记物。
进一步研究PDIA4在胶质瘤中发挥的功能,通过siRNA沉默胶质瘤细胞的PDIA4表达后,观察到细胞增殖减慢,Yao等[8]在卵巢癌研究发现类似的现象,表明PDIA4高表达是胶质瘤细胞快速增殖所需要的。有研究证实PDIA4是前列腺癌细胞凋亡的负调控因子[9],我们的研究发现沉默PDIA4的胶质瘤细胞凋亡比例升高,这提示PDIA4可能也参与了胶质瘤细胞凋亡进程。
细胞凋亡是细胞在多种基因调控下,用于维持细胞稳态的程序性自杀模式[10]。为进一步探索下游机制,检测发现实验组的cleaved-caspase 3、cleavedcaspase 7表达均有升高,而caspase 3和caspase 7是经典凋亡通路的观察指标,作为细胞凋亡的主要执行者,需要通过蛋白水解形成剪切体发挥功能,启动细胞凋亡。由此推测,沉默PDIA4可能通过激活caspase通路来促进胶质瘤细胞凋亡。
综上所述,沉默PDIA4可以明显抑制胶质瘤细胞的增殖,促进细胞凋亡,其机制可能是通过激活caspase通路,但是对于否有其他信号通路参与仍需要进行更深入的研究。同时本研究仍存在明显的不足:首先实验仅进行了沉默PDIA4,没有进行过表达实验,也未在正常胶质细胞中进行实验,难以明确基因基本功能;其次,仅在数据库和细胞水平对该基因进行功能探索,缺少确实的临床数据和动物实验,未来的研究需要对其进一步的完善。
