杨梅素衍生物对A549细胞的抑制作用
2021-06-18陈付凉孙新苑
孙 利,陈付凉,孙新苑,孙 谦,江 浩*
(1蚌埠医学院第一附属医院肿瘤放疗科,蚌埠 233004;2安徽省慢性疾病免疫学重点实验室;3中国医学科学院血液学研究所,中国医学科学院血液病医院;*通讯作者,E-mail:jianghao1223@163.com)
肺癌是最常见的人类恶性肿瘤之一,其死亡率在与癌症相关的死亡原因中排名第一[1]。根据组织学特征,肺癌可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中NSCLC约占80%以上[2]。迄今为止,虽然肿瘤靶向治疗和免疫治疗大大提高了NSCLC的治疗水平,延长了肺癌患者的寿命[3,4],但大多数晚期肺癌仍不能达到很好的治疗效果。因此,传统化疗仍发挥重要作用,筛选具有足够肿瘤敏感性的药物对非小细胞肺癌的治疗具有深远意义。许多天然产物及其衍生物是药物研发的主要来源,其中的生物活性成分不仅可以增强化疗的疗效,在一些情况下还能改善化疗药物的某些副作用[5]。杨梅素是从杨梅中分离出来的一种天然的黄酮类化合物,存在于许多植物中,包括浆果、葡萄、草药、茶等。在过去的10年里,大量的证据表明杨梅素作为一种抗肿瘤、抗炎和抗氧化剂具有良好的生物活性[6-8]。在涉及多种类型癌细胞的研究中,杨梅素被证明可以抑制癌细胞(如肝癌、直肠癌、皮肤癌、肺癌等)的增殖、侵袭和转移,诱导癌细胞的细胞周期阻滞和凋亡[9,10]。有研究表明杨梅素还有放疗增敏的作用[11],这些发现提高了人们对杨梅素作为一种潜在的肿瘤抑制剂的兴趣。本研究通过对杨梅素进行修饰,旨在研究杨梅素衍生物对NSCLC细胞增殖和凋亡的影响,并进一步探讨放疗增敏情况。
1 材料和方法
1.1 杨梅素衍生物的合成
本文所用杨梅素衍生物来源于贵州大学薛伟教授及其团队。杨梅素衍生物采用半合成法通过以下六个步骤进行修饰合成:用甲基碘保护杨梅苷的羟基;暴露它的3个羟基;合成1,4-二溴丁烷;用1-叔丁氧羰基-4-甲氨基哌啶取代末端溴;去除叔丁氧羰基;与磺酰氯反应得到化合物。经过分离提纯后将杨梅素衍生物溶解在DMSO中备用。
1.2 细胞株及主要试剂
A549细胞(ATCC,美国);DMEM培养基、胎牛血清(HyClone,美国);青霉素/链霉素(Gibco,美国)CCK-8、细胞凋亡试剂盒(碧云天生物试剂公司,中国);Ki67、DAPI抗体、吉姆萨染液(Sigma,美国);Transwell小室、Matrigel基质胶(Corning,美国);Bcl-2、Bax、P53、cleaved Caspase-3蛋白抗体(CST,美国)。
1.3 细胞培养
A549细胞在含10%的胎牛血清和1%青霉素/链霉素的DMEM中培养,于37 ℃、5%的CO2细胞培养箱中孵育。
1.4 CCK-8实验检测细胞活力
首先取对数生长期的A549细胞(3×104/ml)接种于96孔板。用培养基对杨梅素衍生物进行稀释,最终浓度为1,6,10 μmol/L,分别孵育24 h和48 h,共进行了3次重复试验,每组设有6个复孔,DMSO作为对照,孵育结束后每孔加入10 μl的WST-8,1 h后用酶标仪单波长模式测定吸光度,检测波长450 nm,参考波长630 nm。细胞活力公式:ODtest/ODcontrol×100%,半数抑制率IC50由GraphpadPrism得出。
1.5 Ki67检测细胞增殖指数
将生长状态良好的A549细胞(3×105/ml)接种于24孔板,加入6 μmol/L的杨梅素衍生物并孵育12 h。PBS洗涤3次,PFA固定10 min。加入0.1% Triton/PBS后,滴加1%牛血清白蛋白(BSA)封闭1 h,用鼠抗人的Ki67抗体(1 ∶200稀释)4 ℃孵育过夜。再将细胞与山羊抗鼠抗体(1 ∶2 000稀释)孵育1 h,DAPI(10 μg/ml)复染核后,用荧光显微镜观察。
1.6 Transwell实验检测细胞侵袭能力
将基质凝胶(5 mg/L)涂于腔内膜的上表面,室温风干后,用含1% BSA无血清培养基水化基底膜(37 ℃孵育30 min),将细胞(1×105/ml)接种于上室,下室填充含5%胎牛血清的DMEM培养基。加入6 μmol/L的杨梅素衍生物培养12 h后,用棉签擦拭上膜层细胞,侵袭细胞用4%多聚甲醛固定20 min,苏木精和伊红染液(HE)染色,PBS洗3次,晾干后荧光显微镜下进行观察计数。
1.7 Annexin Ⅴ-FITC/PI双染检测细胞凋亡
将对数生长期的A549细胞(1×106/ml)接种到6孔板中。待细胞培养贴壁后,更换培养基,加入6 μmol/L的杨梅素衍生物培养12 h。PBS洗涤后用0.5 ml不含EDTA的胰酶消化,终止消化后离心去上清并用1 ml PBS重悬至1.5 ml EP管中。再次离心加入200 μl结合液轻轻重悬后加入Annexin Ⅴ-FITC和PI。室温避光孵育15 min,尼龙网过滤后流式细胞仪上机检测。
1.8 Western blot检测Bcl-2、Bax、P53、cleaved Caspase-3的表达
将对数生长期的A549细胞(2×105/ml)接种到6孔板中,待细胞培养贴壁后,更换培养基,加入6 μmol/L的杨梅素衍生物培养12 h,每孔加入50 μl RIPA蛋白裂解液,离心取上清后,用BCA蛋白定量法测定蛋白浓度并用沸水煮至10 min,加入Loading buffer上样缓冲液离心5 min。按计算得到的所需样本量加入到凝胶孔中,电压调至80 V,待溴酚蓝进入分离胶且条带清晰分离时,将电压调至120 V,待溴酚蓝进入电泳液终止并在200 mA电流下进行转模,室温下封闭30 min。按1 ∶1 000的比例分别稀释β-actin、Bcl-2、Bax、P53、cleaved Caspase-3一抗,摇床摇晃4 ℃过夜。TPBS 1 ∶5 000稀释二抗后,进行显影。
1.9 集落形成实验检测药物的放射增敏效果
将不同密度(100,200,300,500,1 000个细胞)的A549细胞种于6孔板上,培养24 h。细胞贴壁后加入1.2 μmol/L接近IC20浓度的杨梅素衍生物孵育24 h。然后用0,2,4,6,8 Gy的剂量对细胞进行照射,正常条件下培养14 d。当细胞生长到肉眼可见的集落后,甲醇室温下固定15 min,Giemsa染液染色20 min。通过计算菌落存活率来评价杨梅素衍生物的放射增敏效果。用GraphPad Prism 8根据多靶单击模型(S=1-(1-e-D/D0)N)拟合细胞存活曲线,计算辐射敏感性参数SER。
1.10 统计学分析

2 结果
2.1 杨梅素衍生物对A549细胞活力的影响
杨梅素衍生物溶解在DMSO中,其化学式见图1。荧光显微镜下观察细胞,用杨梅素衍生物处理后,无论24 h还是48 h,当药物浓度为6 μmol/L时A549细胞形态发生明显的变化,细胞变圆皱缩,细胞数量减少,这一现象在48 h观察时更为明显。用CCK-8试剂检测细胞活力,药物24 h的IC50为5.65 μmol/L。与DMSO对照相比,细胞在与6 μmol/L杨梅素衍生物孵育后,细胞活力显著抑制(P<0.001,见图2)。
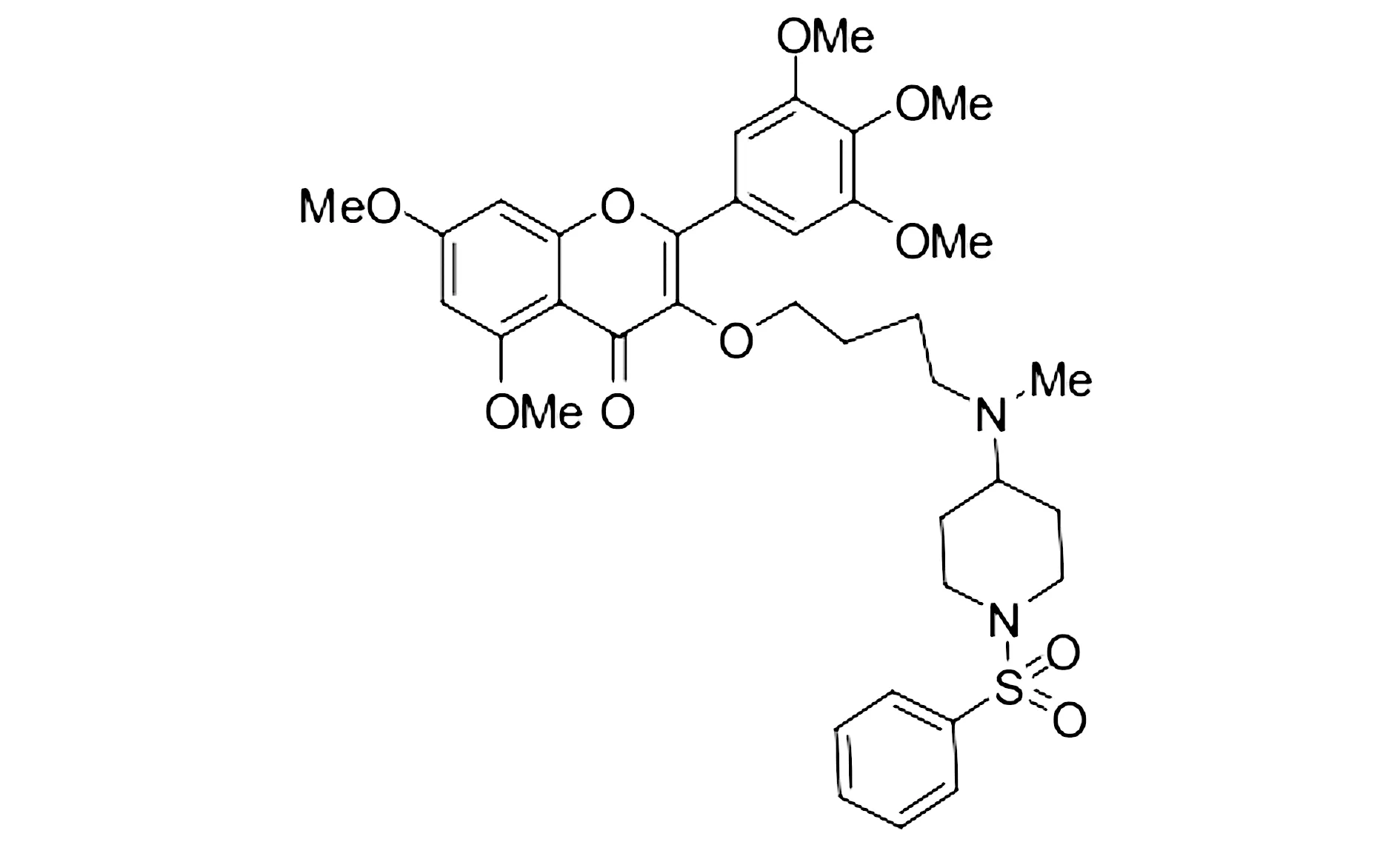
5,7-二甲氧基-3-(4-(甲基(1-(苯磺酰基)哌淀基)氨基)丁氧基)-2-(3,4,5-三甲氧基苯基)-4H-色烯-4-酮图1 杨梅素衍生物的结构式Figure 1 Structural formula of the myricetin derivative
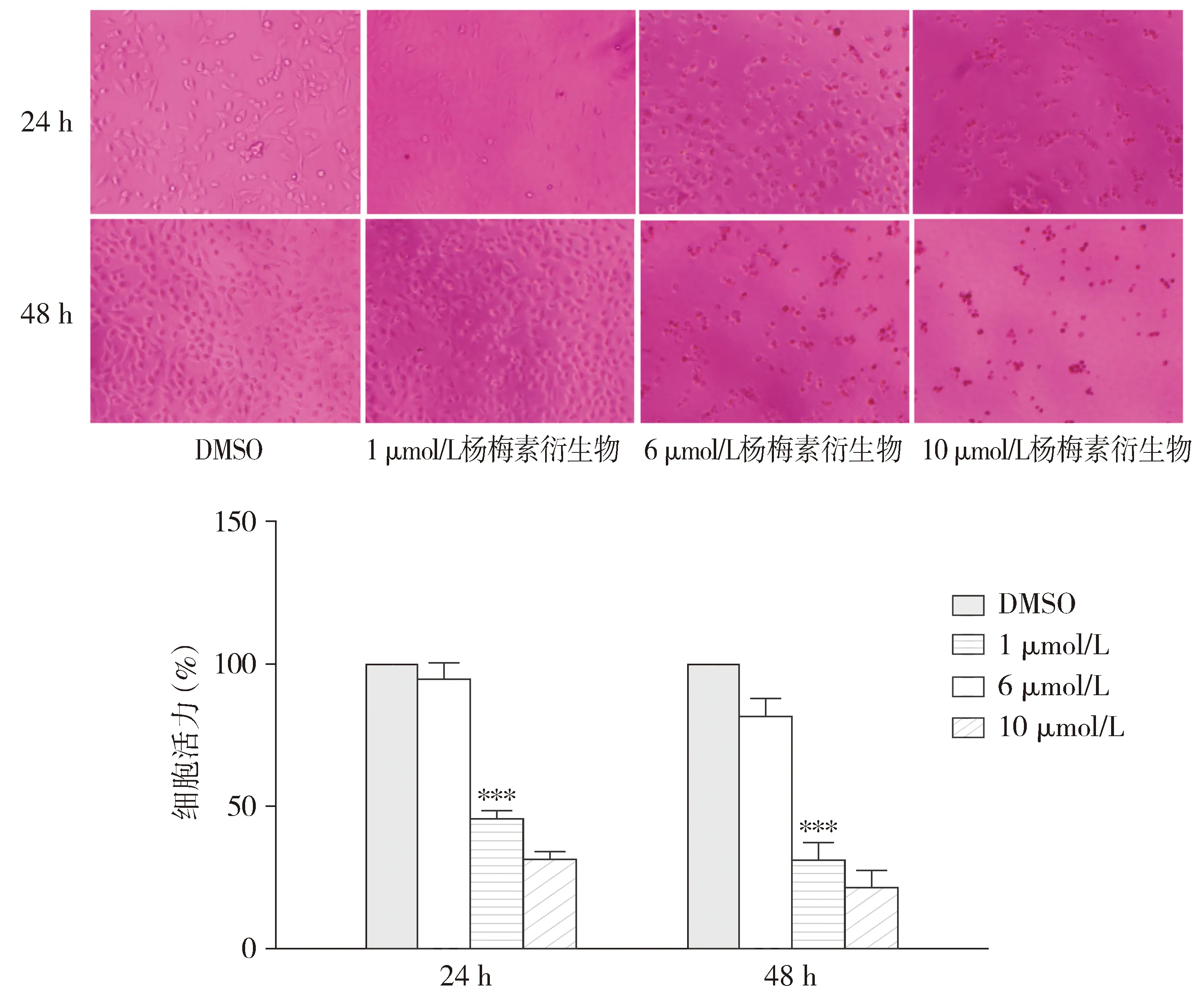
与DMSO对照组比较,***P<0.001图2 不同浓度的杨梅素衍生物对A549细胞活力的影响Figure 2 Effects of different concentrations of the myricetin derivative on A549 cell viability
2.2 杨梅素衍生物对A549细胞增殖指数的影响
Ki67免疫荧光试验结果显示,与DMSO对照相比,6 μmol/L杨梅素衍生物处理12 h后,Ki67阳性细胞数明显减少(P<0.01,见图3)。

图3 杨梅素衍生物对A549细胞增殖指数的影响Figure 3 Effects of the myricetin derivative on A549 cell proliferation index
2.3 杨梅素衍生物对A549细胞侵袭能力的影响
Transwell检测结果显示,与DMSO对照相比,杨梅素衍生物有效抑制A549细胞的侵袭能力(P<0.001,见图4)。
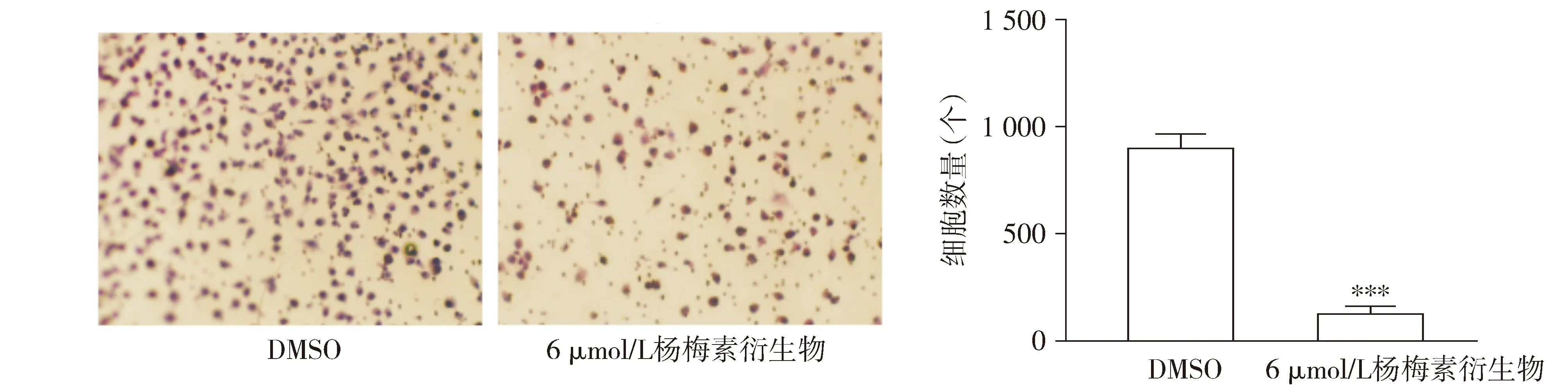
与DMSO对照组比较,***P<0.001图4 杨梅素衍生物对A549细胞侵袭能力的影响Figure 4 Effect of the myricetin derivative on the invasion ability of A549 cells
2.4 杨梅素衍生物对A549细胞凋亡的影响
流式结果显示,当用6 μmol/L杨梅素衍生物培养12 h后,细胞的凋亡率为(22.5±4.5)%,与DMSO对照组相比有明显的的提高(P<0.05,见图5)。

与DMSO对照组相比,*P<0.05图5 杨梅素衍生物对A549细胞凋亡的影响Figure 5 Effect of the myricetin derivative on the apoptosis of A549 cells
2.5 杨梅素衍生物对A549细胞凋亡相关蛋白表达的影响
Western blot结果显示,杨梅素衍生物可上调Bax/Bcl-2蛋白的表达量(P<0.001),下调P53蛋白的表达(P<0.001),同时使cleaved Caspase-3的表达显著增高(P<0.001,见图6)。
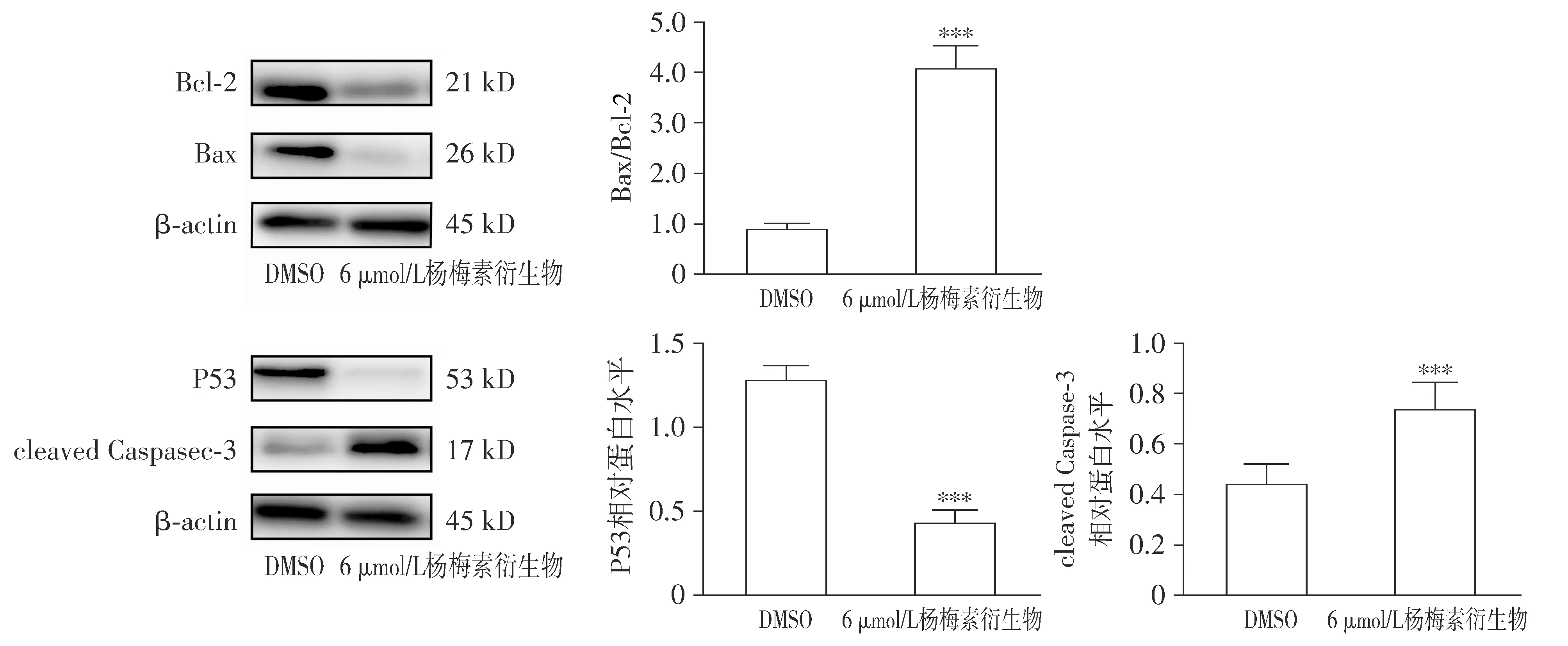
与DMSO对照组比较,***P<0.001图6 杨梅素衍生物对A549细胞凋亡相关蛋白表达的影响Figure 6 Effects of the myricetin derivative on the expression of apoptosis-related proteins in A549
2.6 杨梅素衍生物对A549细胞的放射增敏效果
集落形成实验显示,与DMSO对照组相比,杨梅素衍生物联合放疗可有效降低细胞的存活分数,同时放射增敏参数SER达到1.31(见图7)。

图7 杨梅素衍生物对A549细胞放射增敏的影响Figure 7 Effects of the myricetin derivative on radiosensitization of A549 cells
3 讨论
肺癌是全世界癌症相关死亡的最常见原因,且预后一直很差。然而,在过去的10年里,肺癌治疗取得了重要的进步,如精准医疗等现有医疗的广阔前景,给肺癌的治疗带来了诸多机遇。这也使肺癌的生存率得到了初步提高。但是对于一些亚群,如表现欠佳的患者和老年患者,新的靶向治疗还没有建立完整框架[12,13]。因此,基于新的治疗手段的局限性及传统化疗的特点,研发对肺癌敏感的药物有深远意义。杨梅素作为一种黄酮类化合物广泛存在大自然中。近年来,对于杨梅素的抗肿瘤作用及分子机制研究较多,可作为药物研发的重要来源[10,14]。
本研究通过对杨梅素进行修饰,并在A549细胞上进行验证,探讨其抗肿瘤活性及基本机制。结果发现,修饰后的杨梅素对A549细胞增殖有明显的抑制作用。先前的研究表明,杨梅素在肝癌、顺铂耐药的卵巢癌等肿瘤中有较明显的抗增殖作用[15,16],相比之下,修饰后的杨梅素抗增殖作用有了进一步提高。同时,细胞侵袭能力显著下降。Zhao等[17]研究发现在多形性胶质母细胞瘤U-87细胞中,杨梅素通过与PI3K/Akt和JNK信号直接结合从而抑制PI3K催化异构体的活性,进而减少局部粘连,膜折叠和血管生成,最终抑制细胞入侵和转移行为。
细胞凋亡是多细胞生物中破坏和异常细胞被清除的有序生化过程,是一种调控细胞死亡的形式[18]。本研究结果表明杨梅素衍生物促进了细胞凋亡比率,同时诱导凋亡相关蛋白的表达。阐明在特定人类癌症的特定条件下如何调控细胞凋亡,可能有助于开发新的抗肿瘤药物。一系列研究已经证明了杨梅素可促进癌细胞凋亡,提示有可能用于肿瘤的促凋亡治疗。OVCAR-3和A2780/CP70顺铂耐药卵巢癌细胞株对杨梅素的细胞毒性作用比正常的IOSE-364卵巢癌细胞更敏感,可通过Bcl-2和p53相关途径选择性的抑制肿瘤细胞生长[19]。杨梅素作用后,Bcl-2蛋白家族通过对线粒体膜通透性完整性的影响和促凋亡蛋白Bcl-2相关X蛋白(Bax)、Bcl-2拮抗剂/杀伤剂(Bak)等的释放,以及cleaved Caspase-3激活Caspase-3级联反应参与内在凋亡途径[20]。同样,在人肝癌HepG2细胞中,杨梅素通过增加Bax/Bcl-2比值、激活Caspase-3、诱导细胞色素C线粒体的释放诱导凋亡,同时还可通过降低磷酸化水平诱导Akt/P70s6k/Bad信号相关的细胞凋亡[21]。
放射治疗(RT)是目前肿瘤治疗的主要手段之一,在所有肿瘤患者中有超过50%的人在治疗过程中的关键节点,都会选择接受放射治疗[22]。然而,高剂量放疗时对瘤旁正常组织的损伤等问题,严重限制肿瘤放射治疗的效果。因此,如何提高肿瘤细胞的放射敏感性、特异性及增加肿瘤组织的局部放射剂量已成为目前肿瘤放疗研究的热点和重点,应用放疗增敏剂是常见的提高放射治疗效果的方法。Zhang等[11]研究表明杨梅素联合放疗对A549细胞及H1299细胞有放射增敏作用。本研究采用IC20浓度的杨梅素衍生物作为放射增敏的验证,以排除药物本身的杀伤作用,并观察到细胞的存活曲线相对于对照组有明显的下移。这个结果为杨梅素在同步放化疗中的应用做了初步的尝试。
综上,杨梅素衍生物不仅对非小细胞肺癌细胞A549的增殖及侵袭有抑制作用,促进细胞凋亡,诱导凋亡相关蛋白的表达,同时可作为放射增敏剂增加放疗疗效。
