捻转血矛线虫疫苗候选抗原H11亚型基因的序列结构及启动子活性分析
2021-06-17段丽君张红丽周前进陈学秋杜爱芳
杨 怡,段丽君,张红丽,周前进,陈学秋,杜爱芳*
(1.浙江大学 动物科学学院 浙江省动物预防医学重点实验室,浙江 杭州 310058;2.宁波市海曙区畜牧兽医技术管理服务站,浙江 宁波 315000;3.浙江省动物疫病预防控制中心,浙江 杭州 310058;4.宁波大学 海洋学院,浙江 宁波 315211)
捻转血矛线虫(Haemonchuscontortus)寄生于牛、羊等反刍动物真胃,引起宿主贫血、营养不良甚至死亡[1]。目前该病的防治主要依赖抗虫药物的使用,但耐药性问题日益突出[2],迫切需要研发新型绿色环保的防控措施[3]。疫苗研发是当前捻转血矛线虫病防控方法中热门的研究方向之一。捻转血矛线虫微粒体氨肽酶H11是现阶段最有效的疫苗候选抗原之一。H11天然提取物具有出色的抗虫效果[4-5],但体外重组蛋白却不能诱导有效的免疫保护[6],这可能与H11蛋白特殊的空间构象及存在多个亚型密切相关。
研究证实H11存在多种蛋白亚型,包括H11-1、H11-2、H11-3和H11-4等[7]。本实验室最先分离获得的H11(H11-3)亚型基因完整ORF为2 919 bp,编码972个氨基酸,基因组大小为14 959 bp,拥有25个外显子和24个内含子[8];后续也获得了H11-4的ORF,大小为 2 916 bp,编码971个氨基酸[9]。研究发现,利用昆虫细胞与大肠杆菌表达系统获得的H11(H11-3)重组蛋白免疫山羊后,产生的抗体能与天然H11发生交叉反应,但免疫保护力低,不能提供针对捻转血矛线虫感染的有效保护,没有实际应用价值[10]。利用RNAi技术对感染性L3幼虫进行H11干扰处理,再感染捻转四矛线虫山羊粪便虫卵量减少57%、虫荷减少40%,这表明单一的H11亚型可能不能提供完全的免疫保护[11],但是仍有作为疫苗候选抗原的潜力。因此,本研究克隆了H11亚型基因的完整ORF及DNA序列,利用生物学信息学方法比对分析了各亚型基因的序列结构及剪接模式,并鉴定了各亚型基因的5′侧翼区及其启动转录活性,以期为进一步明确H11参与免疫保护的机制及研发高效重组疫苗奠定基础。
1 材料与方法
1.1 试验材料虫株、菌株及质粒:捻转血矛线虫(Haemonchuscontortus)ZJ株及秀丽线虫(Caenorhabditiselegans)N2野生株由本实验室传代保存,E.coliTOP10及尿嘧啶突变体OP50菌种由本实验室保存;pPD95.77(带绿色荧光蛋白GFP)与pRF4质粒(带roller表型)由中科院遗传与生物发育学研究室杨崇林研究员惠赠。
主要试剂:pMD18-T Vector、pMD18-T simple Vector、DNA抽提试剂盒、LA Taq酶、限制性内切酶、连接酶、Genome Walking Kit等均购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、质粒DNA小抽试剂盒购自Axygen Scientific Inc.;TRIzol(Invitrogen)、Reverse Transcript Kit(TOYOBO)和Super Taq酶购自上海申能博彩生物科技有限公司。
1.2 H11亚型基因ORF序列扩增用TRIzol提取捻转血矛线虫ZJ株总RNA,反转录合成cDNA作为模板,参考已公布的H11-1(AJ249941.1)、H11-2(AJ249942.2)cDNA序列设计特异性引物,选用TaKaRa LA Taq进行PCR扩增,产物经鉴定后测序分析。PCR反应程序:94℃预变性2 min;94℃ 45 s,t退火30 s,68℃ 1 min,共30个循环;68℃延伸10 min。引物、退火温度、延伸时间及扩增片段见表1。
1.3 DNA序列扩增参考本实验室已发现的H11-3基因结构特点[8]及已获得的H11-1、H11-2、H11-4[9]ORF序列,推测3个亚型与H11-3具有相似的基因结构与外显子大小分布。根据预测的外显子设计特异性引物或根据已获得的序列设计基因步移引物进行多段连续扩增,扩增顺序按图1进行。H11-1、H11-2、H11-4分别分4,7,5个片段进行扩增,相邻片段之间含有部分重叠序列,经拼接后获得完整DNA序列。
用DNA抽提试剂盒提取捻转血矛线虫ZJ株的基因组DNA为模板,选用TaKaRa LA Taq进行PCR扩增,H11-1部分基因序列由基因步移获得,产物经鉴定后测序分析。PCR反应程序参照1.2,基因步移参照Genome Walking Kit操作说明书进行。引物、退火温度、延伸时间及扩增片段见表1。
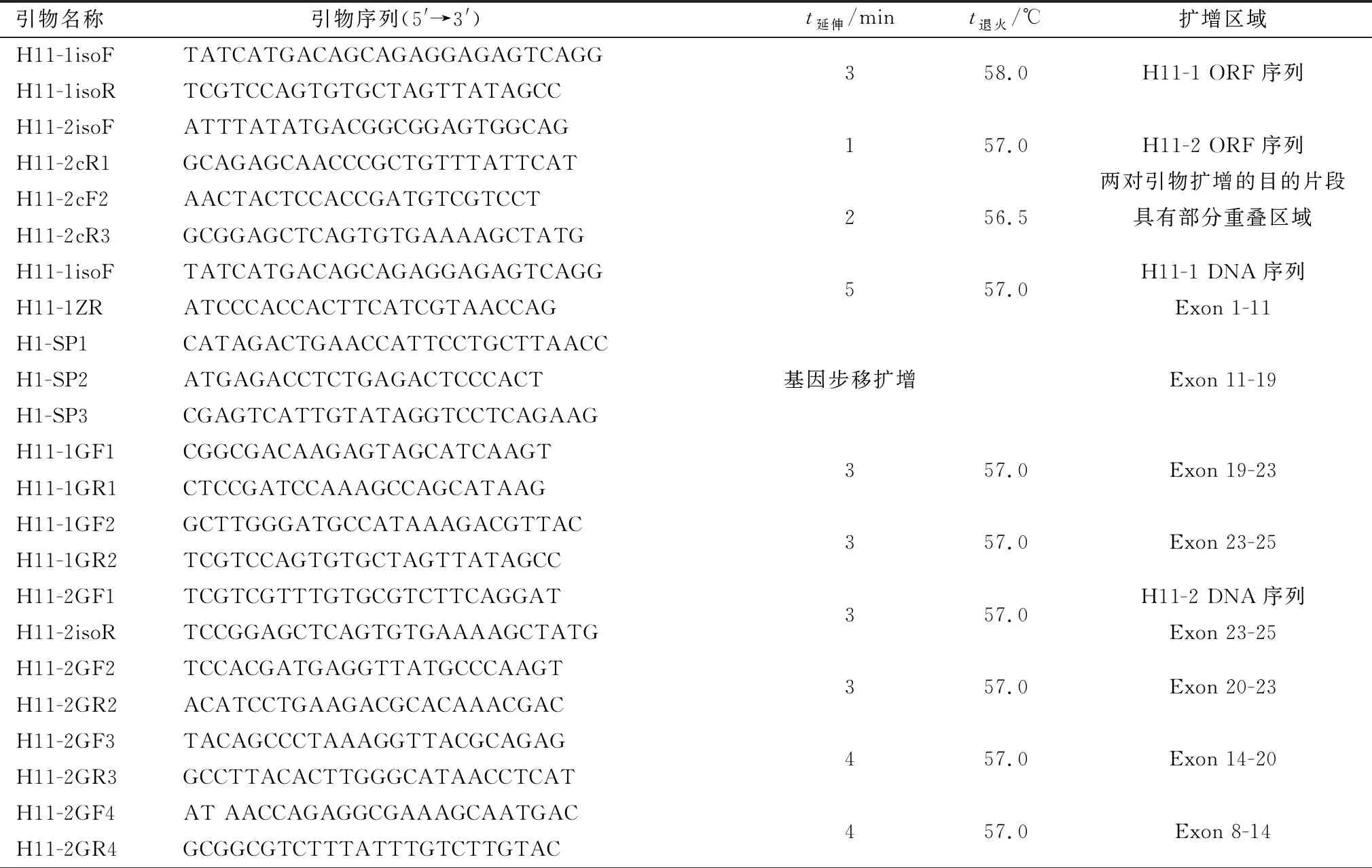
表1 H11亚型基因ORF及DNA序列扩增引物及相关信息
1.4 5′侧翼区序列扩增参考已获得的H11-1、H11-2、H11-4 DNA序列,在第1个与第2个外显子之间设计3条同向的特异性下游引物flanking-sp1/flanking-sp2/flanking-sp3,结合Genome Walking Kit中的兼并引物AP3或者AP4,利用基因步移技术扩增H11亚型基因5′侧翼区序列。引物及扩增片段见表2。

表2 H11亚型基因5′侧翼区序列扩增及重组质粒构建引物
1.5 生物信息学分析将获得的H11-1、H11-2、H11-4序列,经NCBI和寄生性线虫基因组学常用数据库(http://www.nematode.net/Speicies.Summaries/Haemonchus.contortus/index.php,http://www.sanger.ac.uk/cgi-bin/blast/submitblast/h_contortus)进行Blast分析;利用DNAStar TMHMM-2.0预测蛋白质结构;利用NetNGlyc预测糖基化位点;利用MEGA对H11-3及本研究中获得的3个亚型基因进行同源性分析;对获得的ORF及DNA序列进行比对分析其外显子、内含子等结构以及剪接识别序列;利用TESS (http://www.cbil.upenn.edu/tess)对H11-1、H11-2、H11-4基因5′侧翼区序列进行启动子基序分析。
1.6 5′侧翼区启动转录活性分析将H11-1、H11-2、H11-4基因5′侧翼区序列连接至pPD95.77载体,构建带GFP的重组质粒。挑取秀丽线虫N2野生株四期幼虫至新的NGM培养基中,待其发育至子宫内含有单排虫卵的成虫时,将重组表达质粒与pRF4质粒混合,使两者终浓度均为50 mg/L,通过显微注射导入虫体性腺。挑取具有roller表型的F1代虫体培养至F2代后,挑取不同时期的虫体进行绿色荧光观察。
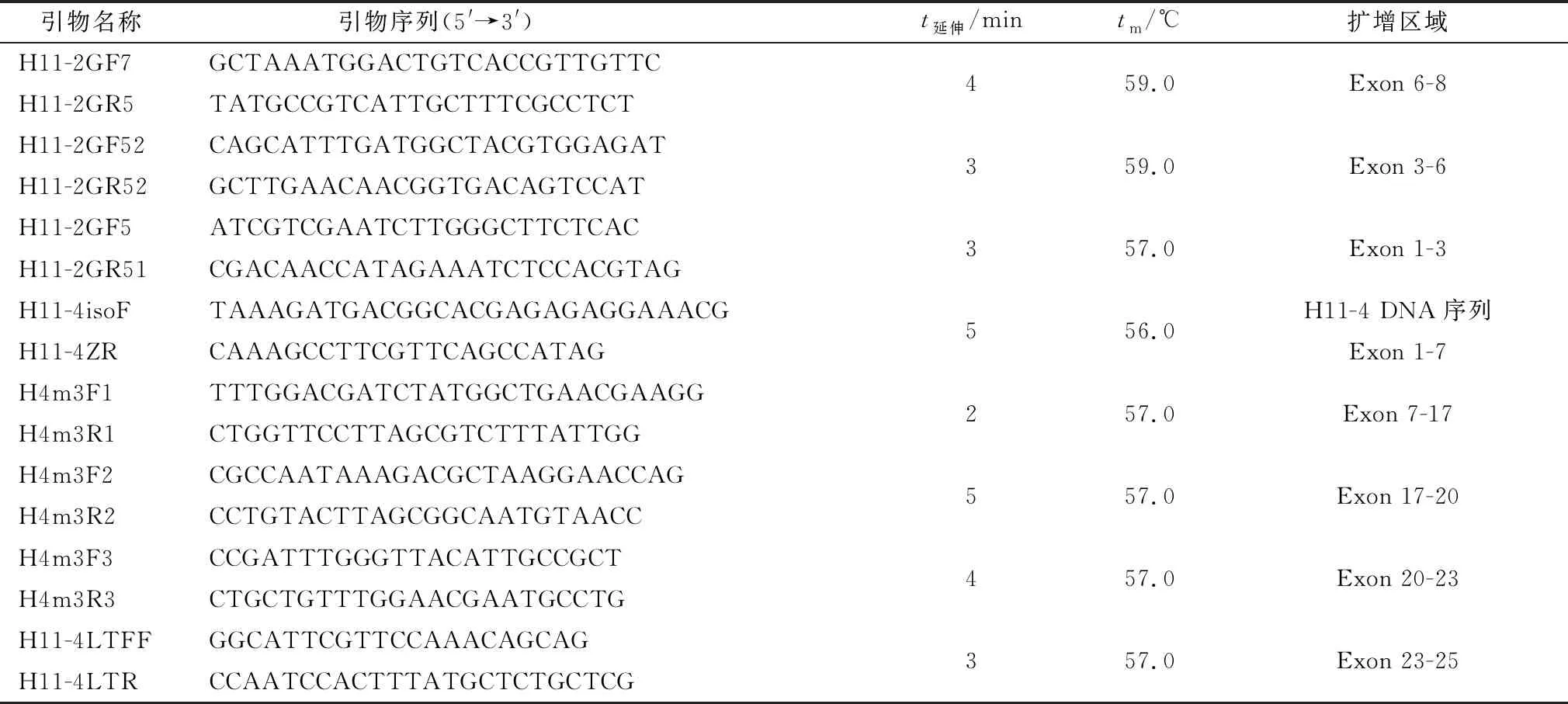
续表1
2 结果
2.1 ORF序列及同源性比对分析扩增获得的捻转血矛线虫 ZJ株H11-1基因ORF长2 937 bp,编码978个氨基酸;H11-2基因ORF长2 919 bp,编码972个氨基酸。序列比对分析发现H11-1与已公布的序列(AJ249941.1)氨基酸同源性为99.4%,第27位到第49位为跨膜区域,含有5个N-糖基化位点NTSV、NWTV、NYTK、NATT及NSSF(图1);H11-2与已公布的序列(AJ249942.2)氨基酸同源性为99.3%,第13位到35位为跨膜区域,含有3个N-端糖基化位点NLTS、NATA及NKSS(图2)。将H11-1、H11-2与此前已获得的H11-3及H11-4氨基酸序列进行比对分析(图3),发现H11的4个亚型均属于Ⅱ型整合膜蛋白,含有1个跨膜区、1个短链N-端胞内尾及1个长链胞外区,胞外区存在氨肽酶锌指基序HEXXHXW;亚型间氨基酸序列高度同源,具有相似的胞内区、跨膜区以及胞外区,而且相对保守,胞外区域含有糖基化位点,某些位点相对保守,如H11-1、H11-3、H11-4共有保守的糖基化位点NWTV和NSSF。
2.2 基因结构及剪接模式分析通过多段连续扩增方法,分别获得的捻转血矛线虫 ZJ株H11-1、H11-2、H11-4基因DNA序列大笑分别为11 698,16 479,19 804 bp(MN852856、MN852857、MN852858)。生物信息学比对分析结果显示(图1及表1,3),3个亚型与H11(H11-3)基因结构相似,编码区均包含25个外显子和24个内含子,外显子与内含子之间通过典型的GT…AG结构进行剪接,外显子大小位于64~201 bp ,内含子大小不等且同源性低。

A.H11-1;B.H11-2;C.H11-4
2.3 5′侧翼区主要启动子基序分析利用基因步移技术鉴定的H11-1、H11-2、H11-4 5′侧翼区序列长度分别为4 606,3 465,2 361 bp。对H11的4个亚型基因5′侧翼区进行序列比对分析发现,它们相互之间同源性极低,但存在数个相同的启动子元件。进一步分析启动子区域的主要基序,发现H11-1 5′侧翼区无TATA-box,拥有2个CCAAT motif、8个CAC-binding site;H11-2的5′侧翼区无TATA-box,拥有1个CCAAT motif、9个CAC-binding site;H11-4的5′侧翼区拥有1个TATA-box、1个CCAAT motif和4个CAC-binding site;同时3个亚型的5′侧翼区拥有数个肠道特异性表达的启动子元件,如elt-2、Cdx-1以及GTAT-4等。
2.4 5′侧翼区启动转录活性分析构建H11-1、H11-2、H11-4的5′侧翼区部分序列的重组表达质粒,分别与pRF4 Marker质粒等比混合,显微注射入秀丽线虫N2野生株,培养后观察,发现均可获得具有稳定roller表型的转基因虫体。将虫体培养至F2代后进行荧光表型观察,发现只有H11-4 5′侧翼区成功启动了GFP强表达,而H11-1与H11-2基因的5′侧翼区未能启动GFP表达或者表达强度极弱。H11-4的5′侧翼区启动GFP在线虫胚胎期以外的其他生命时期表达,表达部位集中于肠道起始和肠道末端,中段肠道亦可见GFP表达,而以肠道末端表达强度最高,且在不同时期虫体内的表达等部位以及强弱存在一定差异(图2)。
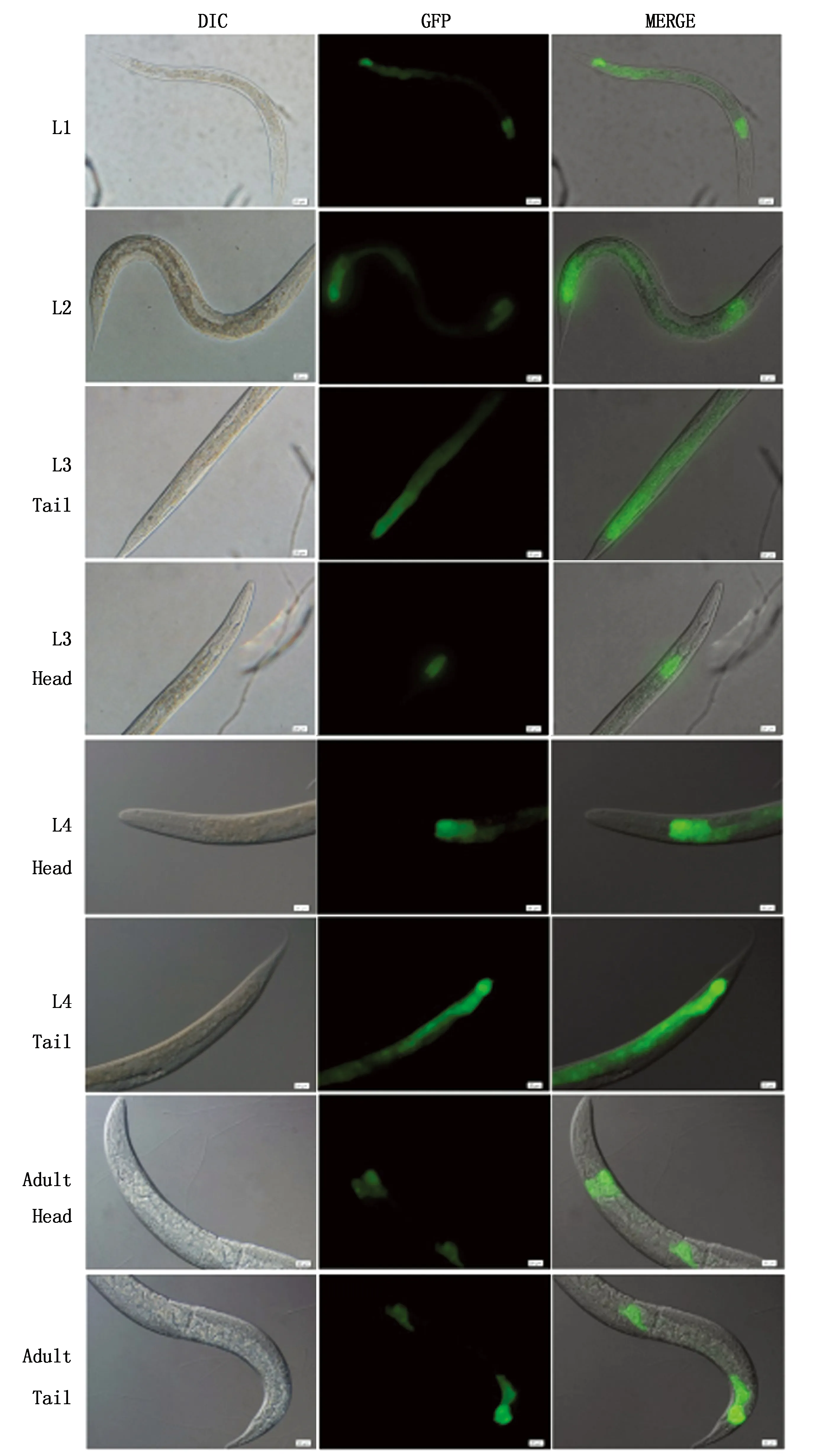
图2 H11-4基因5′侧翼区启动GFP在秀丽线虫不同时期虫体内的表达 (标尺: 20 μm)
3 讨论
微粒体氨肽酶H11天然提取物对耐药虫株、药物敏感虫株以及不同地域的虫株均能提供免疫保护力[12-13],具有较好的疫苗研发前景。近年来,H11的研究主要集中在分子疫苗研制方面[14-15],但单一亚型的重组蛋白并不能提供有效的保护力。
本研究鉴定了H11已知亚型基因的ORF、DNA及5′侧翼区序列。ORF序列分析显示H11-1、 H11-2与已公布的序列存在个别碱基或氨基酸突变,推测可能是由不同地域虫株差异所造成。H11氨基酸序列分析结果表明4个亚型高度同源,且具有相对保守的跨膜区、糖基化位点等。H11是一种糖蛋白复合物,糖基化修饰有其独特结构,其具有高度岩藻糖化的低聚糖核心结构,在参与免疫保护中可能起着重要作用[16],H11天然提取物能提供有效保护力,而单一形式的重组蛋白不能获得同等水平的保护力,推测与其不能完成糖基化修饰和正确空间折叠相关。同时,H11含有多种亚型,免疫效果可能还与天然提取物中某种亚型或某些亚型组合在免疫保护中起关键作用有着密切关系。DNA序列分析显示H11-1、H11-2、H11-4基因结构及剪接模式与较早鉴定的H11 (H11-3)基因非常相似[8],具有真核生物外显子与内含子交替连接的基本基因结构特征,但与H11在秀丽线虫中类似物的基因结构特征具有较大差异。真核生物中普遍存在基因选择性剪接[17],在秀丽线虫[18]和捻转血矛线虫中也存在[19]。通过比较已获得的H11 4个亚型基因相应位置的外显子,发现他们的大小和分布规律基本一致,但对应内含子大小差异甚大,说明4个亚型均由独立的基因进行编码,相互之间不存在选择性剪接的方式。本实验室前期扩增H11-3的5′侧翼区启动子区域时,获得了H11-4基因的最后一个外显子和3′UTR序列,表明H11 (H11-3)与H11-4在染色体上是连锁的,且具有相同的延伸方向[8]。而本研究鉴定的H11-1、H11-2、H11-4基因5′侧翼区序列与H11-3以及此前获得的H11-4部分序列进行比对,未发现相似于H11-3与H11-4之间的基因连锁现象[8],推测可能是由于本次获得的亚型基因分别位于不同的染色体上,且H11亚型并不是由同一基因进行选择性剪接产生。
基因的非编码序列在生物间保守性较低,但启动子却存在一些共同的转录因子结合基序,如TATA-box、GC-box、CCAAT motif、CAC结合位点等[20],以维持基因完成基本的转录;同时在特定位置表达的基因的启动子间可能存在特殊的结合基序。分析发现已获得的H11 4个亚型5′侧翼区同源性较低,但是存在一些共同的基序,如真核生物的启动子元件CCAAT motif以及CAC结合位点等,同时还包含数个肠道特异性表达基因的启动子元件,如elt-2[21]、GATA-4[22]和Cdx-1[23]等,在一定程度上反映出H11各亚型在捻转血矛线虫体内可能的表达分布特征。本实验室前期以秀丽线虫为模式,建立了表达捻转血矛线虫疫苗候选抗原的转基因技术体系,并以此分析了H11(H11-3)5′侧翼区的启动子转录活性,显示该基因5′侧翼区能启动H11-3在秀丽线虫表达,但表达模式不完全相同,也不能实现正确的剪接[6,8,24]。本研究利用该体系验证了H11-1、H11-2、H11-4的5′侧翼区的启动转录活性,发现只有H11-4的5′侧翼区具有明显的转录活性,能够启动GFP在秀丽线虫除胚胎外的各个时期表达,表达部位集中在肠道。但这与H11各亚型仅在捻转血矛线虫四期幼虫与成虫时期的肠微绒毛表面表达的模式不一致[7,25],可能是由于克隆的H11-4的5′侧翼区序列不含有调控基因表达时效性的相关基序,也可能是存在该基序但秀丽线虫体内肠道缺少相类似的转录因子与之结合。H11-4的5′侧翼区的转录活性与H11-3在同一时期表达特异性方面具有一定的相似性,但在表达的组织分布方面又不尽相同[8],表明H11亚型基因的启动子可能存在各自特有的启动子元件。TESS分析结果显示H11-1、H11-2的5′侧翼区启动子主要基序与H11-4存在相似的启动子元件,但前两者未能启动GFP表达,原因可能是转录活性较弱,克隆的该段序列未包含增强子相关基序,或者含有的增强子基序不能够被秀丽线虫识别导致GFP表达较弱难以观察。
本研究探讨了H11各亚型基因的序列结构及启动子活性,为后续进一步探索其生物学功能及研制高效重组疫苗提供了新材料。
