金黄色葡萄球菌乙酰基转移酶抑制巨噬细胞胞外诱捕网的形成
2021-06-17周程锴刘真真毛桥虹杨勇军
周程锴,刘真真,高 宇,毛桥虹,杨勇军,陈 巍
(吉林大学 动物医学学院,吉林 长春 130062)
金黄色葡萄球菌(Staphylococcusaureus)广泛感染人和动物,是重要的人兽共患病病原菌,严重影响养殖业的发展和危害人类的健康。金黄色葡萄球菌发挥致病作用主要得益于其众多的毒力因子如α溶血素、肠毒素、杀白细胞素D等。乙酰基转移酶(O-acetyltransferase,OatA)作为一种重要的毒力因子,在病原感染中发挥着重要的作用。OatA是一种以不溶性肽聚糖细胞壁聚合物为底物的膜相关蛋白[1],主要参与宿主的天然免疫。OatA基因缺失金黄色葡萄球菌更易激活宿主的NOD1和NOD2受体,且更易被宿主识别[2],诱导免疫细胞早期更快分泌炎症细胞因子和趋化因子[3]。除此之外,OatA可以保护金黄色葡萄球菌免受溶菌酶的溶解作用,OatA基因缺失金黄色葡萄球菌丧失了抗溶菌酶活性,巨噬细胞更易对其清除,但其清除方式尚不明确[4]。
2004年,BRINKMANN等[5]发现了中性粒细胞不同于吞噬和降解来抵抗病原感染的新方式,并将这种新的抵抗病原的方式命名为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。NETs是主要以DNA为骨架,其上附着有髓过氧化物酶、弹性蛋白酶、组织蛋白酶G、组蛋白H3等物质和明胶酶、乳铁蛋白等特定二、三级颗粒蛋白的网状结构。NETs可由多种物质刺激产生,包括PMA、A23187、LPS和细菌、真菌、病毒、寄生虫等。不同刺激物刺激中性粒细胞产生NETs的方式不同,对于病原微生物而言,病原的大小影响NETs的释放[6]。目前,胞外诱捕网(ETs)的形成已被证明不止存在于中性粒细胞,巨噬细胞、嗜酸粒细胞、肥大细胞和单核细胞等免疫细胞也发现了此种现象[7]。不同的是已有研究证明嗜酸粒细胞释放的ETs中不含有胞浆蛋白[7]。研究发现,ETs的存在不仅局限于人类,除了小鼠、马、牛、犬、猫等哺乳动物之外,在鱼类和鸟类中也发现了ETs的形成[8-9]。金黄色葡萄球菌可以诱导中性粒细胞产生ETs,其毒力因子表面蛋白A(SpA)基因缺失的金黄色葡萄球菌诱导NETs的能力明显减弱[10]。然而,毒力因子OatA在ETs形成中发挥的作用尚不明确。因此,本研究通过对比金黄色葡萄球菌OatA基因缺失株ΔOatA-USA300与野生型USA300在METs形成中的差异并初步探讨其机制,为进一步解析OatA生物学作用奠定理论基础。
1 材料与方法
1.1 菌株金黄色葡萄球菌USA300菌株由吉林大学动物医学学院韩文瑜教授惠赠;USA300 OatA基因缺失菌株由本实验室构建。
1.2 试验动物C57BL/6J小鼠购自北京华阜康生物技术股份有限公司,本试验所有小鼠均为雌性,6~8 周龄,体质量为18~22 g。
1.3 主要试剂SYTOX Green购自Invitrogen公司;LDH检测试剂盒购自Promega公司;CitH3(R2+R8+R17)抗体购自Abcam公司;羊抗鼠IgG-HRP和羊抗兔IgG-HRP购自Santa Cruz公司;p-ERK、p-P38、p-JNK、GAPDH抗体和羊抗兔IgG(H+L)荧光二抗购自武汉三鹰公司;RPMI-1640购自GIBCO公司;胎牛血清购自Gemini公司;甲醇、氯化钠等化学试剂购自北京化工厂。
1.4 小鼠骨髓来源巨噬细胞的分离取8周龄的雌性小鼠,在无菌条件下分离小鼠胫骨和腓骨,使用含有0.1%双抗的RPMI-1640培养基冲取骨髓,骨髓悬液1 000 r/min,4℃离心10 min。使用MGM培养基(65% PRMI. 1640+25% LCCM+10% FBS+0.1%双抗)重悬并培养,第4 天换新的MGM培养基,第6 天用1%胰酶消化并计数、接种于细胞培养板中。
1.5 LDH检测将BMDM接种于96孔板中,细胞数为0.2×106个/孔。MOI=20的USA300分别刺激1,2,3,4,5,6 h后吸取细胞培养上清,除试验组外另收取未感染组及阳性对照组细胞培养上清,使用LDH检测试剂盒进行检测。
1.6 胞外DNA定量将BMDM接种于96孔板中,细胞数为0.2×106个/孔。用MOI=20的USA300、ΔOatA-USA300分别刺激1,2,3,4,5 h,收取细胞培养上清,使用SYTOX Green染色后,荧光酶标仪检测荧光强度(激发波长488 nm,发射波长523 nm)。
1.7 免疫荧光将多聚赖氨酸包被的细胞爬片预先放于24孔板中,细胞数为0.5×106个/孔,用MOI=20的USA300、ΔOatA-USA300刺激3 h。弃掉培养上清,4%多聚甲醛固定20 min;0.1% Trion-X100打孔20 min;5%山羊血清封闭1 h;抗体CitH3 (1∶200)孵育过夜;FITC 羊抗兔二抗(1∶200)孵育1 h;1 μmol/L SYTOX Green染色10 min;防淬灭封片剂封片,荧光显微镜下观察。
1.8 Western blot 检测将BMDM接种于6孔板中,细胞数为3×106个/孔,用MOI=20的USA300、ΔOatA-USA300刺激3 h,收取全细胞裂解液,使用BCA法检测蛋白含量;甲醇氯仿法提取蛋白,每孔上样30 μg,SDS-PAGE凝胶电泳进行蛋白分离;湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉室温低速振荡封闭2 h;分别与抗体CitH3(1∶1 000),p-ERK(1∶1 000),p-JNK(1∶1 000),p-P38(1∶1 000),GAPDH(1∶5 000)孵育过夜;TBST溶液洗涤4次,每次15 min;与羊抗兔IgG-HRP抗体(1∶5 000)室温孵育1 h;TBST溶液洗涤4次,每次15 min;显影后应用Image J进行灰度分析。
1.9 统计学分析试验数据使用Graphpad Prism 7.0软件进行分析,统计结果以平均数±标准差表示,组内数据使用单因素方差分析。
2 结果
2.1 OatA 抑制骨髓来源巨噬细胞(BMDM)胞外DNA的释放为了检测OatA对BMDM胞外DNA的释放是否有影响,通过荧光酶标仪定量检测胞外DNA释放量,结果表明ΔOatA-USA300感染后1,2 h胞外DNA释放量与USA300组没有明显差异;3,4,5 h 胞外DNA释放量显著多于USA300组(图1)。在感染1~5 h的LDH生成量与空白对照相比均没有明显差异(图2)。由此得出OatA可抑制骨髓来源巨噬细胞胞外DNA 的释放。
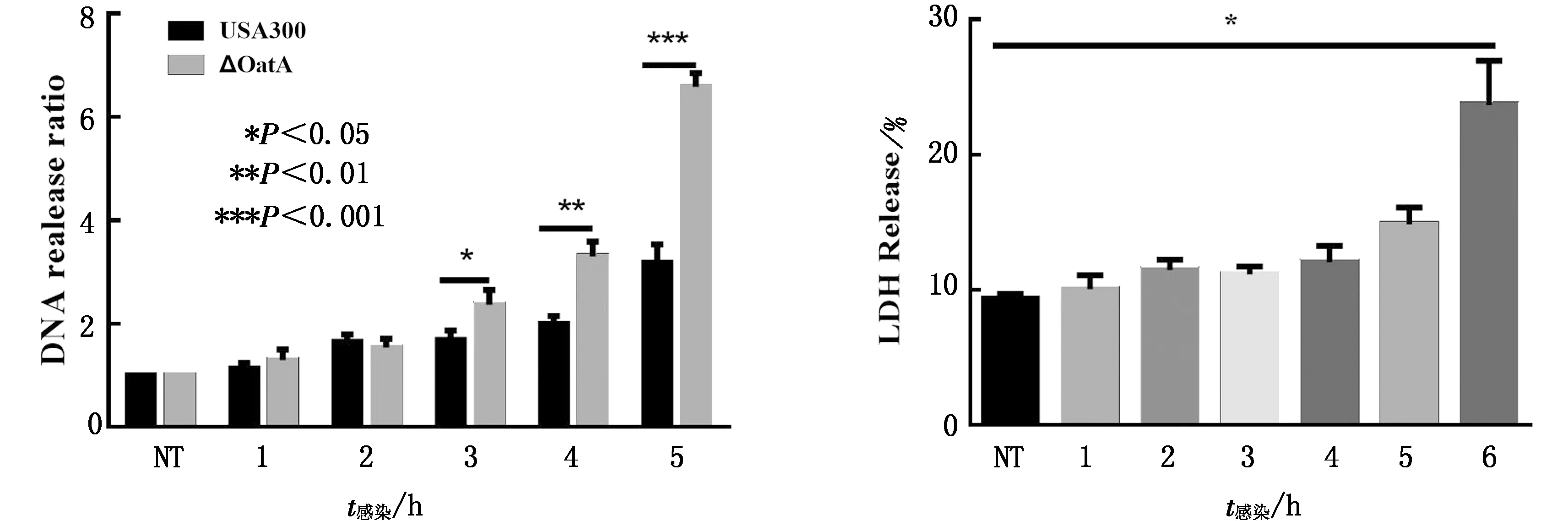
图1 毒力因子OatA对巨噬细胞胞外DNA释放的影响 图2 LDH生成量检测
2.2 OatA 抑制METs的形成为了进一步探讨OatA 对METs形成的影响,使用Western blot方法检测CitH3的表达,结果表明ΔOatA-USA300感染组CitH3表达量显著多于USA300感染组(图3A),免疫荧光显示ΔOatA-USA300感染组胞外DNA与CitH3共定位显著多于USA300感染组(图3B)。由此得出,OatA可抑制METs的形成。

A.Western blot检测CitH3;B.免疫荧光结果(绿色为DNA,红色为CitH3,黄色为DNA与CitH3共定位)
2.3 OatA 抑制MAPK通路的激活为了进一步探讨毒力因子OatA对于METs形成的机制,通过Western bolt方法检测MAPK信号通路中关键蛋白(JNK、ERK、p38)的激活。结果显示,ΔOatA-USA300感染组的JNK、ERK、p38磷酸化水平显著多于USA300感染组(图4)。由此可以得出,OatA 通过抑制MAPK通路的激活来抑制METs的形成。

A.Western blot检测p-JNK、p-ERK和p-P38的表达;B.A图的灰度扫描
3 讨论
当病原微生物侵入机体,机体会迅速启动免疫反应来抵御病原微生物。ETs作为一种新发现的抵御病原感染的方式,在细菌、真菌、寄生虫和病毒感染中起着非常重要的作用。ETs依靠其网状结构可以捕获细菌,现已有研究证明,ETs可以捕捉金黄色葡萄球菌、铜绿假单胞菌等[11-12]。为了防止在试验过程中金黄色葡萄球菌过量感染导致大量的细胞死亡从而影响试验结果的准确性,首先检测了金黄色葡萄球菌感染BMDM不同时间的LDH生成量,确定了感染时间应为5 h以内。通过检测不同时间胞外DNA量,发现缺失毒力因子OatA的金黄色葡萄球菌可以导致巨噬细胞释放更多的胞外DNA。ETs上附着有NE、MPO、组织蛋白酶G、组蛋白H3、CitH3等物质,ETs的形成过程伴随着组蛋白H3的瓜氨酸化[13]。本试验发现金黄色葡萄球菌在缺失毒力因子OatA时可导致巨噬细胞表达的CitH3增加。由此可以推断,金黄色葡萄球菌毒力因子OatA可抑制METs的形成。
自ETs被发现以来,众多的研究者对其进行了研究,但是其形成机制众说纷纭。现有的研究认为NETs形成大体上依赖于2条途径:NADPH氧化酶(NOX)依赖型和NADPH氧化酶非依赖型。以PMA为代表的NETs经典激动剂主要依赖于NOX生成ROS促进染色质解聚。以A23187为代表的激动剂诱导 NETs 形成时,其ROS来源于线粒体[14],属于NOX 非依赖型。ROS是在ETs形成过程中的一个关键产物,慢性肉芽肿患者体内NOX酶存在缺陷,因此无法产生NETs。NETs释放主要被视为由外部刺激激活的细胞内在途径驱动的活跃过程。在NOX非依赖型,有研究者发现NE和MPO是NETs形成过程中后期所必须的[15]。但现在已经被推翻,认为NE和MPO 只是在某些特定的NETs形成过程中起作用[16]。蛋白质精氨酸脱亚氨酶4(PAD4)在中性粒细胞中含量丰富,钙离子和PAD4 复合物进入细胞核,可以促进组蛋白瓜氨酸化加速染色质的解聚。在抑制PAD4或缺乏PAD4小鼠中NETs的形成能力受损[17]。中性粒细胞体外使用二甲双胍预处理后,PMA刺激NETs的形成明显减少,虽然具体的机制还不清楚但这反映了NETs的形成可能与糖代谢有着密切的关系。此外MAPK(ERK、JNK、p38)介导的转录活化也分别参与NOX依赖型和非依赖型。HAKKIM等[18]首次证明MAPK 通路促进NETs的形成,随后在LPS和猪链球菌2型等诱导的NETs形成中均再次证明[19-20]。本研究发现毒力因子OatA缺失后MAPK通路中关键蛋白ERK、p38、JNK磷酸化水平显著提高,表明了金黄色葡萄球菌毒力因子OatA一定程度上抑制MAPK通路的激活以抑制METs的形成。
综上所述,本研究以毒力因子OatA对METs的影响为主线,发现OatA基因缺失后促进METs形成且更强烈地激活MAPK通路,得出OatA通过抑制MAPK通路的激活以抑制METs的形成。这进一步丰富了金黄色葡萄球菌宿主感染中毒力因子所发挥的作用,为更深入研究毒力因子OatA在病原菌感染和抵抗宿主防御方面奠定基础。
