冷柱头气相色谱法测定示踪剂[18F]PBR06注射液中有机溶剂含量
2021-06-14乔洪文盛灵慧梁志刚
乔洪文,盛灵慧,梁志刚,3
(1.首都医科大学宣武医院 核医学科,北京 100053;2.首都医科大学宣武医院 国家老年疾病临床医学研究中心,北京 100053;3.首都医科大学宣武医院 信息中心,北京 100053)
正电子发射断层显像(positron emission computed tomography, PET)能够在体定量反应特定靶向的功能情况,已经成为临床实用的分子影像手段,在疾病的研究、诊断、监测和疗效评价中发挥日益重要的应用价值[1-2]。性质优良的示踪剂是获取良好PET图像的必要条件,临床上经常采用的放射性核素包括:11C、18F、13N、68Ga等。PET显像示踪剂存在放射性半衰期的物理限制,需要制备后尽快使用,因此要求产品的质控检验方法快速、有效;同时由于放射性可能会引起辐射损伤,要求质控检验方法操作简单、样品量少[3]。对于新开发的正电子类示踪剂,应根据《正电子类放射性药品质量控制指导原则》[4],制定适用的质量标准,并通过临床前研究验证制备工艺和产品质量稳定性,以保证后续研究中示踪剂制剂的安全性和研究的有效性。
[18F]PBR06是一种新型PET示踪剂,主要用于检测脑中神经炎症的分布和轻重程度。由于神经炎症表现在多种神经系统疾病中均有重要作用,包括多发性硬化、脑肿瘤和神经退行性疾病等,因此,[18F]PBR06具有重要的临床和研究应用价值[5]。[18F]PBR06注射液的制剂形式是含有10%(v·v-1)乙醇的0.5%(g·g-1)抗坏血酸钠生理盐水溶液,其中乙醇为助溶剂,用于维持[18F]PBR06在制剂中的溶解度、保持制剂稳定,制剂中乙醇含量的合格范围为8.0%~12.0%。[18F]PBR06注射液在生产过程中还使用了另外两种有机溶剂:乙腈用于原料18F-脱水干燥和粗产物色谱纯化,DMSO用作氟化反应溶剂[6-7]。《中国药典》2020年版中规定,产品制剂中乙腈的限量为0.041%,DMSO为0.5%[8]。正电子放射性药物中的残留溶剂通过气相色谱测定,常用分流/不分流进样口直接进样法和顶空进样法[10-14],用于[18F]PBR06注射液分析存在的问题是:分流/不分流进样口直接进样法难以在一次进样中准确测定低沸点溶剂乙醇、乙腈和高沸点溶剂DMSO的含量,而且[18F]PBR06制剂中乙醇含量较高,超出定量检测线性范围;顶空进样法所需样品量较多、耗时较长。本研究拟开发一种快速、样品量少、能够在一次进样中快速完成定量检测[18F]PBR06注射液中乙醇含量,以及乙腈、DMSO残留量的制剂质检方法。
1 实验部分
1.1 实验仪器
色谱仪:安捷伦7890B气相色谱仪,配备冷柱头进样口、G4513A型自动进样器和FID检测器;AB204E型电子天平:梅特勒公司。
1.2 主要试剂
乙醇:药用级,南京化学试剂有限公司,批号:190509120B,含量99.93%;抗坏血酸钠:药用级,石药集团,批号:219014801;乙腈(批号:STBH5417,含量99.96%)、DMSO(批号:STBH9550,含量99.99%):分析纯,Sigma;水:色谱级,Fisher Chemical,批号:178475;生理盐水:药用级,中国大冢制药有限公司,批号:9F99B1;[18F]PBR06注射液(批号:PBR06-20190808-XWH,PBR06-20191216~20191220-XWH 共6批次):于首都医科大学宣武医院核医学科放射性药物实验室制备。
1.3 色谱条件
采用Restek公司Stabilwax色谱柱(30 m×0.52 mm,1 μm),载气为高纯氮气。初始温度为55 ℃,保持4 min,以40 ℃/min的速率升温至200 ℃,保持3 min。检测气为氢火焰离子化检测器,检测器温度为240 ℃。冷柱头进样口温度跟随柱温,进样口恒定压力5.5 psi(37.9 kPa),进样体积1 μL。
1.4 溶液配制
供试品溶液:[18F]PBR06注射液,基质为含10%(v·v-1)乙醇的0.5%(g·g-1)抗坏血酸钠-生理盐水溶液。
空白溶液:精密称取抗坏血酸钠500 mg,溶解于100 mL生理盐水,制得空白溶液。
标准溶液:在50 mL容量瓶中加入约40 mL空白溶液,用移液器向容量瓶中依次加入6 mL乙醇,32 μL乙腈、273 μL DMSO,称量并记录加入的准确质量,然后用空白溶液定容,制得乙醇浓度为12%(v·v-1)、乙腈浓度为0.048%(g·g-1)、DMSO浓度为0.59%(g·g-1)的1号标准溶液。用空白溶液逐级稀释1号标准溶液,制得2~6号标准溶液,乙醇浓度(v·v-1)依次为10%、5%、2%、1%、0.5%;乙腈浓度(g·g-1)依次为0.040%、0.020%、0.008 0%、0.004 0%、0.002 0%;DMSO浓度(g·g-1)依次为0.49%、0.25%、0.098%、0.049%、0.025%。
1.5 方法学验证
1.5.1专属性及系统适用性检查 取空白溶液和2号标准溶液各100 μL,分别置于5 mL容量瓶中,用水定容并混匀,然后取1 mL置于样品瓶中,按1.3节色谱条件进行分析,其中2号标准溶液连续进样3次。
1.5.2精密度考察 取2号标准溶液100 μL,置于5 mL容量瓶中,用水定容并混匀,取样并于同一日内重复测定6次,考察各峰的保留时间和峰面积的相对标准偏差(RSD%)。
1.5.3线性范围考察 取1~6号标准溶液各100 μL,分别置于5 mL容量瓶中,用水定容并混匀,然后各取1 mL置于样品瓶中,每个样品平行测定3次。分别以乙醇、乙腈和DMSO的峰面积为纵坐标,以1~6号标准溶液浓度为横坐标进行线性回归,考察各溶剂的线性范围和决定系数R2。
1.5.4定量限和检测限测定 采用线性范围考察2号标准溶液的分析结果,按照信噪比10∶1和3∶1分别计算乙醇、乙腈和DMSO的定量限和检测限,然后按照倍数将2号标准溶液用空白溶液逐级稀释,制得乙醇、乙腈、DMSO的定量限和检测限检查溶液。分别移取100 μL上述检查溶液,用5 mL水稀释后按1.3节色谱条件进行分析(n=3),分别考察乙醇、乙腈和DMSO的定量限和检测限。
1.5.5加标回收率实验 准确移取已测得各组分含量的[18F]PBR06注射液(批号为PBR06-20190808-XWH)5 mL,置于10 mL容量瓶中,分别加入高、中、低量的乙醇、乙腈和DMSO,然后用空白溶液定容,制得加标回收率检查溶液。分别取上述回收率检查溶液100 μL,置于5 mL容量瓶中,用水定容混匀,然后取1 mL置于样品瓶中,照1.3节的色谱条件测试,每个样品平行测定3次。
1.5.6系统耐用性初步分析 首先将样口压力分别设置为5.3 psi(36.5 kPa)、5.5 psi(37.9 kPa)和5.7 pis(39.3 kPa),保持其余色谱条件如1.3节不变,取2号标准溶液稀释液进样分析;然后将样口温度分别设定为53 ℃、55 ℃和57 ℃,保持其余色谱条件如1.3节不变,取2号标准溶液稀释液进样分析。计算改变进样口压力和温度时,乙醇、乙腈和DMSO保留时间和峰面积的相对标准偏差。
1.6 样品测定
在[18F]PBR06注射液生产结束后(共5批次,批号:PBR06-20191216~20191220-XWH),于铅玻璃后取产品制剂100 μL,加入到5 mL容量瓶,采用水定容并摇匀,然后移取0.2 mL到微量GC样品瓶中,按照1.3节的色谱条件进行分析,通过峰面积计算制剂中乙醇、乙腈和DMSO的含量。
2 结果与分析
2.1 方法学验证
2.1.1专属性及系统适用性检查 2号标准溶液分析结果表明,乙醇、乙腈和DMSO能够获得较好分离,保留时间依次为2.053 min、2.943 min和7.975 min,三个色谱峰之间的分离度大于1.5。乙醇、乙腈和DMSO的理论塔板数分别为1 199、9 697和615 360,拖尾因子分别为2.63、1.65和1.10。空白溶液分析结果中无可见色谱峰,对被测各组分无干扰,色谱图见图1。2号标准溶液3次连续进样中乙醇保留时间和峰面积的相对标准偏差分别为0.5%和0.1%,乙腈为0.1%和1.8%,DMSO为0.0%和2.4%。以上结果表明,本研究开发的GC条件具有较好的专属性和系统适用性[9]。
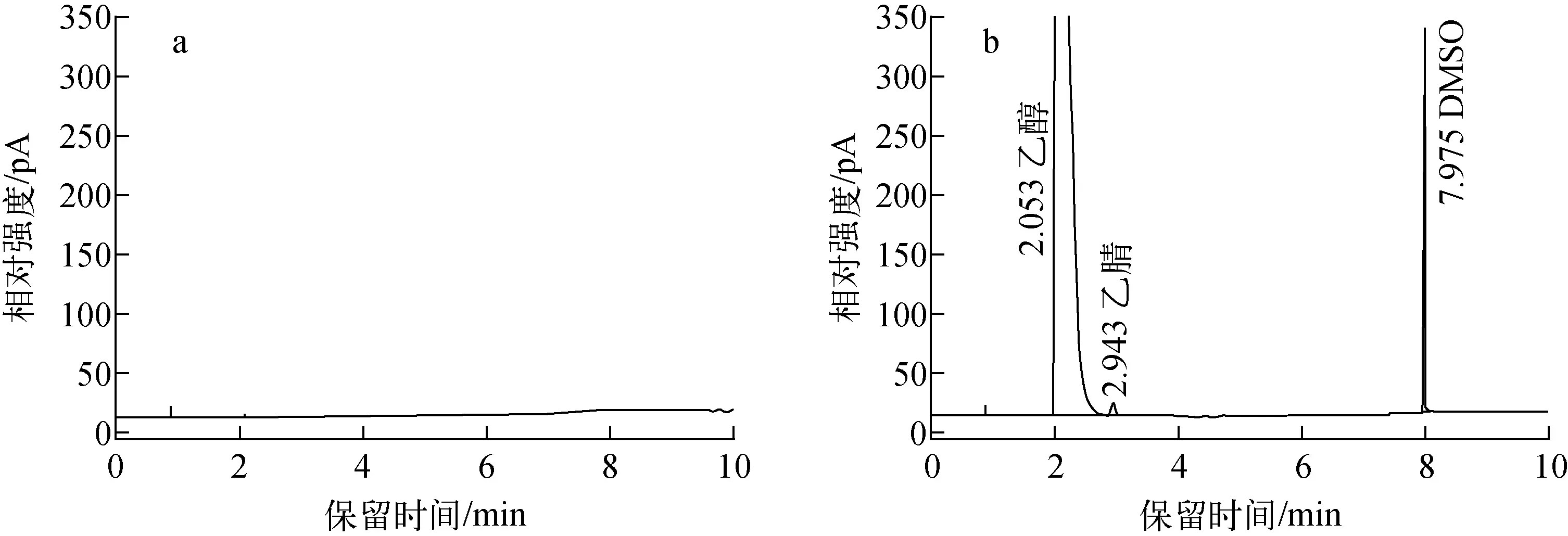
图1 空白溶液(a)和2号工作标准溶液(b)的气相色谱图Fig.1 GC chromatogram of blank (a) and No.2 standard (b)
2.1.2精密度 方法精密度考察结果见表1,乙醇、乙腈和DMSO三种目标物的保留时间和峰面积的相对标准偏差均小于5%,表明本色谱方法精密度良好,符合《中国药典》2020版中关于残留溶剂重复性的要求(RSD≤5%)[7]。
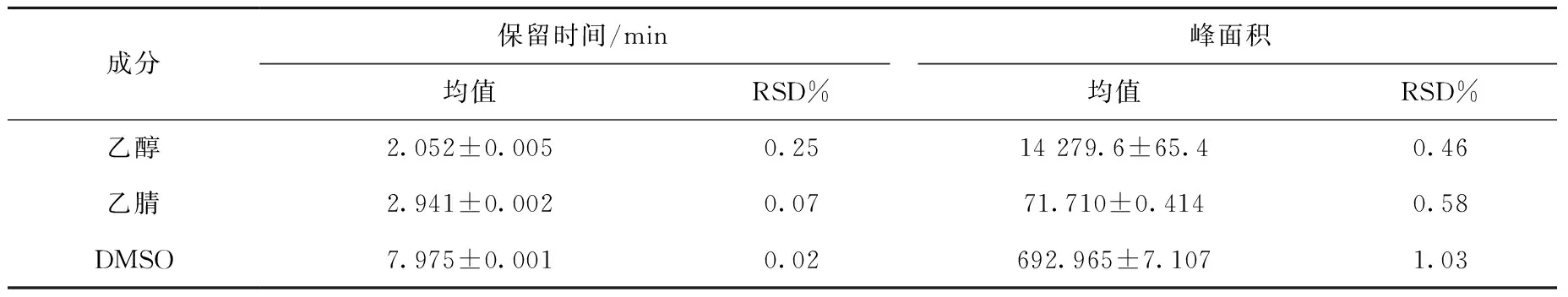
表1 GC方法精密度测试结果Table 1 The results of precision inspection for the GC method validation
2.1.3线性范围 根据1~6号标准溶液分析结果得到回归方程列于表2,乙醇、乙腈和DMSO分别在0.5%~12.0%(v·v-1),0.004 0%~0.048 0%(g·g-1)和0.025%~0.590%(g·g-1)浓度范围内具有良好的线性关系。[18F]PBR06注射液中乙醇含量的理论值为10%(v·v-1),合格范围为8.0%~12.0%(v·v-1);残留溶剂乙腈限度为0.041%,DMSO为0.50%。本研究GC方法的线性范围涵盖以上三种溶剂的检测限度。
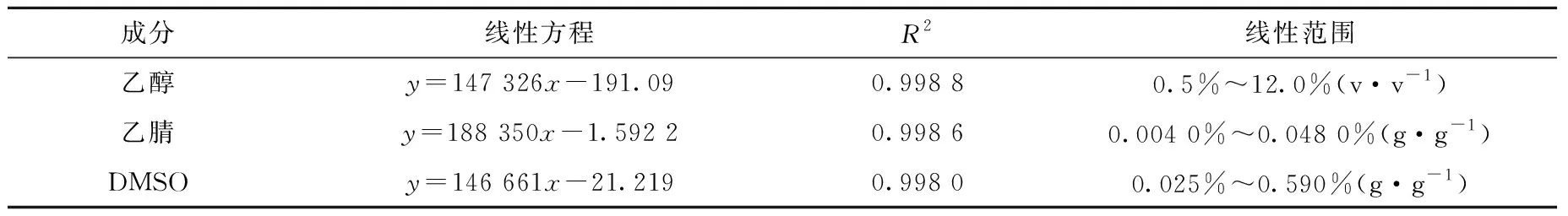
表2 方法线性范围考察结果Table 2 The results of linear range inspection
2.1.4定量限(S/N=0)和检测限(S/N=3)测定 将2号标准溶液经系列稀释后分析,测得乙醇的定量限为0.15%(v·v-1),检测限为0.05%(v·v-1);乙腈定量限为0.002 9%(g·g-1),检测限为0.000 87%(g·g-1);DMSO定量限为0.008 2%(g·g-1),检测限为0.002 5%(g·g-1)。
2.1.5加标回收率 高、中、低浓度的加标回收率检查溶液中的溶剂浓度为限度120%、100%和80%,分析结果列于表3,三种待测溶剂的加标回收率均大于95%,表明该方法具有良好的准确度。
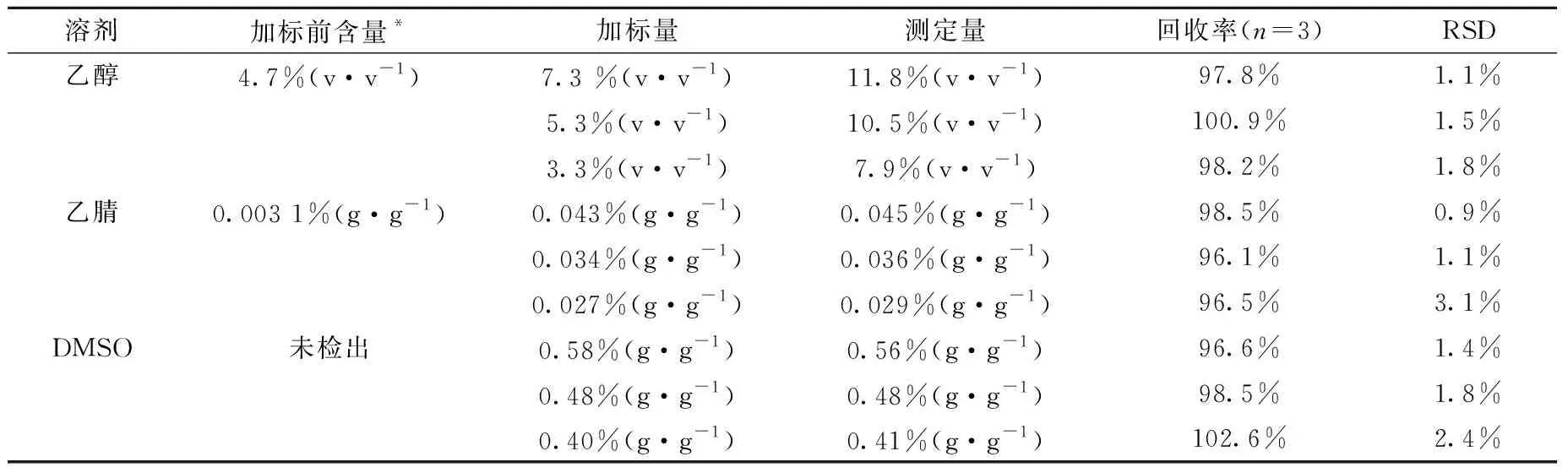
表3 方法加标回收率考察结果Table 3 The results of standard addition recovery inspection
2.1.6系统耐用性 在色谱柱选择上,Stabilwax色谱柱适用于高含水量和高盐样本分析,研究结果表明此款色谱柱可以实现制剂中各目标组分的良好分离,同时具有良好的重现性和精密度。样口压力分别设置为5.3 psi(36.5 kPa)、5.5 psi(37.9 kPa)和5.7 pis(39.3 kPa),取2号标准溶液分析,结果表明,三种目标物的保留时间相对标准偏差<0.94%,峰面积<1.83%。进样口初始温度分别设置为53 ℃、55 ℃和57 ℃,2号标准溶液中三种目标物的保留时间相对标准偏差<0.68%,峰面积<1.57%。以上数据表明该方法耐用性良好。
2.2 样品测定
5批次[18F]PBR06注射液分析结果列于表4,乙醇含量和乙腈、DMSO残留量均合格。在生产过程中,乙醇主要作用是将纯化后产品从固相萃取小柱上洗脱,加入到抗坏血酸钠生理盐水溶液中,并使产品稳定溶解于制剂溶液中。生产中投入乙醇的量为最终产品制剂的10%(v·v-1),但是由于乙醇和生理盐水溶液在生产体系中有不同程度的残留,导致实际进入最终产品制剂中的乙醇比例发生变化,产品制剂中乙醇含量的合格范围为8.0%~12.0%(v·v-1)。检验批次产品中乙醇含量均合格。
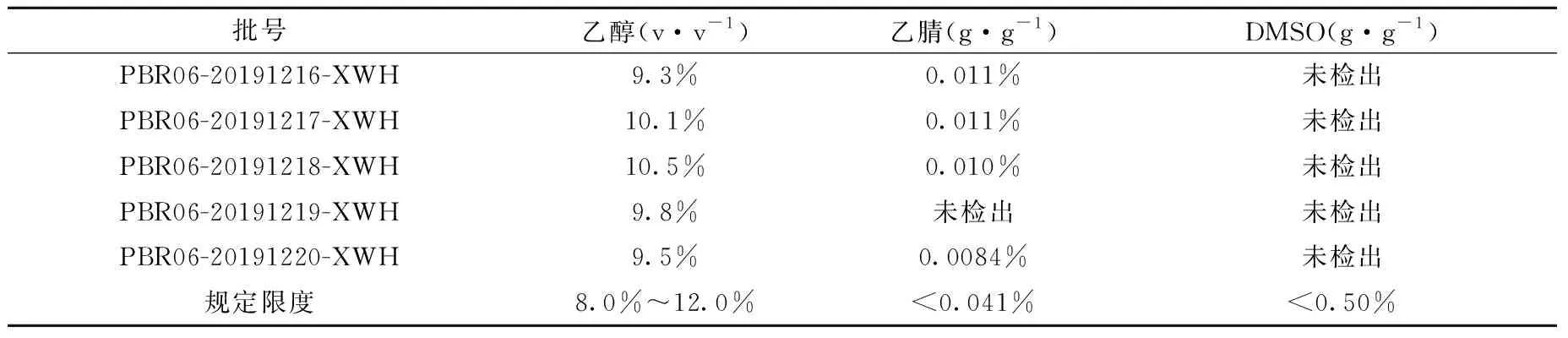
表4 5批[18F]PBR06注射液质控分析结果Table 4 The results of quality control tests of five batchs
[18F]PBR06注射液生产过程,乙腈用于原料F-18离子的除水剂和制备色谱的流动相;DMSO用作氟化反应溶剂。《中国药典》2020版中规定,产品制剂中乙腈和DMSO的限度分别为0.041%和0.5%[8]。经检验的5批产品中的乙腈和DMSO残留量均合格。
3 讨论
正电子核素标记的PET示踪剂具有放射性和较短的物理半衰期,这要求药物制剂的质控检验方法快速、测试样品量小[12-14]。常用的药物制剂中有机溶剂的检查方法为顶空进样法和分流/不分流进样口直接进样法。顶空进样法是指将供试品溶液置于密闭小瓶中,在恒温控制的加热室中加热至供试品中挥发性组分在液态和气态达到平衡后,由进样器吸取一定体积的顶空气注入色谱柱中进行分析。顶空进样法可用于极性差异较大的多组分分析,缺点是需要较长的平衡时间和较多样品量。分流/不分流进样口直接进样法是指将供试品溶液直接注入进样口中,溶液在进样口气化室中完成气化,然后部分或全部进入色谱中进行分离测定。该方法的优点是所需样品量少、速度较快,缺点是可能存在高沸点组分气化不完全、样品加热气化过程中发生改变等问题,导致进样口易被污染、对高沸点组分检测的重复性较差。
冷柱头进样口直接进样法是将供试品溶液直接注射到色谱柱中,在色谱柱中完成气化和分离的气相分析技术。该技术不存在进柱前加热汽化过程,避免了样品组分岐视效应、进样针头选择性蒸发和非线性分流等问题,具有良好的稳定性和检测灵敏度。该技术的缺点是进样口结构复杂,衬管和进样器针头需要对应色谱柱直径;非挥发性组分可能沉积在色谱柱柱头,造成污染。冷柱头进样口直接进样法在国内外的研究中主要用于热不稳定样品或痕量组分的分析,在食品、农药和石油工业中应用较多[15-18];用于药物检验的报道较少,这主要是由于常规药物批量较大,对取样量和检测时间的限制较小,采用应用较广泛的分流/不分流进样口即可满足检测要求;冷柱头进样口用于放射性药物质控检测此前尚未见文献报道。放射性药物生产具有批量小、质控样品量较少的特点,冷柱头进样口直接进样法所需样品量少,通过数微升样品即可完成检测,而且检测时间短,可通过一次进样测定制剂中乙醇和残留溶剂含量;此外放射性药物中有效物质含量低,可以避免冷柱头进样口因非挥发性组分沉积而造成污染。采用冷柱头进样口直接进样法进行放射性药物制剂中有机溶剂分析,可充分发挥该方法快速、样品少、定量范围宽等优点,而避免柱头污染等弊端,具有良好的应用价值。
本研究采用冷柱头进样口直接进样法测定[18F]PBR06注射液中有机溶剂含量,方法学验证结果表明,该方法用于乙醇定量检查和乙腈、DMSO限度检查符合《中国药典》要求。该方法可在一次进样中完成三种待测溶剂的检测,运行时间小于12 min,而且使用的样品量相当于4 μL产品制剂原液,可大幅减低暴露在环境中的放射性活度,减少操作人员受到的辐射剂量。本研究证明冷柱头进样口直接进样方法适用于[18F]PBR06产品制剂的质控检查,有利于保证药物制剂的安全性,对[18F]PBR06的推广应用具有重要意义。此外,本研究开发方法还适用于其他制剂中乙醇含量为0.5%~12%(v·v-1)的放射性药物的质控分析,在本实验室已经用于β淀粉样蛋白示踪剂[18F]AV-45、Ⅱ型囊泡单胺转运体示踪剂[18F]FP-DTBZ和多巴胺D2受体示踪剂[18F]Fallypride的残留溶剂质控检测。
4 结论
冷柱头直接进样气相色谱法适用于放射性药物制剂[18F]PBR06注射液中的乙醇含量测定和乙腈、DMSO残留量检查,具有快速、样本量小的优点,可通过单次进样即获得三种待测溶剂含量,有利于提高药物质控分析效率,并且该方法可进一步用于其他制剂组成类似的放射性药物的质控分析。
