溶液中离子浓度关系问题归类例析
2021-06-07甘肃省高台县第一中学石兴龙734300
甘肃省高台县第一中学 石兴龙 734300
溶液中离子浓度关系,是高中化学教学重点、难点,也是近几年高考中的热点内容,考查考生对知识点熟练应用和创新思维能力,试题灵活,有很好的区分度.很多学生对教材中涉及知识应用不熟练,在解答时没有找准思维切入点,分析判断不准确,常会出错.现以近几年高考题中涉及溶液离子浓度关系问题部分选择题为例,进行归类解析,以期使同学们更好地掌握.
1 单一溶质溶液
1.1 溶质是弱酸或弱碱
例1下列说法正确的是:

B.(2014全国Ⅱ卷11题)一定温度下,pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1.


小结:注意分析弱酸、弱碱部分步电离情况,应用守恒关系,解答离子浓度关系问题;若弱酸、弱碱溶液加水稀释,c(H+)或c(OH-)并没有缩小同等倍数.
1.2 溶质是弱酸盐或弱碱盐
例2 室温下,下列溶液中粒子浓度关系正确的是:
A.(2020天津新高考7题)在1mol·L-1Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=1mol·L-1.

强碱弱酸盐(如Na2CO3、Na2SO3、Na3PO4、Na2C2O4、CH3COONa)溶液中离子浓度大小、守恒关系相似.



小结:弱酸盐、弱碱盐、弱酸弱碱盐溶液中,要分析弱碱根、弱酸根水解的主次,溶液的酸碱性或pH值,注意守恒关系及水解规律应用.
1.3 溶质是弱酸酸式盐
例3下列溶液中微粒物质的量浓度关系正确的是:





小结:弱酸酸式盐或弱碱弱酸酸式酸盐溶液中,依据是溶液的酸碱性或pH值,分析弱碱根、弱酸酸式酸根即水解又电离的主次,判断离子浓度关系.
1.4 不同溶质溶液间离子浓度问题比较
例4下列说法正确的是:
A.(2019上海20题)常温下,0.1mol/L的①CH3COOH②NaOH③CH3COONa,①②等体积混合后,水的电离程度比①③等体积混合的电离程度小.
B.(2014全国Ⅱ卷11题)一定温度下,pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③.
解析A:①②等体积混合后,恰好完全反应生成CH3COONa溶液,发生CH3COO-+H2O⇌CH3COOH+OH-水解促进水的电离;①③等体积混合后,发生CH3COOH⇌CH3COO-+H+电离出的H+抑制水的电离;总体上看①②等体积混合后,水的电离程度比①③等体积混合的电离程度大;说法错误.
如在NH4HSO4溶液中,NH4HSO4完全电离出的H+促使水解N+H2O⇌NH3·H2O+H+水解平衡向左移动,抑制部分N水解;而CH3COONH4溶液中,NH4+水解产生H+,CH3COO-水解产生OH-,促使水解平衡向右移动,发生相互促进的双水解.
解析B:依据盐类水解规律,盐中弱酸根、弱碱根对应的酸或碱越弱,水解程度越大;酸性CH3COOH>H2CO3>HClO,水解程度ClO->HC>CH3COO-;当pH值相同时,三种盐溶液中弱酸根水解产生的c(OH-)也相同,则三种盐液溶质的物质的量浓度①>②>③,则c(Na+):①>②>③,说法正确.
小结:不同溶质溶液间离子浓度关系问题比较,注意分析溶液酸碱性强弱和盐类水解规律应用.
2 两种或几种溶质混合溶液
混合溶液要考虑溶质间是否反应,反应是否过量,反应后溶液的酸碱性对弱电解质电离和盐水解的影响.
2.1 溶液混合后溶质不反应
例5下列混合溶液中微粒物质的量浓度关系正确的是:

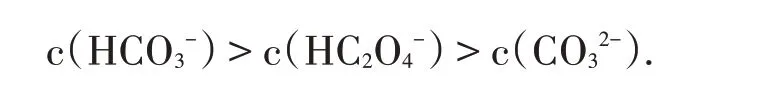

小结:弱酸盐与弱酸酸式盐、弱酸盐与弱酸、弱碱盐与弱碱、酸与酸、碱与碱溶液混合,溶质间虽不反应,但要注意混合溶液的酸碱性或pH值,分析弱酸根与弱酸、弱碱根与弱碱水解和电离程度的大小,判断微粒间浓度关系.
2.2 溶质混合后恰好反应
例6下列有关溶液中粒子浓度关系正确的是:

B.(2015安徽13题)25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+).


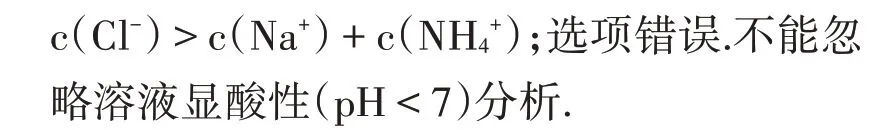
小结:溶质混合反应时要根据题设信息进行定量、定性分析,是否恰好反应,反应后溶液酸碱性;分析弱碱根、弱酸根水解、电离程度大小和离子的种类.
2.3 溶液混合反应,一种剩余或不足量.
例7下列说法正确的是:
A.(2017年江苏卷14题)常温下,0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+).
B.(2014四川卷6题)室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)>c(NH4+)+c(OH-).
解析A:溶液等体积混合反应后CH3COONa过量,得到的是CH3COOH、CH3COONa和NaCl的混合液,因pH<7,混合液中部分CH3COOH电离程度大于部分CH3COO-水解,Na+、Cl-不水解;混合液中离 子 浓 度大小:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-);电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-);物料守恒:c(CH3COO-)+c(CH3COOH)=c(Na+);说法正确.
解析B:室温下,pH=2的盐酸,c(H+)=1×10-2mol·L-1,pH=12的氨水,c(OH-)=1×10-2mol·L-1,是弱碱c(NH3·H2O)远大于1×10-2mol·L-1,等体积混合反应后氨水过量,溶液显碱性,c(OH-)>c(H+),说明部分NH3·H2O电离程度大于部分NH4+水解程度;微粒浓度大小:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+);从电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-)得c(Cl-)+c(H+)<c(NH4+)+c(OH-),说法错误;本题忽视反应物过量判断.
小结:找准题设隐含条件,判断溶质混合反应时反应物过量还是不足量,分析剩余物质的电离、水解平衡移动情况,是解题的关键.
2.4 溶液混合后反应,溶液为中性(pH=7).
例8判断所得溶液中微粒的物质的量浓度关系正确的是:


解析A:当滴入氨水20mL时,恰好反应,混合液中溶质为NH4Cl和CH3COONH4,c(NH4+)最大,约为c(CH3COO-)的2倍,部分NH4
+水解大于部分CH3COO-水解,混合液显酸性(pH<7);则c(H+)>c(OH-),c(NH4+)>c(Cl-)>c(CH3COO-);离子浓度大小:c(NH4+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-);电荷守恒:c(NH4+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-);物料守恒:c(NH4+)+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-)+c(Cl-).当滴入氨水超过20mL时,稍微过量氨水中NH3·H2O电离出的OH-中和NH4+水解产生的H+,使混合液显中性(pH=7),即c(H+)=c(OH-),代入电荷守恒式,得c(NH4+)=c(CH3COO-)+c(Cl-),故c(NH4+)>c(Cl-).因此当滴入氨水20mL,溶液呈酸性或滴入氨水大于20mL,溶液呈中性时,c(NH4+)>c(Cl-),选项错误;忽略弱碱根、弱酸根水解程度大小的分析.
解析B:NaHSO3溶液中通入NH3后反应生

小结:溶质混合反应后注意溶液显中性或pH=7定性分析,c(H+)=c(OH-)应用到溶液离子守恒关系中判断离子浓度关系.
3 电离常数、水解常数应用
例9下列所得溶液中微粒的物质的量浓度关系说法正确的是:
A.(2017年江苏卷14题)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,浓度均为0.1mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者.
B.(2018江苏卷14题)H2C2O4为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-).室温下用NaOH溶液滴定25.00mL0.1mol·L-1H2C2O4溶液至终点.滴定过程中得到c(Na+)=c(总)的溶液中:c(Na+)>c(H2C2O4)>c(C2)>c(H+).
解析A:甲酸钠、氯化铵溶液电荷守恒式分别为:c(H+)+c(Na+)=c(OH-)+c(HCOO-),c(H+)+c(NH4+)=c(OH-)+c(Cl-);在常温下氨水的Kb小于甲酸的Ka,离子积KW不变,即NH4+水解程度大于HCOO-水解,则NH4Cl溶液中c(H+)大于HCOONa溶液中c(OH-),则氯化铵溶液中c(OH-)小于甲酸钠溶液中c(H+),Cl-和Na+不水解,c(Cl-)=c(Na+),由上述两个守恒式可知,c(H+)+c(Na+)>c(H+)+c(NH4+),即HCOONa溶液中的阳离子物质的量浓度之和大于NH4Cl溶液,说法正确.

小结:注意题设隐含信息定性、定量分析,应用弱电解质电离常数及弱酸根或弱碱根离子水解常数,判断混合溶液中电离、水解的大小,判断离子浓度关系.
4 图像应用
例10下列溶液中微粒的物质的量浓度关系叙述正确的是:
A.(2020全国Ⅰ卷13题)以酚酞为指示剂,用0.1000mol·L-1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液.溶液中pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图1所示.[比如A2-的 分布系数,δ(A2-)=c(A2-)/(c(H2A)+c(HA-)+c(A2-))],滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-).

图1
B.(2016天津卷6题)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图2所示,当pH=7时,三种溶液中:c(A-)=c(B-)=c(D-).
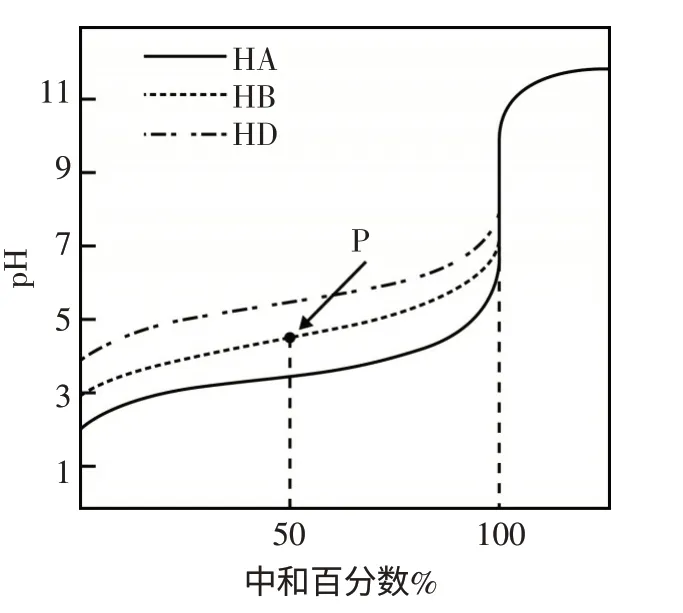
图2
解析A:当加入NaOH溶液40mL时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;读图发现,没有加入NaOH时,H2A溶液的pH为1,c(H+)=0.1mol·L-1,说明H2A第1步完全电离,第2步HA-部分电离;电离方程式分别为:H2A=H++HA-,HA-⇌A2-+H+,H2A电离出HA-和A2-;根据反应,2NaOH+H2A=Na2A+H2O,开始以HA-为主,随NaOH的滴入逐渐减小,A2-逐渐上升,故曲线①代表δ(HA-),曲线②代表δ(A2-).用酚酞作指示剂,酚酞变色pH范围为8.2~10,终点时溶液显碱性,c(OH-)>c(H+),溶液中电荷守恒:c(H+)+c(Na+)=2c(A2-)+c(HA-)+c(OH-);A2-部分水解A2-+H2O⇌HA-+OH-,则c(Na+)>2c(A2-)+c(HA-),说法错误.解答本题的关键是看图时,联系NaOH滴定H2A的反应中HA-和A2-的变化趋势,判断H2A和HA-的电离.另外,根据反应,2NaOH+H2A=Na2A+H2O,c(H2A)=0.1000mol·L-1×40mL/(2×20mL)=0.1000mol·L-1,H2A第1步完全电离,则HA-的起始浓度为0.1000mol·L-1,看图分析,当VNaOH=0时,HA-分布系数为0.9,溶液的pH=1,A2-分布系数为0.1,则HA-的 电 离 平衡常数Ka=c(A2-)·c(H+)/c(HA-)=0.1000mol·L-1×0.1×0.1000mol·L-1/0.1000mol·L-1×0.9=1.00×10-2.读图又发现曲线①和曲线②相交时,δ(A2-)=δ(HA-),此时横坐标为25mL,滴定曲线可看出,溶液的pH=2,c(H+)=1.00×10-2;根据HA-的电离方程式:HA-⇌H++A2-,可知Ka=c(A2-)·c(H+)/c(HA-),此 时δ(A2-)=δ(HA-),c(A2-)=c(HA-),即c(HA-)=c(H+)=1.00×10-2,则Ka=c(H+)=1.00×10-2.
解析B:根据图像信息可知,均为0.1mol·L-1的三种酸(HA、HB和HD)溶液的起始pH>1,三种酸都是部分电离,酸性强弱为HA>HB>HD.滴定后钠盐溶液中,三种弱酸根水解程度A-<B-<D-;用同浓度的NaOH溶液滴定0.1mol·L-1的三种弱酸至pH=7时,滴定HA加入NaOH的体积最多,HD用的量最少,滴定后3种盐溶液中钠离子浓度不相等,则3种弱酸根离子浓度也不相等,为c(A-)>c(B-)>c(D-),该说法错误;本题看图过程中忽视了酸性强弱,读题过程中忽略了滴定至溶液中性(pH=7)和滴定至终点的差别.
另外,读图分析:图中曲线上P点表示用NaOH溶液滴定弱酸HB中和50%,溶液溶质为等物质的量浓度的弱酸HB和NaB,溶液显酸性;弱酸HB部分电离且大于B-部 分水解,则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-).读图又发现当中和百分数达100%时,三种溶液的A-、B-、D-水解生成相应的HA、HB、HD;若混合后,混合液中质子守恒:c(H+)+c(HA)+c(HB)+c(HD)=c(OH-),变式得:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+).
小结:应用图像呈现的题设信息,判断溶液中离子浓度关系是近几年化学高考新热点,解答时看懂图意、读懂题意,仔细分析,正确判断.
高考题中关于溶液中离子浓度关系问题考查,从单一溶质溶液到两种溶质溶液混合到两种溶质反应后的混合溶液,再到近几年来电离常数、水解常数应用,特别是应用图像呈现题设信息;试题综合性强,考查学生对知识点熟练应用和综合分析能力、创新思维能力.解答时要读懂题设和图像信息,注意分析电解质在溶液中电离、水解的主次和离子种类;熟练应用溶液的酸碱性,弱电解质电离、盐类水解规律、平衡理论及溶液中离子守恒关系,仔细分析,灵活判断,提高解题准确率.
