XPC基因遗传变异对接受奥沙利铂辅助化疗方案的Ⅲ期结直肠癌患者的神经毒性及预后的影响
2021-06-05郑凯张天可付文政
郑凯 张天可 付文政
天津市人民医院肛肠科(天津300191)
结直肠癌(colorectal cancer,CRC)在我国每年新发病例约55.5 万,死亡病例约28.6 万[1]。近年来,针对可切除的CRC 患者辅助化疗领域的研究进展相对不多。IDEA 研究提示低危的Ⅲ期结肠癌推荐3 个月而非6 个月的辅助化疗方案[2]。这在一定程度上减少了患者不必要的化疗副作用。另一方面,随着更为灵敏的检测技术的出现,ctDNA 在接受手术切除的CRC 患者的术后复发风险方面具有潜在的复发监测和预后评估方面的价值[3]。然而,ctDNA 距离临床应用尚需要进一步的探索。奥沙利铂为基础的辅助化疗在临床应用过程中仍然会出现较大的个体差异,有较多的因素影响该方案的预后[4]。和化疗药物作用相关的基因遗传变异就是其中很重要的研究方向。
着色性干皮病基因组C(xeroderma pigmentosum group C,XPC)基因位于染色体3p25.1上,包含18个外显子,大小约为17 kb。XPC缺陷可导致遗传不稳定的发生,从而介导了肿瘤的发生和发展[5]。较多的研究也表明了XPC 基因Lys939Gln 多态性位点和结直肠癌,肺癌,肝癌等肿瘤的易感性显著相关[6]。另一方面,也有研究表明XPC 基因遗传变异和接受铂类药物治疗的患者的预后存在一定的关联[7]。
因此,本研究旨在评估XPC 基因遗传变异对接受奥沙利铂为基础辅助化疗的Ⅲ期CRC 患者预后及安全性的影响。
1 资料与方法
1.1 病例选择标准及研究设计本研究设计为回顾性分析,从2014年1月至2019年12月在天津市人民医院肛肠科连续性地收集术后接受奥沙利铂为基础辅助化疗的CRC患者,入组标准包括:(1)年龄在18岁及以上;(2)东部肿瘤协作组(ECOG)的体力状态评分(PS)评分在0 ~2 分;(3)确诊为结肠肿瘤或直肠肿瘤接受了手术切除及术后的辅助化疗;(4)病理学分期为Ⅲ期的患者;(5)肝肾功能及骨髓功能合适具有接受辅助化疗的指征。排除标准为:(1)未接受奥沙利铂的辅助化疗方案的患者;(2)没有合适标本(外周血标本)用来提取基因组DNA 的患者;(3)伴随了其他恶性肿瘤或根据研究者评估会影响生存的重大疾病的患者;(4)无法评估患者预后及生存情况的患者;(5)其他的比如遗传性结直肠癌综合症的患者。本研究的研究流程图如图1所示,最终,符合入排标准并纳入本研究的患者为186例。
本研究纳入的患者均为接受奥沙利铂的辅助化疗方案的CRC 患者,辅助化疗方案包括mFOLF⁃OX6 和CAPEOX 两种方案。本研究得到天津市人民医院医学伦理委员会的批准,每个入组的患者或家属签署知情同意书。

图1 术后接受奥沙利铂为基础辅助化疗的结直肠癌患者的回顾性研究流程图Fig.1 The flow chart of the retrospective study of postoperative patients with CRC receiving oxaliplatin based adjuvant chemotherapy
1.2 随访及不良反应的评估研究纳入的患者前期的随访是在患者接受辅助化疗期间通过医院的电子病历系统进行评估,这期间可以准确地获取患者接受治疗过程中出现不良反应情况。并根据治疗过程中出现的严重的不良反应调整奥沙利铂或其他化疗药物相应的剂量。不良反应的评价标准是根据CTCAE4.03 版本进行评价并纳入本研究的分析中。
本研究中奥沙利铂引起的神经毒性主要包括急性神经毒性和慢性神经毒性。其中急性神经毒性主要变现为用药数小时内出现的包括接触冰冷食物时产生的敏感反应,肌肉痉挛和伴有吞咽困难或呼吸困难及喉咙感觉异常的主观感受。慢性神经毒性主要包括感觉性共济失调,持续性手足疼痛麻木,精细分辨力减退,听力下降耳毒性等毒性反应[8]。具体的神经毒性分级参考CTCAE4.03版本进行分级。
1.3 血液样本收集及XPC 基因遗传变异分析研究纳入的多态性位点为rs2228001(Lys939Gln),rs2228000(Ala499Val)和rs2229090(37828C >G)[9]。研究首先进行DFS 的分析,结果如表1 所示,只发现了rs2228001(Lys939Gln)位点和DFS 的显著关联。因此,后续的分析都以rs2228001(Lys939Gln)位点进行展开。用酶切方法进行rs2228001 位点的基因分型。对该位点及附近的DNA片段进行扩增,上游引物为:5′⁃GCCTCAAAACCGAGAAGATG⁃3′,下游引物为:5′⁃CTGCCTCAGTTTGCCTTCTC⁃3′,产物片段为237 bp,用BseRI 内切酶通过限制性片段长度多态性聚合酶链反应(PCR⁃RFLP)方法对该位点进行基因分型。通过条带大小判断该位点的基因型:TT 型一条条带:一条237 bp 条带,TG 型三条条带:一条115 bp 条带,一条122 bp 条带,一条237 bp 条带,GG 型两条条带:一条115 bp 条带,一条122 bp 条带。

表1 XPC 多态性位点和DFS 的初步分析Tab.1 The preliminary analysis of XPC polymorphism and DFS
1.4 统计学方法研究中的统计分析均采用SPSS统计分析软件(25.0 版本)进行分析。用χ2分析XPC 基因rs2228001 位点基因型是否符合哈迪温伯格平衡。基线临床资料分析中,离散型变量和连续型变量和rs2228001 位点的基因型的关联分别采用χ2检验和非参的Mann⁃WhitneyU检验进行分析。本研究涉及的生存分析均采用Kaplan⁃Meier 分析方法进行。用Stata 软件(14.0 版本)制作生存曲线,采用对数秩检验方法对曲线间的差异进行比较。用Cox 风险比例模型进行多变量的校正。P<0.05 为差异有统计学意义。
2 结果
2.1 基线临床资料和XPC 基因rs2228001 位点基因型的关联分析入组研究的186 例CRC 患者的基线临床资料如表2 所示。XPC 基因rs2228001 位点基因分型方面,经过PCR⁃RFLP 分析方法结果发现:TT 基因型101 例(54.3%),TG 型70 例(37.6%),GG 型15 例(8.1%),MAF 为0.27,三种基因型的例数符合哈迪温伯格平衡(P= 0.561)。由于GG 型患者相对较少且考虑到后期对比的方便,将TG 和GG 基因型合并。结果见表2,TT 和TG/GG 基因型的患者的基线临床资料基本均衡。
2.2 XPC 基因rs2228001 位点对患者复发风险及预后的影响中位DFS 为4.3年(95%CI:3.90 ~4.70),中位OS为5.5年(95%CI:5.14 ~5.86),见图2。
DFS 分析结果见图3,TT 基因型患者和TG/GG基因型患者的中位DFS 分别为3.8年和5.0年,差异有统计学意义(χ2=6.37,P=0.012)。此外,为了进一步校正其他混杂因素的影响,本研究引入Cox风险比例模型进行多变量校正。将在单因素分析中对DFS 具有显著影响意义的其他基线资料如年龄,ECOG 评分及rs2228001 位点纳入该模型进行多变量校正。结果如表3 所示,经过多变量校正rs2228001 位点不同基因型为DFS 的保护因素(HR= 0.77,P= 0.022)。此外,其他因素为DFS 独立危险因素为年龄(HR=1.41,P=0.015)和ECOG评分(HR=1.81,P=0.011)。

表2 本研究186 例CRC 患者中根据rs2228001 位点不同基因型的基线临床资料比较Tab.2 Comparison of baseline characteristics of the 186 patients with CRC according to rs2228001 genotype status 例(%)

图2 186 例接受奥沙利铂为基础辅助化疗的CRC 患者的DFS 和OSFig.2 The DFS and OS of the 186 patients with CRC receiving oxaliplatin based adjuvant chemotherapy
此外,根据XPC 基因rs2228001 位点基因型状态的OS 分析结果见图4,TT TG/GG 基因型患者的中位OS 分别为5.0年和5.7年,差异有统计学意义(χ2=5.15,P=0.021)。
2.3 奥沙利铂为基础辅助化疗的主要不良反应与XPC 基因rs2228001 位点基因型的关联分析不良反应情况见表4。其中,多态性的关联分析结果见表4,TG/GG 基因型患者的神经毒性发生率显著高于TT 基因型患者(72.9%vs.55.4%,χ2= 6.09,P= 0.014)。其他的不良反应未发现和rs2228001位点不同基因型的显著关联(P>0.05)。
3 讨论

图3 186 例结直肠癌患者中根据XPC 基因rs2228001 位点基因型状态的DFS 对比Fig.3 The comparison of DFS of the 186 patients with CRC according to XPC rs2228001 genotype status
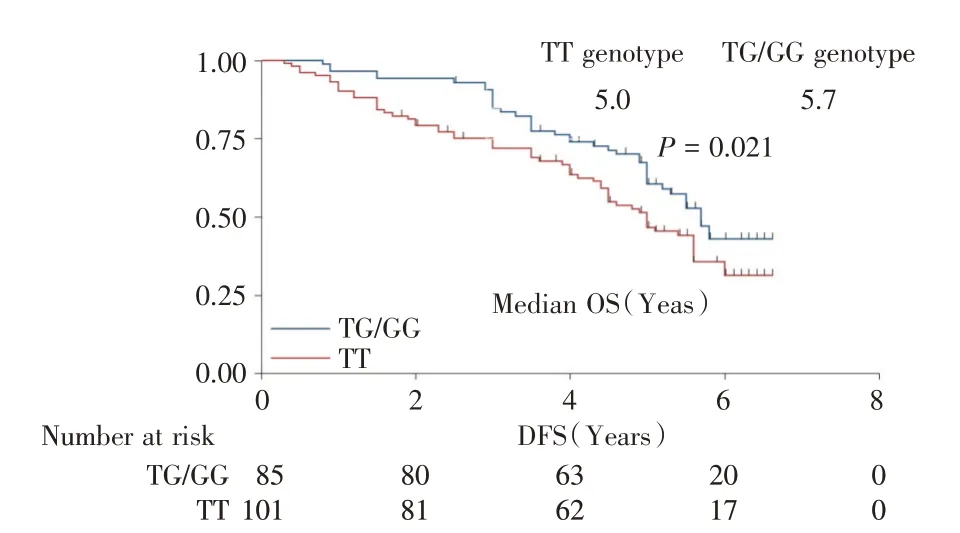
图4 186 例结直肠癌患者中根据XPC 基因rs2228001 位点基因型状态的OS 对比Fig.4 The comparison of OS of the 186 patients with CRC according to XPC rs2228001 genotype status

表3 针对DFS 纳入的基线资料及多态性位点而构建的多变量Cox 分析Tab.3 Multivariate Cox Regression Analysis for DFS according to other baseline characteristics and polymorphism
目前经典的奥沙利铂的化疗方案仍然在CRC的治疗中具有重要的地位[10]。2020年报道的PD⁃L1基因901T >C 遗传变异位点对R0 切除术后接受卡培他滨的辅助化疗方案的结直肠癌患者预后影响的研究[11]。2019年报道的核酸切除修复通路上的RPA1 基因rs5030740 多态性位点对接受一线奥沙利铂联合方案治疗的晚期CRC 患者的疾病控制率和PFS 影响的研究[12]。这些研究结果也都表明了基因遗传变异在CRC 患者的疗效及预后评估方面具有潜在的临床意义。

表4 奥沙利铂为基础辅助化疗的主要不良反应和XPC 基因rs2228001 位点基因型的关联分析Tab.4 The association analysis between the main adverse reactions of oxaliplatin based adjuvant chemotherapy and XPC gene rs2228001 genotype status 例(%)
本研究中186例CRC患者的中位DFS为4.3年,中位OS 为5.5年,预后结果次于奥沙利铂联合卡培他滨辅助治疗Ⅲ期结直肠癌患者的NO16968 研究中的DFS 和OS[13]。可能是因为本研究纳入了较多的ECOG 评分为2 分的患者。NO16968 研究中只纳入了0 ~1分的患者。此外,回顾性研究中患者管理相对于Ⅲ期临床研究相对较差,这也体现在本研究的mFOLFOX6 方案实际完成周期中位只有3 个周期,CAPEOX 方案实际完成周期中位只有4个周期。不充分的辅助化疗在一定程度上会影响患者的复发及预后[14]。
本研究首次发现了在接受奥沙利铂为基础辅助化疗的中国CRC 患者中XPC 基因rs2228001位点对患者DFS 具有独立的影响。Rs2228001 位点的MAF 为0.27,这和数据库中该位点在中国人群中的突变频率基本一致。先前,KAP 等[7]研究表明MNAT1 基因的rs3783819 位点和XPC 基因的rs1043953 位点和CRC 患者的预后存在显著关联。这在一定程度和本研究结果一致。XPC 基因的rs2228001 位点既往研究最多的是该位点和众多肿瘤包括乳腺癌、肺癌、结直肠癌、膀胱癌和胃癌等肿瘤的易感性[15]。结果都提示rs2228001 位点使得编码区的氨基酸谷氨酰胺变异为赖氨酸,总体来说,携带谷氨酰胺即TG/GG 基因型的患者具有较高的肿瘤易感性,尤其是在亚洲患者中[16]。此外,ZHU 等[17]研究分析了XPC 基因多态性位点Lys939Gln 和Ala499Val 和患者疗效的关联。结果表明Lys939Gln 位点TG/GG 基因患者伴随了较低的铂类药物治疗的有效率,这和本研究结果不一致。原因可能和不同癌种以及不同的铂类药物反应有关。rs2228001 位点的多态性使得编码区氨基酸发生了改变,也有研究表明在亚洲人群中TG/GG 基因患者的XPCmRNA 表达水平明显高于TT基因型患者,而体外研究的结果也证实了较高的XPC 表达水平可以增加对于顺铂治疗的敏感性。这些研究的结果和本研究中TG/GG 基因型患者伴随较好的预后是一致的[18]。
神经毒性是奥沙利铂治疗中特异性的不良反应。XPC 基因参与了奥沙利铂引起的DNA 损伤修复过程,XPC 基因的遗传变异,可能会在一定程度上导致DNA 修复功能的降低。这可能是奥沙利铂疗效和不良反应的重要预测因子[19]。总之,未来还需要大样本的前瞻性临床研究进一步验证XPC基因rs2228001 位点在接受奥沙利铂治疗的CRC患者中的疗效及安全性预测价值。
本研究的局限性在于:样本量相对较少,XPC基因遗传变异位点的临床意义尚需要在大样本中进一步评估。此外,回顾性研究的偏倚无法避免。此外,本研究纳入的奥沙利铂方案包括了mFOLF⁃OX6 和CAPEOX 两种方案,两种方案的分布数量和人群都有差异,从而导致研究内部的异质性相对较大。不过,本研究还是相对充分地对XPC 基因的遗传变异位点的预后意义进行了评估,对术后接受奥沙利铂为基础辅助化疗的Ⅲ期CRC 患者的预后评估具有一定的临床指导意义。
