不同时长的过氧化氢刺激对人脐静脉内皮细胞衰老的影响
2021-06-05林朴卿阮云军
林朴卿 阮云军
南方医科大学南方医院老年病科(广州510515)
血管内皮细胞(vascular endothelial cell,VEC)是映衬于血管壁的单层细胞,由于增龄或外界刺激诱导VEC 衰老是血管老化重要的始动因素[1],在动脉粥样硬化[2]、肺动脉高压[3]、脑卒中[4]等血管老化相关疾病发病过程扮演着关键角色。因此,研究VEC衰老机制,寻找衰老过程的关键靶点是防治血管老化相关性疾病有效手段[5]。由于增龄导致自然衰老细胞模型具有周期长、代价大等缺陷,因而较少用于科学研究,取而代之的是诱导性细胞衰老。在饥饿、缺氧、氧化应激等众多诱导性衰老手段中,过氧化氢诱导氧化应激是最为常用的细胞衰老诱导手段[6],具有易于获得、性质稳定、周期短等优势,同时也伴有不易控制、凋亡过多等缺点[7]。本研究将运用H2O2制造人脐静脉内皮细胞(humen umbilical vein endothelial cell,HUVEC)衰老模型,并通过检测不同时间点HUVEC 功能、衰老和凋亡的指标,探讨H2O2诱导HUVEC 衰老的最适作用时间,为细胞衰老的科学研究提供可靠的细胞模型。
1 材料与方法
1.1 主要试剂和材料HUVEC 细胞株由南方医科大学中心试验室赠送;DMEM 无酚红培养基和澳洲胎牛血清购自美国Gbico 公司;细胞用过氧化氢购自上海麦克林公司;MTT 购于美国Sigma⁃Al⁃drich 公司;细胞衰老SA⁃β半糖苷酶染色试剂盒购自上海碧云天公司;细胞内皮素(ET⁃1)、NO 检测ELISA 试剂盒均购自武汉博士德生物公司;MDA、SOD、GSH⁃px 检测试剂盒购自南京建成生物公司;Bax、Bcl⁃2、p21、β⁃actin 兔抗人单克隆一抗,辣根过氧化物酶标记二抗均购自美国CST 公司。
1.2 实验分组与处理HUVEC 复苏后置于37 ℃二氧化碳含量为5%孵育箱用含10%FBS 的DMEM培养,隔日换液,待细胞融合率达80%进行传代,取3 ~5 代细胞进行实验;按H2O2刺激时间(0.5、1、3、6、12、24、48 和96 h)把HUVEC 分为9 组,分别是空白对照组、0.5 h 组、1 h 组、3 h 组、6 h 组、12 h组、24 h 组、48 h 组和96 h 组。
1.3 MTT 检测细胞增值活性HUVEC 消化离心后计数,调整细胞密度为10×104个/mL,吸100 μL细胞悬液种于96 孔板,细胞分组及处理已如上述,每组设5 个复孔,处理后弃去旧培养基,予以100 μL 不含FBS 的DMEM 培养基加10 μL MTT,避光37 ℃孵育4 h 后加入150 μL DMSO,酶标仪570 nm 测OD值,弃去最大、最小值分析统计。
1.4 ELISA 检测ET⁃1、NO 水平按照试剂盒说明书完成制备标准品,绘制标准曲线,然后上样,洗板、加入工作液,再洗板最后到酶标仪检测OD值,具体操作步骤见试剂盒说明书。
1.5 MDA、SOD 和GSH⁃px 测定HUVEC 以适当的密度接种于六孔板中,孵育过夜;然后按照上述分组进行相应处理;收集细胞,按照试剂盒说明书要求完成MDA、SOD、GSH⁃px 的检测。
1.6 Western blotHUVEC 细胞分组处理如上述,加入RIPA 冰上裂解0.5 h 提取总蛋白,BCA 法测定蛋白浓度。按照要检测蛋白的分子大小在组装好的电泳玻璃板中加入适量的10%过硫酸铵、四甲基二乙胺(TEMED)、30%丙烯酰胺(30%Acr⁃Bis)、蒸馏水等配制成适当浓度的堆积胶与分离胶,插入梳子,每孔加入20 μL 总蛋,完成后续电泳、转膜及封闭后,分别以Bax、Bcl⁃2、p21 和β⁃actin 一抗4 ℃孵育过夜。TBST 洗膜3 次,每次10 min,37 ℃孵育二抗1 h,TBST 洗膜三次,ECL 显影。
1.7 统计学方法所有数据均采用SPSS 19.0软件进行分析。所得数据均采用均数±标准差表示。多组之间的比较分析采用单因素方差分析法;组间多重比较采用最小显著差异法(LSD);两样本均数的比较采用独立样本t检验;率之间的比较采用卡方分析;P<0.05(双侧)为差异有统计学意义。
2 结 果
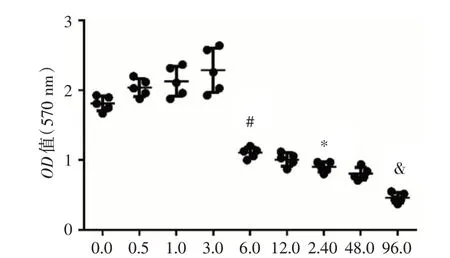
图1 MTT 检测细胞活力Fig.1 MTT assay detected cell viability
2.1 MTT 检测细胞活力与空白组相比,H2O2刺激0.5 h到3 h内,细胞活力逐渐增强,差异无统计学意义(P>0.05);6 h 细胞增殖活性明显下降(P<0.05),往后随着H2O2刺激时间的延长,细胞活力逐渐下降,96 h 达到最低点。见图1。
2.2 SA⁃β糖苷酶染色检测细胞衰老在H2O2刺激0.5 h 到3 h 内,HUVEC 未见明显衰老着色;但随着H2O2刺激时间的延长(3 ~24 h),HUVEC 衰老染色阳性细胞明显增加(P<0.05),24 h 到达高峰,然后一直维持到96 h。见图2。
2.3 ELISA 检测细胞因子变化与空白组相比,在短时间内(0.5 ~3 h)H2O2刺激使HUVEC 分泌ET⁃1 和NO 增加,差异无统计学意义(P>0.05)。随着刺激时间的延长(3 h 以后),HUVEC 分泌ET⁃1 增多,24 h 到达最高值,然后一直减少;3 h后NO 逐渐减少(P<0.05),96 h 达到最小值。见图3。
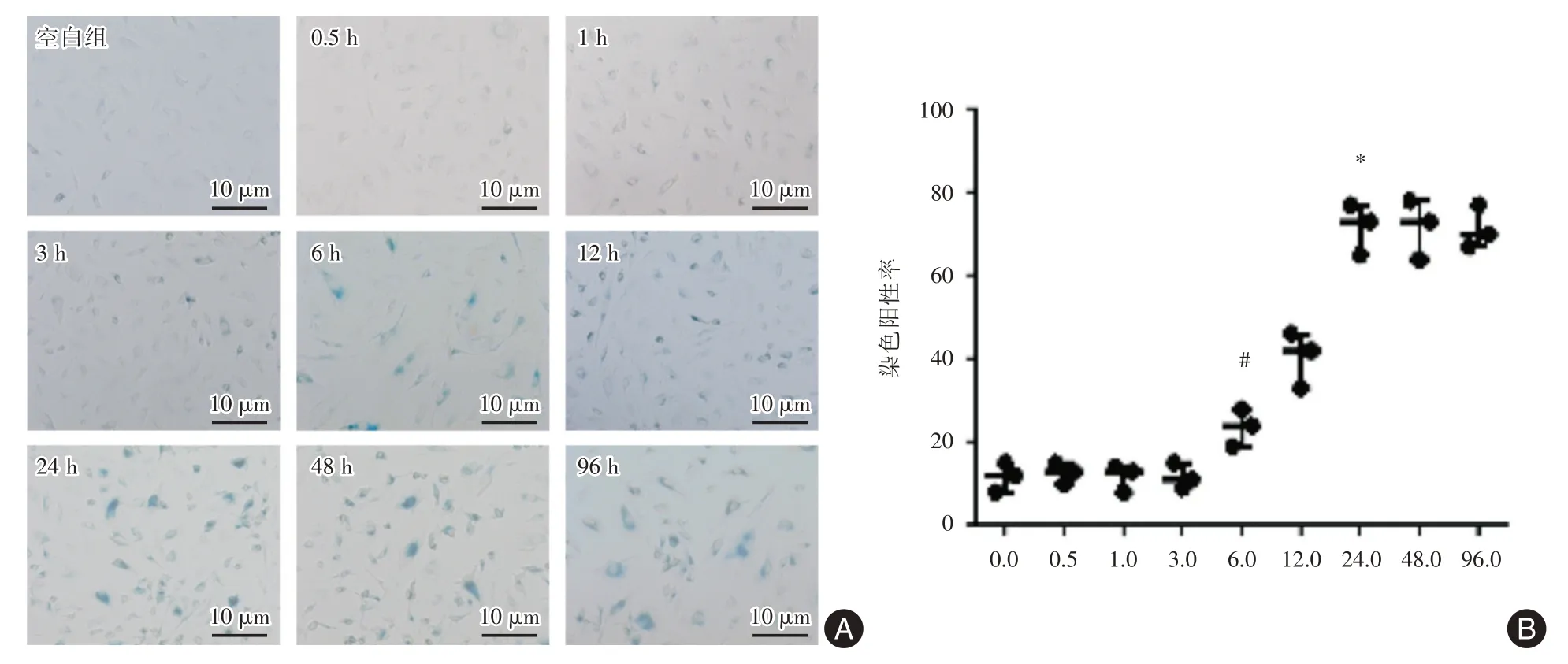
图2 SA⁃β糖苷酶染色检测细胞衰老Fig2 SA⁃β staining detected cell senescence
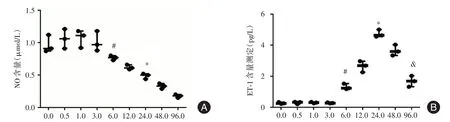
图3 ELISA 检测细胞因子变化Fig.3 Endothelial cells′function were detected by ELISA
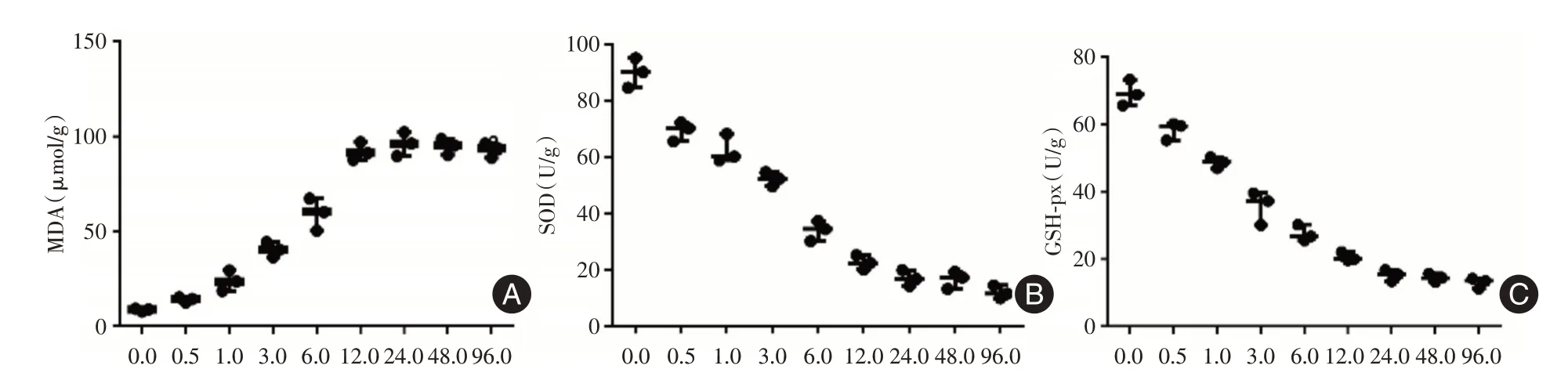
图4 各组细胞氧化应激水平的变化Fig.4 Oxidative stress in different groups
2.4 各组细胞氧化应激水平的变化与空白组相比,H2O2刺激各组细胞氧化应激水平明显升高,表现在MDA 增加,SOD、GSH⁃px 显著降低(P<0.05)。见图4。
2.5 各组细胞凋亡和衰老蛋白表达变化研究结果提示,在H2O2刺激24 h 内,各组细胞凋亡蛋白Bax 和Bcl⁃2 表达无差异;24 h 后,随着H2O2刺激时间的延长,Bax 表达逐渐增多(P<0.05),Bcl⁃2 表达逐渐减少(P<0.05)。衰老蛋白p21 在H2O2刺激3 h 内表达无差异,6 ~12 h 随着刺激时间的延长,p21 表达逐渐增多,24 h 最高(P<0.05),48 h 后表达减少(P<0.05)。见图5。

图5 各组细胞凋亡和衰老蛋白表达变化Fig.5 Expressions of apoptosis and senescence proteins in different groups
3 讨论
正如被誉为“英国的希波克拉底”医生THOMAS SYDENHAM 所说:“A man is as old as his arteries”,与个体衰老伴随而来的是血管老化[8]。VEC 衰老是血管整体老化必不可少的改变,也是众多血管老化相关疾病,如动脉粥样硬化、脑卒中、冠心病等疾病的重要始动因素[9-11]。因此,有学者认为,心脑血管疾病发病率随着年龄逐渐增加的一个重要原因就是由于VEC 衰老降低了这些疾病的发病阈值[12]。
外源性H2O2是强氧化应激因子,可通过损伤DNA、使端粒区域单链断裂等机制在较短时间内诱导细胞早衰[13],使细胞高表达复制性衰老相关的标志物,因此H2O2是优秀的细胞衰老造模工具。但由于H2O2化学性质活泼、不稳定,因此关于H2O2造细胞衰老模型的浓度和时间不同实验室之间均存在较大的差异[14-15]。
本实验室长期致力于VEC 衰老研究,经过反复验证,项目成员发现200 μmol/L 的H2O2可制造出较为稳定的HUVEC 衰老模型[16]。本研究发现,在H2O2作用的0 ~3 h 内,细胞活力反而增强,这是因为在强氧化应激作用下,细胞在短时间内通过调动细胞应激反应以“度过难关”[17],因此此时间段内细胞因子(NO、ET⁃1)分泌稍微增加,但衰老并不明显。但随着H2O2刺激时间的延长(6 ~24 h),细胞氧化应激水平持续升高并超过细胞应激调整能力,细胞活力开始下降,NO 分泌减少,ET⁃1 分泌增加,p21 表达增加,SA⁃β阳性率升高,并且以24 h最明显,即H2O2作用24 h 可作为衰老造模的可靠时间点。一旦超过24 h(48 ~96 h)细胞SA⁃β糖苷酶染色和p21 表达无明显变化,持续升高的氧化应激水平伴有凋亡蛋白表达明显增高,细胞因子分泌减少,这就提示,过长时间的氧化应激可诱导细胞凋亡增多,细胞衰老反而没那么明显。
强烈的氧化应激既可以引起细胞衰老,又可以导致细胞凋亡[18],因此H2O2诱导细胞衰老的一大难点是如何确定一个合适的浓度和合适的作用时长以保证衰老相关指标表达明显增高又能保证细胞凋亡不明显[19]。由于细胞种系的不同,文献报道的H2O2诱导细胞衰老模型的浓度和处理时间亦不一致,浓度低者可至5 μmol/L[20],高者可达1 000 μmol/L[21];作用时间也从4 h[22]到5 d[21]不等。本实验室长期致力血管老化的研究,结合前期研究基础[22-24]并参考国内外研究报道[25-26],认为H2O2诱导细胞衰老的浓度可因细胞种系和实验条件的不同而调整,但作用时间不宜过长,一方面因为刺激时间过长可直接破坏线粒体质膜结构,导致细胞色素C 释放至细胞质,激活caspase 家族,诱导细胞凋亡[27-28];另一方面,刺激时间过长可导致培养液血清耗尽,从而不能界定是氧化应激还是营养剥夺诱导的细胞衰老[29-30]。综合以上研究结果,笔者认为200 μmol/L 的H2O2作用24 h 可成功诱导出HUVEC 衰老模型,可作为其他科学研究的参考。
本研究使用最为常用的H2O2作为工具药物,通过连续观察9 个不同时间点HUVEC 的功能、衰老和凋亡指标,证实了200 μmol/L 的H2O2作用24 h可成功诱导出HUVEC 衰老模型,为血管衰老的研究提供了细胞模型,并可作为实验参考推广至其他种系细胞的研究。但是,由于本研究监测的时间点有限,观察指标尚不完整,因此仍需要进一步的研究去完善H2O2造HUVEC 衰老模型的其他细节问题。
