藤椒及其干燥品的急性毒性和胃肠动力学比较研究
2021-06-04林梦娴饶朝龙
林梦娴,饶朝龙
(1.成都中医药大学 药学院,四川 成都 611137;2.成都中医药大学公共卫生学院药食同用中药效用与安全研究中心,四川 成都 611137;3.西南特色中药资源国家重点实验室(筹),四川 成都 611137)
藤椒又名竹叶花椒(ZanthoxylumarmatumDC.),为芸香科花椒属植物[1],性温,微苦[2],始载于《本草图经》,有小毒,在《神农本草经》中名为“蜀菽”“蜀椒”,被归为下品,主邪气咳逆,温中,寒湿痹痛,下气。目前国内外的研究者已经从藤椒中分离鉴定出60多种化学成分,主要含酰胺、黄酮、生物碱、甾体、三萜和木脂素等成分[3-4],初步研究发现藤椒具有抑菌消炎[5]、保肝[6]、降血脂血糖[7-9]、抗癌[10]、增强免疫与抑制血小板聚集[11]等药理作用。藤椒是传统药食两用资源,含有丰富的活性物质,具有多种生理功能,是集食用、药用和生态价值于一体的经济作物。
藤椒现已被广泛应用在日常生活中,涉及药用、食用以及生活日化等多个方面。在药用方面,藤椒可用于治疗发热、感冒、咳嗽、消化不良、牙疼和一些慢性疾病。在食用方面,藤椒因具有丰富的香味和麻味被作为日常香辛料在川渝地区广泛应用,用于辅助菜肴增味和提鲜[12],是传统香料之一,也有地区将新鲜藤椒作为泡菜食用。同时,基于藤椒广泛的生物活性和丰富的资源,其应用领域已逐渐从食品和药品拓展出来,目前市面上已有如藤椒抑菌皂、藤椒灭蚊液等日化产品。
藤椒的运用已经越来越广泛,但迄今为止,藤椒的安全性或毒性尚未见有明确的研究,其食用和药用安全性无法评价,在合理、安全的使用藤椒时缺少理论依据。因此,本研究通过小鼠经口急性毒性试验评价,明确藤椒的具体毒性表现与中毒剂量范围,并与其干燥品进行毒性对比,初步明确藤椒干燥前后毒性的变化,为合理、安全应用藤椒提供参考。同时,本课题组首次针对藤椒对胃肠动力的作用进行研究,为藤椒在胃肠道方面的使用提供依据。
1 实验材料与设备
1.1 药物制备
鲜藤椒购买自四川省眉山市洪雅县,一部分鲜品冷藏,一部分自然晾晒24 h,然后装筛放入烘箱,烘烤温度60℃,烘烤至藤椒含水量小于10%时取出,去除杂质后得到干藤椒,储存于干燥阴凉处。
分别称取鲜藤椒、干藤椒,按料液比1∶10加入蒸馏水,浸泡0.5 h后用水蒸气蒸馏装置提取5 h得到水提液,水提液经真空抽滤后浓缩至浸膏状,将所得浸膏称重后分装保存于-20℃冰箱备用。
1.2 动物
SPF级ICR小鼠190只,体质量(20±2)g,6周龄,雌雄各半。购自成都达硕实验动物有限公司,许可证号:SCXK(川)2015-030。小鼠被安置在标准环境下(温度为25℃,湿度为50%,光照/黑暗周期为12 h),给予标准动物饲料,自由摄食和饮水。
1.3 试剂
3.2%枸橼酸钠抗凝剂(北京雷根生物技术有限公司,货号:R10140)、吗丁啉(西安杨森制药有限公司,批号:190328099)、ALT、AST、UREA、CREA、TG检测试剂盒(深圳雷杜生命科学股份有限公司,货号:S03030、S03040、S03036、S03076、S03027)、GLU检测试剂盒(长春汇力生物技术有限公司,货号:C050)。
半固体营养糊制备:取10 g羧甲基纤维素钠,溶于250 mL蒸馏水中,分别加入16 g奶粉、8 g糖、8 g淀粉和2 g活性炭末,搅拌均匀,配制成300 mL约300 g的黑色半固体糊状物。
1.4 主要仪器
全自动生化分析仪(深圳雷杜生命科学股份有限公司,Chemray 800);全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司,BC-2800vet)
2 实验方法
2.1 急性毒性试验
根据前期预实验得知,将藤椒浸膏配制成最大浓度以最大给药体积灌胃小鼠,鲜藤椒、干藤椒水提液均可引起动物死亡,且鲜藤椒灌胃小鼠的0%致死量(Dn)和100%致死量(Dm)分别为2.00 g/kg、6.00 g/kg,干藤椒灌胃小鼠的0%致死量(Dn)和100%致死量(Dm)分别为3.53 g/kg、7.00 g/kg,故进行改良Bliss法LD50实验。小鼠110只,适应性喂养3 d后随机分为11组,给药前12 h禁食。给药当天使用2% Tween-80溶液配制药液,鲜藤椒组根据Dn、Dm计算组间剂量比(r=0.76),继而得到各组给药剂量(1~5组依次为生药量2.00 g/kg、2.60 g/kg、3.40 g/kg、4.50 g/kg、6.00 g/kg),干藤椒组间剂量比(r=0.84),各组给药剂量(1~5组依次为生药量3.53 g/kg、4.20 g/kg、5.00 g/kg、5.96 g/kg、7.10 g/kg),对照组给予等体积的2% Tween-80溶液。试验当天对小鼠进行多次观察,此后每日观察并记录小鼠的存活情况、体质量、饮食和运动,连续观察14 d后小鼠禁食12 h,摘眼球取血后处死,部分血液加入抗凝剂,用于血常规检验;剩余血液4℃低温离心得到血清,用于测定血生化。处死后,分离肝、心、脾、肺、肾并称重,将各脏器的重量与其体重相比得到各脏器系数。
2.2 藤椒对小鼠胃肠动力的影响试验
80只小鼠随机分为对照组,阳性药组(吗丁啉3.90 mg/kg)、鲜藤椒干藤椒高中低剂量组(1.48 g/kg、0.74 g/kg、0.37 g/kg),每组10只。各组按照0.1 mL/10 g体质量灌胃给药,第6 d给药后禁食不禁水24 h。
于第7天再给受试物1次,给药半小时后,每只小鼠灌胃0.8 mL营养糊。20 min 后,处死并打开腹腔,去除与整个胃部和肠道相连的系膜,结扎胃贲门和幽门后从两端剪断,拭干后称量,剪开胃体,用提前预冷的生理盐水洗去胃内容物,拭干后再次称量,两次结果之差和所灌糊重的百分比为胃内残留率;剪取胃幽门至回盲部的肠管,直铺于白瓷盘上,从幽门至黑色肠管前端的长度与肠管全长的百分比即为小肠推进率。
2.3 数据统计分析
3 实验结果
3.1 急性毒性试验
3.1.1 半数致死量(LD50)测定
鲜藤椒水提液灌胃小鼠的LD50为3.70 g/kg,95%置信区间为3.20~4.40 g/kg。干藤椒水提液灌胃小鼠的LD50为5.03 g/kg,95%置信区间为4.76~6.00 g/kg,详见表1。

表1 全水提液灌胃小鼠的LD50检测结果
3.1.2 一般状况
观察给药后小鼠的毒性反应,各剂量组小鼠均不同程度地出现活跃增加、呼吸频率加快,深度变浅、四肢颤动等症状,大剂量给药时,动物死亡出现在3~10 min之间,小剂量给药时死亡时间稍有延长,但均在30 min内死亡,死前均有抽搐、惊厥,甚至窜跳等反应。对死亡动物立即剖检见胃内大量残留药液,其余脏器均未见异常。存活动物于2 h后行动迟缓、伏地不能站立、少动并长时间僵住、精神萎靡、反应迟钝,4 h后毒性反应逐渐减轻,活动增加,开始摄食,12 h内基本恢复正常。14 d观察期内给药组小鼠精神状态、运动情况与对照组小鼠无明显差异,整体生存状态良好,正常饮食(P>0.05),见图1、图2。对比对照组与藤椒各剂量组小鼠体质量,差异无统计学意义(P>0.05),保持逐渐升高的正常状态,见图 3。
3.1.3 脏器系数
解剖后通过肉眼观察发现,藤椒各剂量组小鼠脏器组织形态无肿大、出血、粘连等异常变化,与对照组相比无明显器质性病变。通过脏器系数计算,发现藤椒各给药组肝脏、脾脏、胸腺的脏器系数与对照组差异无统计学意义(P>0.05);干藤椒3.53 g/kg、5 g/kg剂量组,鲜藤椒2 g/kg、2.6 g/kg剂量组心脏系数显著升高(P<0.01);鲜藤椒2 g/kg、3.4 g/kg剂量组肺脏系数显著升高(P<0.01);相比对照组,各藤椒给药组肾脏系数均明显增加(P<0.01),见表2。
3.1.4 血常规与血生化
各剂量组小鼠全血中各指标与对照组比较,差异无统计学意义(P>0.05);血清中各生化指标水平无明显差异(P>0.05),见表3、表4。
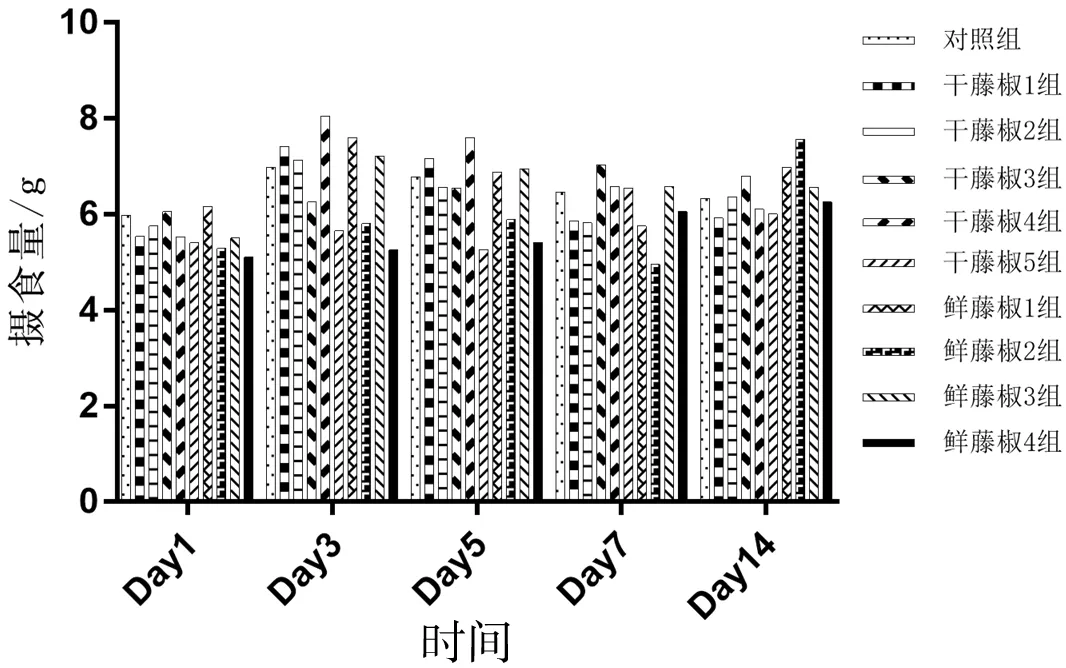
图 1 各组小鼠平均摄食量

图2 各组小鼠平均饮水量

图3 各组小鼠体质量变化
3.2 胃肠动力实验结果
3.2.1 藤椒对小鼠胃排空功能的影响
如表5所示,与正常对照组小鼠比较,鲜藤椒组中胃残留率下降只发生在低剂量组(P<0.05),减少了8.72%,干藤椒高、中、低剂量组小鼠的胃残留率均明显减少(P<0.05),依次减少了8.86%、7.86%、13.45%,说明各剂量的干藤椒均能促进胃排空,其中低剂量改善小鼠胃排空功能的效果更好,比吗丁啉效果更明显。同为低剂量条件下,干藤椒的效果较鲜藤椒明显。
3.2.2 藤椒对小鼠小肠推进功能的影响
如表6所示,藤椒两个低剂量组小鼠的小肠推进率与正常组相比均上升明显(P< 0.01),依次升高了13.99%、15.56%。干藤椒中剂量组也提高了11.79%(P<0.05),鲜藤椒中剂量组无明显差异。干藤椒与鲜藤椒均能明显促进小鼠的肠推进,两者均表现出低剂量促进小鼠小肠蠕动的效果更明显,比阳性药作用效果强。
表2 各组小鼠脏器系数比较
表3 各组小鼠血常规比较
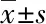
表4 各组小鼠血生化比较
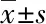
表5 藤椒对小鼠胃排空功能的影响
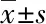
表6 藤椒对小鼠小肠推进功能的影响
4 讨论
通过实验结果可以看出,LD50的结果表明藤椒的急性毒性明显,鲜藤椒的毒性大于干藤椒,经过干燥后,可以明显降低藤椒的毒性,提高安全性,可能是因为干燥过程中会损失藤椒的挥发油、枝叶和藤椒籽,减少的部分均具有一定的毒性。目前也有研究证实藤椒挥发油有显著的驱虫活性[13],枝叶提取物对人宫颈癌细胞[14]、人乳腺癌细胞和结直肠癌细胞有细胞毒性[15],可以印证干燥后毒性会降低的实验结果。藤椒挥发油中含有萜类、酚类、酯类、醇类、黄酮及类黄酮类成分[16-17],藤椒枝叶中也富含酚苷、木脂素等活性物质[18-20],两者在干燥过程中被损失后改变了藤椒的化学物质组成,从而影响藤椒的毒性,后续可以对其化学成分进行研究。相较于鲜藤椒,藤椒干燥品的安全性更高,在藤椒产品开发时,可以通过去籽、干燥等处理方式,达到对藤椒减毒、控毒的目的。从毒性表现来看,主要集中在呼吸、感官、神经肌肉方面,藤椒给药后刺激小鼠呼吸中枢使小鼠呼吸浅快,刺激小鼠躯体运动使其活动先增加后减少,麻痹小鼠感官使其僵住不动且反应迟钝,小鼠四肢震颤、抽搐甚至窜跳是由于刺激神经肌肉导致,藤椒所致毒性反应时间短而强烈,造成小鼠迅速死亡。仍存活的小鼠精神情况、运动和体态良好,饮食、体质量与对正常小鼠比较也无明显差异。作为反映药物毒性的重要指标[21],脏器系数与空白组比较,藤椒各给药组肝、脾、胸腺三个器官的系数无明显差异,心脏系数在干藤椒3.53 g/kg、5 g/kg剂量组,鲜藤椒2 g/kg、2.6 g/kg剂量组有明显升高,鲜藤椒2 g/kg、3.4 g/kg剂量组肺脏系数增加,所有藤椒给药组肾脏系数均明显升高,提示藤椒有潜在的心脏、肺脏和肾脏毒性,但藤椒给药后小鼠血常规与血生化各项指标却无明显变化。未改变的原因可能是由于毒性损伤处于早期,暂时没有引起血液中指标的变化,同时,血液指标易受机体内环境等多因素的影响。但由于解剖观察时未出现肉眼可见的明显病变,此次试验未对脏器进行组织病理学检查,无法观察具体组织损伤情况。
藤椒有芳香健胃、消食通气的功效,在民间常被用来治疗胃气不通,食欲不振[22],但目前尚未有文献明确指出藤椒对胃肠功能的作用,本次试验采用接近小鼠粮食组成的半固体营养糊对小鼠肠推进和胃排空情况进行了研究,更能真实地反映小鼠胃肠运动变化[23]。结果表示,藤椒可以明显促进小鼠的胃排空与肠推进。藤椒提取物在低剂量时对小鼠胃肠动力表现出更明显的促进作用,可能是连续给药后,剂量累积后较大,毒性蓄积,剂量越高,毒性越强,提示藤椒可能存在蓄积毒性并对胃肠道功能的调节作用可能存在毒效关系,尚待进一步证实,可以通过梯度稀释给药剂量并观察作用效果来验证。在同一低剂量给药时,藤椒干燥品的促进效果要明显强于鲜藤椒,证明藤椒通过干燥后可以达到减毒增效的目的,这可能也是与干燥后藤椒成分发生变化有关。
综上,通过对藤椒的毒性研究,首次明确了藤椒的LD50,并与干燥品相对比,明确两者毒性大小,确定其干燥的加工工艺对毒效的影响,为指导藤椒产品的加工利用提供理论依据,对藤椒产品的开发利用有现实性的指导意义。同时,首次针对藤椒对胃肠道动力的影响进行研究,发现藤椒对胃肠动力具有明显的促进作用,为藤椒在调节胃肠功能方面的应用提供了数据支持,发掘出藤椒的潜在价值,对藤椒资源的全方面应用具有重要意义。
