芦可替尼治疗骨髓纤维化阶段性疗效及安全性评估
2021-06-02罗洁谭雅娴黄继贤吴婉儿刘靓周玲玲周璇阴常欣刘晓力许娜
罗洁 谭雅娴 黄继贤 吴婉儿 刘靓 周玲玲 周璇 阴常欣 刘晓力 许娜
1南方医科大学南方医院血液科(广州510515);2粤北人民医院血液科(广东韶关512025)
骨髓增殖性肿瘤(MPN)是以一系或多系髓系细胞增殖为主要特征的克隆性造血干细胞疾病,其中真性红细胞增多症(PV)、原发性血小板增多症(ET)、原发性骨髓纤维化(PMF)是最常见的经典型BCR⁃ABL 融合基因阴性的MPN。而PV、ET在疾病后期可进展为继发性骨髓纤维化(MF),称为Post⁃PV MF、Post⁃ET MF[1]。MF 的临床表现为进行性血细胞减少、肝脾肿大和衰弱症状(疲劳、虚弱、腹痛、恶病质、体重减轻、瘙痒、盗汗和骨痛),并且高风险向白血病转化,导致患者生存质量下降和寿命缩短。研究表明JAK⁃STAT通路的过度活化与MF 的发生发展密切相关。芦可替尼作为一种强效的JAK1/JAK2 选择性抑制剂,是美国食品药物管理局(FDA)批准上市的第一个JAK 家族抑制剂。大量研究证实芦可替尼显著改善MF 患者的生存质量和延长患者的总体生存期(overall survival,OS),现已作为IPSS 中危⁃2 和高危组MF患者治疗的首选。该药2017年于我国上市批准用于治疗中高危PMF、PV 继发的MF 或者ET 继发的MF[2],由于费用相对昂贵,故目前中国人群真实世界关于芦可替尼疗效及安全性报道较少,缺少具有参考价值的临床大数据的支持。本研究拟分析单中心芦可替尼治疗MF 患者的疗效及安全性,同时观察芦可替尼对MF 患者免疫系统的影响,为中国人群真实世界中芦可替尼的用药提供了一定的参考价值。
1 资料与方法
1.1 病例资料回顾性分析2017年6月至2019年5月就诊于南方医院规范服用芦可替尼超过12 个月的60 例MF 患者,其中男29 例,女31 例,中位年龄58(20,78)岁。所有病例均有明确的骨髓活检组织病理学诊断依据,且诊断符合2016年WHO 重新修订的造血和淋巴组织肿瘤分类中关于PPV⁃MF、PET⁃ET 和PMF 的诊断标准[3],入组患者PMF 29 例(48.33%)、PPV⁃MF 16 例(26.67%)、PET⁃MF 15例(25.00%)。确诊MF的患者均根据国际预后积分系统(IPSS)、动态国际预后积分系统(DIPSS)或DIPSS⁃Plus 预后积分系统[4]进行了危险分层,其中中危⁃2组38例(63.33%)、高危组22例(36.67%)。MF 患者的一般临床特征见表1。
1.2 药物剂量根据患者血小板基线计数来确定芦可替尼的起始剂量(50~100)×109/L,10 mg bid;(100~200)×109/L,15 mg bid;>200×109/L,20 mg bid)。本研究中对于就诊时血红蛋白低于90 g/L的患者芦可替尼起始剂量调整为5 mg bid。根据疗效和不良反应发生情况允许进行剂量调整,调整剂量间隔至少2 周,最大用量为25 mg bid[4]。本研究中起始剂量20 mg bid:23例;15 mg bid:11例;10 mg bid:18 例;5 mg bid:8 例。有8 例(13.33%)患者分别在用药后的第2、3、8、12、24 周减小药物剂量,减量的主要原因是血小板减少和贫血;有2 例(3.33%)患者用药后第8 周因严重贫血而停药,停药2 个月后贫血好转又继续用药;有3 例(5.00%)患者因疾病进展停药;其余患者的药物使用剂量随访期间稳定维持。
1.3 疗效及不良反应评估使用MPN 症状评估表(MPN⁃SAF⁃TSS)[5]评估服用芦可替尼12 个月后患者总症状评分较基线的变化,观察总评分降低≥50%的患者比例。采用超声技术测量患者脾脏的长径和厚径来评估脾脏大小,观察服用芦可替尼12 个月,患者脾脏长厚径较前缩小情况。骨髓纤维化程度通过骨髓活检活组织切片病理染色来分析,根据WHO(2016)定义的骨髓纤维化分级[3,6]进行评估。JAK2V617F 等位基因突变量的定量检测通过实时定量PCR(RT⁃PCR)法来检测,等位基因负荷改善率根据前后PCR 结果来评估。
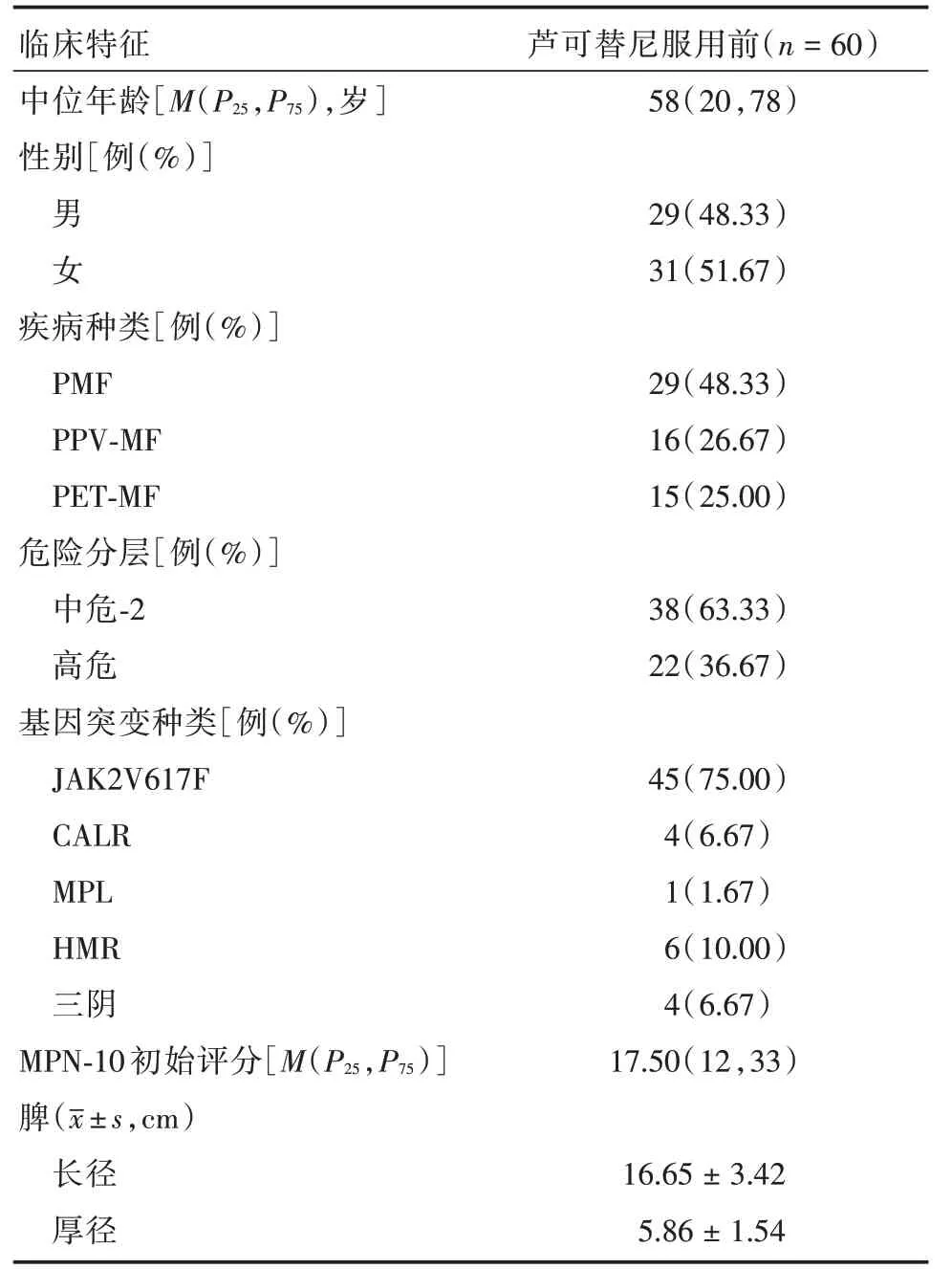
表1 60 例骨髓纤维化患者的一般临床特征Tab.1 Basic clinical characteristics of 60 patients with myelofibrosis
药物不良反应的严重程度是依据美国国家癌症研究所(NCI)发布的不良反应常用术语标准(CTCAE)4.0 版进行评估的,根据定义:1 级=轻度,2 级=中度,3 级=重度,4 级=危及生命或致残。
1.4 流式细胞术检测T 细胞亚群变化T 淋巴细胞亚群及NK 细胞检测使用直接免疫荧光染色法(试剂及仪器均采购于美国BD公司)。全部患者均于清晨空腹抽取静脉血2 mL 置于EDTA 紫色抗凝管中,各取血50 μL 置于4 个试管中,分别加入荧光素标记抗人CD3⁃APC/CD19⁃Pacific,CD3⁃PerCP⁃Cy5⁃5/CD4⁃APC/CD8⁃PE,CD3⁃APC/CD56⁃PE 单克隆抗体各5 μL,留一个空白对照试管。混匀后置于阴暗处4 ℃孵育20 min。各加红细胞裂解液2 mL充分震荡混匀,置于阴暗处18~20 ℃孵育10 min。待红细胞充分溶解后2 000 r/min 离心5 min;加1 mL PBS 洗液,2 000 r/min 离心5 min,弃上清液,重复1 次;加300 μL PBS 洗液重悬,上机检测。以CD3+CD19-T 细胞表示总T 细胞,CD3+CD4+T 细胞标记Th 细胞(辅助性T 细胞),CD3+CD8+T 细胞标记Tc 细胞(细胞毒性T 细胞),CD3-CD56+代表NK 细胞,记录T 细胞、NK 细胞的阳性细胞百分率。
1.5 随访通过走访、门诊进行随访。随访终止时间为2020年5月31日,中位随访时间为20(12,34)个月。
1.6 统计学方法应用SPSS 22.0 软件进行统计学分析,正态性计量资料以均数±标准差描述,非正态性计量资料以M(P25,P75)描述,计数资料以例(%)描述,自身对照采用配对样本t检验或Wilcoxon 符号秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 症状评分评估随访12 个月,49 例(81.67%)患者总症状评分较基线有不同程度的下降,其中31例(51.67%)患者总症状评分降低≥50%。基线中位MPN⁃10 评分为17.50(12,33),随访12 个月后减少至10.00(6,18),差异有统计学意义(P<0.01)。治疗期间,患者的各项单项症状均明显改善,中位症状评分改善均≥50%(表2)。
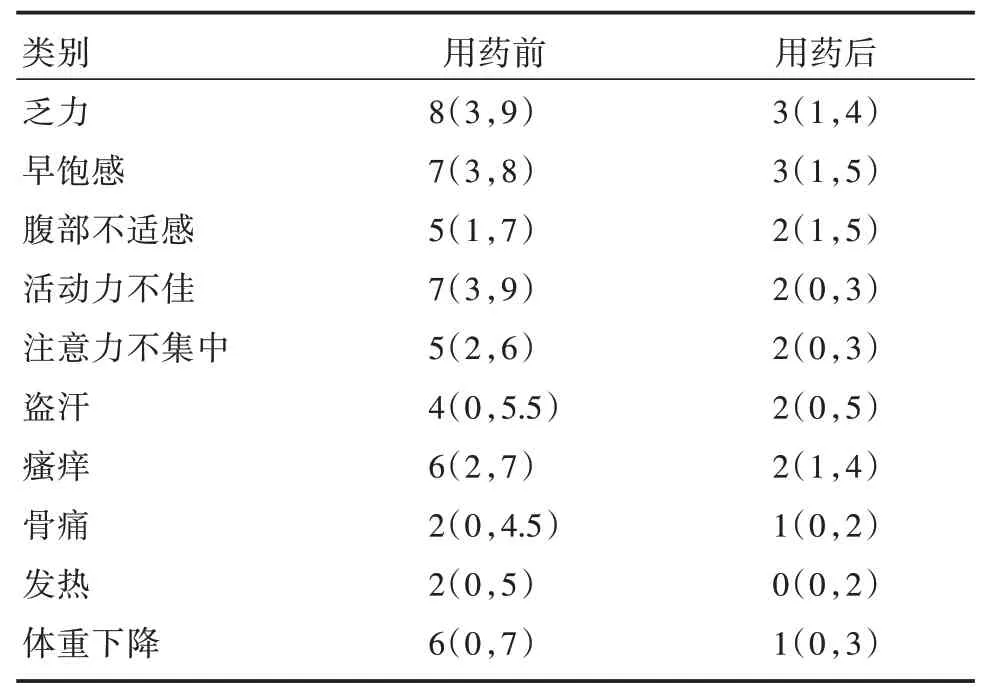
表2 骨髓纤维化患者接受芦可替尼治疗前后各项症状评分变化Tab.2 The changes of symptom scores in patients with myelofibrosis after treat with ruxolitinib M(P25,P75)
2.2 脾脏大小评估基线时45 例患者存在脾脏肿大,治疗期间40 例(88.89%)患者有不同程度的脾脏缩小。患者在服用芦可替尼前后均用B 超测量了脾脏的长径和厚径,基线脾脏平均长厚径分别为(16.65±3.42)、(5.86±1.54)cm,随访12 个月分别缩短至(14.93 ± 3.02)、(5.32 ±1.29)cm,差异有统计学意义(P<0.001,表3)。

表3 骨髓纤维化患者接受芦可替尼治疗前后脾脏长径变化Tab.3 The length of the spleen after the treatment of ruxolitinib in patients with myelofibrosis 例(%)
2.3 骨髓纤维化改善率及JAK2V617F 等位基因负荷改善率至随访结束共取得42 例患者服用芦可替尼前后的骨髓病理结果,其中24 例(57.14%)患者骨髓纤维化程度稳定,15 例(35.71%)患者较基线有所改善(包括1 例从3 级、2 例从1 级改善至0级),3例(7.14%)患者加重,见表4。45例(75.00%)患者合并JAK2V617F基因突变,基线中位等位基因负荷为52.40%(23.09%,78.67%),随访12个月该基因突变负荷中位下降了0.90%,差异无统计学意义(P=0.600)。

表4 骨髓纤维化患者接受芦可替尼前后骨髓纤维化程度变化Tab.4 Bonemarrow fibrosis in patients with myelofibrosis after ruxolitinib therapy
2.4 安全性随访期间,47 例(78.33%)患者经历了一种或多种不良反应(任何级别),19例(31.67%)患者发生3/4 级不良事件。10 例(16.67%)患者因不良事件而药物减量或中断治疗,3 例(5.00%)因不良事件而终止给药。
常见的血液学不良反应为贫血(68.09%,3/4 级19.15%)和血小板减少(40.43%,3/4 级8.51%)。患者平均血红蛋白水平和血小板计数在开始治疗后的前8 周显著下降,随后逐渐恢复至平均血红蛋白≥110 g/L,平均血小板计数维持在300×109/L 的水平(图1)。几乎所有发生3/4 级贫血的患者经红细胞输注后贫血症状改善,仅1 例患者因重度贫血而停药;发生3/4 级血小板减少事件的患者均经调整芦可替尼剂量后好转。

图1 平均血红蛋白和血小板计数随芦可替尼治疗时间的变化Fig.1 Mean hemoglobin and platelet counts changes with the treatment time of ruxolitinib
非血液学不良反应主要观察到感染的发生,14 例(23.33%)患者在服用芦可替尼后出现感染,包括尿路感染(1 例)、肺炎(7 例)、肺结核(3 例)、带状疱疹(1 例)、巨细胞病毒(1 例)、隐球菌性脑炎(1 例)。其中2 例患者因严重感染而停药,其余患者在针对感染症状治疗后好转。为探索芦可替尼对患者免疫功能的影响,采用流式细胞术检测患者服用芦可替尼前后免疫细胞亚群的变化情况(表5、图2),结果显示在使用芦可替尼后MF 患者外周血中CD3+、CD3+CD4+、CD3+CD8+T 细胞及NK细胞百分率均有所下降,其中NK 细胞百分率在治疗前后的差异有统计学意义(P=0.020),见表5。
表5 骨髓纤维化患者接受芦可替尼治疗前后免疫细胞亚群对比Tab.5 Immune cell subsets in patients with myelofibrosis before and after the therapy of ruxolitinib±s,%
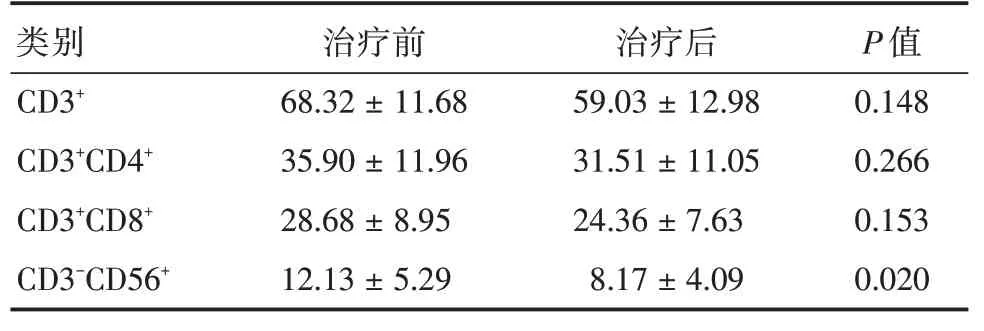
表5 骨髓纤维化患者接受芦可替尼治疗前后免疫细胞亚群对比Tab.5 Immune cell subsets in patients with myelofibrosis before and after the therapy of ruxolitinib±s,%
类别 治疗前 治疗后P 值CD3+68.32±11.6859.03±12.980.148 CD3+CD4+35.90±11.9631.51±11.050.266 CD3+CD8+CD3-CD56+28.68±8.95 12.13±5.29 24.36±7.63 8.17±4.09 0.153 0.020
3 讨论

图2 流式细胞术检测治疗前后患者免疫功能的变化Fig.2 Flow cytometry to detect changes in the patient′s immune function after the treatment of ruxolitinib
骨髓纤维化是一种异质性疾病,JAK⁃STAT 信号通路的过度激活导致造血干细胞过度增殖和炎症因子的过度释放是其发生的核心机制。当前骨髓纤维化的治疗目标是缓解疾病相关症状和体征,提高患者生存质量,改善/逆转骨髓纤维化,延长生存。芦可替尼是一种JAK1/JAK2 选择性抑制剂,本研究显示芦可替尼通过抑制JAK⁃STAT 通路,可显著改善骨髓纤维化患者体质性症状、缩小肿大脾脏、稳定或改善骨髓纤维化程度、一定程度降低JAK2V617F 基因突变负荷,与文献报道基本一致[7-11]。此外,本研究还评估了芦可替尼治疗骨髓纤维化的安全性并探讨了芦可替尼对患者免疫细胞的影响,旨为真实世界中芦可替尼的用药提供一定的参考价值。
既往研究[5]表明,芦可替尼对MF 患者有良好疗效。本研究采用MPN⁃SAF⁃TSS(MPN 症状评分表⁃总积分)对MF 患者的症状负荷进行评估,该评分包括乏力、早饱感、腹部不适、活动力不佳、注意力不集中、盗汗、皮肤瘙痒、骨痛、发热及体重下降10项指标,每项症状由轻至重评分为0~10分,满分100 分。随访12 个月,81.67%的患者总症状评分较基线有不同程度的下降,其中51.67%的患者经历了总症状评分较基线改善≥50%,与A2202 临床研究相近(53.1%的患者总症状评分降低≥50%)[11]。在一项芦可替尼治疗亚洲MF 患者的研究中,患者的单项症状有明显改善(盗汗:-49.9%;早饱:-35.5%;腹部不适:-30.6%)[12],本研究中患者各项指标的评分均有较大改善,显示了芦可替尼在提高患者生存质量方面的优越性。
除改善MF 患者体质性症状外,芦可替尼还具有缩脾效果。随访12 个月,结果显示88.89%的患者有不同程度的脾脏缩小;其中,脾脏长厚径缩短≥35%的患者比例分别为31.11%、28.89%。脾反应率较A2202 临床试验稍差(39.7%的患者脾脏体积较基线水平缩小≥35%),这可能与两个实验用于衡量脾脏大小的标准不同所造成,A2202 临床试验采用MRI 或CT 通过测量脾脏体积来评估用药前后脾脏的变化,而本研究则采用B 超通过测量脾脏长厚径来评估。此外,许多研究还提到使用肋下可触及脾脏长度作为衡量脾脏大小的标准[7,9,12],但不论是以何种标准来衡量脾脏大小试验结果都说明了芦可替尼具显著的缩脾效果。
骨髓纤维化程度被认为是MPN 患者预后不良的一个重要影响因素[13-14]。在一项长期使用芦可替尼和最佳可行治疗(BAT)对MF 患者骨髓纤维化影响的研究中,发现与BAT 相比,芦可替尼改善或稳定骨髓纤维化几率更大[10]。本研究随访12 个月,发现92.86%的患者骨髓纤维化程度改善或稳定,反应率较好。JAK2V617F 等位基因负荷与疾病表型相关,白细胞计数和血红蛋白水平较高且脾肿大程度患者往往合并较高的等位基因突变负荷。COMFORT⁃Ⅰ中延长芦可替尼治疗时间可以降低JAK2V617F 等位基因负荷,虽然平均变化不大,但一部分患者实现了分子学缓解,并且这种效果与基线等位基因负荷水平无关[15]。而在本研究中随访12 个月,JAK2V617F 等位基因负荷中位下降了0.90%。以上结果提示芦可替尼具有逆转或缓解骨髓纤维化程度的作用,并可减轻JAK2V617F基因突变负荷。
JAK⁃STAT 信号通路通过介导来自多种细胞因子(IL⁃2、IL⁃6 等)和造血生长因子(EPO、TPO、G⁃CSF 等)的信号在正常造血中发挥核心作用,而芦可替尼作为一种JAK1/2 强抑制剂,也可能具有骨髓抑制作用。在既往的临床研究中,芦可替尼最常见的血液学不良反应为贫血和血小板减少[16]。本研究中贫血、血小板减少的发生率分别为68.09%、40.43%,并且3/4 级贫血和血小板减少事件均在开始治疗的前8 周发生,与既往研究报道的基本一致[7,11],提示在使用芦可替尼后的一段时间内应密切监测血常规至患者血象稳定。尽管贫血和血小板减少发生率较高,但绝大多数患者经输注红细胞、减小药物剂量或暂时中断治疗后症状改善,仅5.00%的患者因不良反应而停药。
此外,JAK⁃STAT 信号通路对免疫系统中细胞因子的激活和信号传递也是至关重要的,因此,MPN 患者表现出循环中致炎因子水平异常升高,从而导致疾病相关的全身症状。笔者前期研究工作中也发现MPN 患者循环中TPO、IL⁃6、IL⁃8、IL⁃12等炎性细胞因子较正常对照组明显升高[17]。而芦可替尼作为一种JAK 抑制剂,其抑制细胞因子作用可明显改善患者全身症状,但同时也会引发免疫抑制效应,进而导致感染的发生。芦可替尼的细胞抑制靶点包括先天和获得性免疫系统成分,如树突状细胞(DC),自然杀伤细胞(NK),辅助性T 细胞和调节性T 细胞(Tregs)[18]。DC 是一种抗原呈递细胞,在诱导抗原特异性T 细胞反应中具有关键作用[19]。BARONE 等[20]研究显示暴露于芦可替尼后,树突状细胞数量减少、功能受损,从而导致T 细胞活化受损。NK 可非特异性杀伤肿瘤细胞、病毒感染细胞等,CURRAN 等[21]在研究中发现使用芦可替尼治疗的患者NK 细胞数量明显减少,这可能是因为其抑制了对NK 细胞终端成熟至关重要的细胞因子(IL⁃2、IL⁃15)的合成,并发现合并NK 细胞缺乏的患者更易合并感染。Tregs 细胞调节自身反应性淋巴细胞并调节先天和适应性免疫反应。BARONE 等[20]发现接受了芦可替尼治疗的患者Tregs 细胞较健康人显著降低,并且芦可替尼停药或是减量都会影响Tregs 细胞的数量及功能,且对Tregs 细胞的影响是不可逆的。SANT′ANTO⁃NIO 等[22]发现芦可替尼在体内外均可快速抑制CD4+T 细胞分泌炎症因子,进而抑制免疫功能活化而增加感染发生率。本研究中感染发生率为23.33%,服用芦可替尼后MF 患者循环中CD3+、CD3+CD4+、CD3+CD8+T 细胞及NK 细胞百分率均有所降低,表明机体存在免疫功能的受损,与上述研究的结论一致,说明芦可替尼的使用可能引起机体免疫抑制效应,提示在应用芦可替尼或其他JAK 抑制剂治疗时应仔细询问既往感染史并进行积极的安全性评估,及时防控感染的发生。
总之,本研究结果表明芦可替尼可显著改善骨髓纤维化患者症状、缩小肿大脾脏、稳定或改善骨髓纤维化程度、一定程度降低JAK2V617F 基因突变负荷。不良反应主要为可控制的贫血和血小板减少,对于芦可替尼的免疫抑制作用导致感染事件的发生需谨慎对待。不足在于本研究为单中心回顾性研究且病例数较少,可能会存在偏移;此外一年的观察期较短缺乏长期随访。因此芦可替尼对于真实世界中的疗效仍需要进一步扩大样本量,进行下一阶段的观察。
