缺氧条件下CK1δ和PER1可调控BV2细胞的线粒体形态
2021-06-02金晶刘雨朦张栋葛建陈思源施海媛何明利
金晶 刘雨朦 张栋 葛建 陈思源 施海媛 何明利
1徐州医科大学附属连云港医院神经内科(江苏连云港222002);2南京医科大学连云港临床医学院(江苏连云港222002)
缺血性脑卒中是一种常见的难治性疾病,其主要发病机制是脑血管阻塞导致局部脑组织缺血缺氧,进而导致一系列病理生理事件,例如小胶质细胞的激活、能量代谢异常、氧化应激等[1-3]。近几年的研究显示缺血性脑卒中的发病时间及损伤程度具有时间依赖性[4-5],疾病与昼夜节律之间的潜在联系受到关注。OLIVEIRA 等[6]研究显示生物体昼夜节律的异常会改变缺血性脑卒中患者的活动水平。同时,动物实验观察到缺血性脑损伤与核心生物钟蛋白PER1 的节律性改变密切相关[7]。上述实验均提示昼夜节律的破坏可能参与了缺血性脑卒中的发生发展过程。
PER1 蛋白是昼夜节律调控中的重要一环,CK1 蛋白对PER 蛋白的磷酸化被认为是决定生物钟速度的关键步骤[8]。CK1 存在六个亚型(α、γ1、γ2、γ3、δ和ε),CK1δ是大脑和行为节律中介导PER 昼夜起搏的主要内源性调节因子[9]。据报道,CK1 活性改变会影响小鼠的脑梗死体积[10]。此外,WIEBKING 等[11]通过敲除小鼠Per1 基因发现,PER1 能通过调控凋亡和自噬相关因子的表达调节小鼠的脑损伤情况。但最近的研究表明,PER1 能够优化线粒体功能以适应能量供应/需求的每日变化[12],提示CK1δ、PER1 对于缺血性脑卒中的调控可能是通过调控线粒体的功能实现的。因此,本研究以BV2 细胞为研究对象,用CoCl2处理细胞来模拟脑卒中时细胞的缺氧状态[13],在细胞缺氧条件下,抑制、敲低和过表达CK1δ来检测昼夜节律的调控基因PER1 及线粒体的功能,以揭示昼夜节律基因CK1δ、PER1 调控缺血性脑卒中的分子机制。
1 材料与方法
1.1 细胞培养与缺氧处理BV2 细胞购自上海中科院细胞库,与含10%胎牛血清的DMEM(Gibco)一起置于37 ℃、5%CO2细胞培养箱中培养。将CoCl2(Sigma⁃Aldrich)溶解于双蒸水中,配成100 mmol/L母液,分装保存于-20 ℃冰箱,使用时用完全培养基稀释成50、100、200、400、800 μmol/L 处理细胞。
1.2 实时定量PCR(quantitative real⁃time,PCR)使用Trizol(Invitrogen)提取细胞总RNA,并溶解于RNA free 的ddH2O 中,紫外分光光度仪(Invitrogen)分析RNA 纯度并测定其浓度。按照逆转录试剂盒(Invitrogen)的说明,将RNA 反转录为cDNA。Primer Premier 5.0 软件设计并合成Per1 和CK1δ的引物序列:Per1 正向(5′⁃3′)GTCTAGCTGGTGCCA⁃TTCTC 和反向(5′⁃3′)CTCGATGTAACGGCTTGTG;CK1δ正向(5′⁃3′)ACGCCGGGATCGAG⁃AAGAA 和反向(5′⁃3′)CCGACCGGGAATCTGTG⁃AG。用PCR仪进行扩增,扩增参数为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火延伸30 s,扩增32 个循环,分析数据。
1.3 CK1δ抑制剂PF670462(Med Chem Express)在DMSO(Sigma)中配制成10 mmol/L 储存液,使用时用培养基稀释至0.25、0.5、1、2 μmol/L 处理细胞,并用PBS 作为对照。
1.4 CK1δ过表达采用脂质体转染的方法,按照Lipofectamine 2000 试剂(Invitrogen)的转染说明,用无血清培养基稀释pEGFP⁃CK1δ质粒(上海生工构建)和脂质体,室温混合20 min 后加入到BV2 细胞中,轻轻混匀,置于37 ℃培养箱中培养,6 h 后更换为完全培养基,用荧光显微镜观察荧光后继续培养48 h,免疫印迹法(Western blot)检测CK1δ蛋白的表达。
1.5 siRNA 介导的CK1δ沉默针对CK1δ mRNA不同基因位点设计并合成3 条干扰序列及阴性对照序列(上海吉玛制药技术有限公司),分别命名siRNA 1、siRNA 2、siRNA 3 及siRNA NC。siRNA1正义链:GGAUCAGUGAGAAGAAAGAUTT,反义链:AUCUUCUUCUCACUGAUCCTT;siRNA2 正 义 链:GGGACUACAAUGUCAUGGUTT,反义链:ACCAU⁃GACAUUGUAGUCCCTT;siRNA3 正义链:GACAG⁃CUCUUCAGAAAUCUTT,反义链:AGAUUUCUGA⁃AGAGCUGUCTT。根据lipo2000 说明书,用50 pmol siRNA 转染6 孔腔中的2.5×105BV2 细胞,6 h 后荧光显微镜观察荧光,48 h 后Western blot 检测CK1δ蛋白的敲低效果。
1.6 Western blot收集各组细胞,RIPA 裂解液提取总蛋白,细胞核抽提试剂盒(碧云天)提取细胞核蛋白,BCA 蛋白浓度测定试剂盒测定蛋白质浓度。将提取蛋白与蛋白上样缓冲液1∶4 混合后100 ℃煮沸5 min。使用SDS⁃PAGE 电泳分离后转移至PVDF 膜,加5%脱脂奶粉封闭1 h,加入一抗Per1(1∶500)、CK1δ(1∶5 000)和Tubulin(1∶1 000)4 ℃过夜,TBST液洗膜3次,随后加入二抗(1∶1 000),37 ℃孵育1 h。用显影仪扫描胶片,Image J 软件(Bio⁃Rad 公司,美国)分析条带灰度值。
1.7 线粒体和细胞核染色将BV2 细胞以5×107接种至激光共聚焦专用培养皿中按照试剂盒说明方法进行线粒体和细胞核标记。细胞培养24 h后,加入Mito Tracker Red(Invitrogen)和Hoechst(凯基生物)染色液,置于培养箱中孵育30 min,共聚焦显微镜(Nikon)观察线粒体和细胞核的形态。
1.8 统计学方法使用SPSS 26.0 软件分析数据,t检验比较两组之间的差异,单因素方差分析比较多组间的差异。数据表示为均值±标准差,P<0.05为差异有统计学意义。
2 结果
2.1 缺氧条件下Ck1δ和Per1 基因的mRNA 表达水平本研究采用CoCl2处理BV2 细胞后,Western blot 检测结果显示,CoCl2浓度为200 μmol/L 时,缺氧诱导因子HIF⁃1α蛋白的相对表达量达到峰值(图1A)。用200 μmol/L CoCl2分别处理BV2细胞6、12、24、48 h 来探究最佳处理时间,结果显示200 μmol/L CoCl2处理细胞在24 h时,HIF⁃1α蛋白的相对表达量达到峰值(图1B)。因此,在200 μmol/L CoCl2处理24 h 后提取细胞总RNA,qPCR 检测结果显示与常氧条件相比,CK1δ和Per1 在缺氧条件下的mRNA 表达水平降低,差异有统计学意义(P<0.05,图1C、D)。
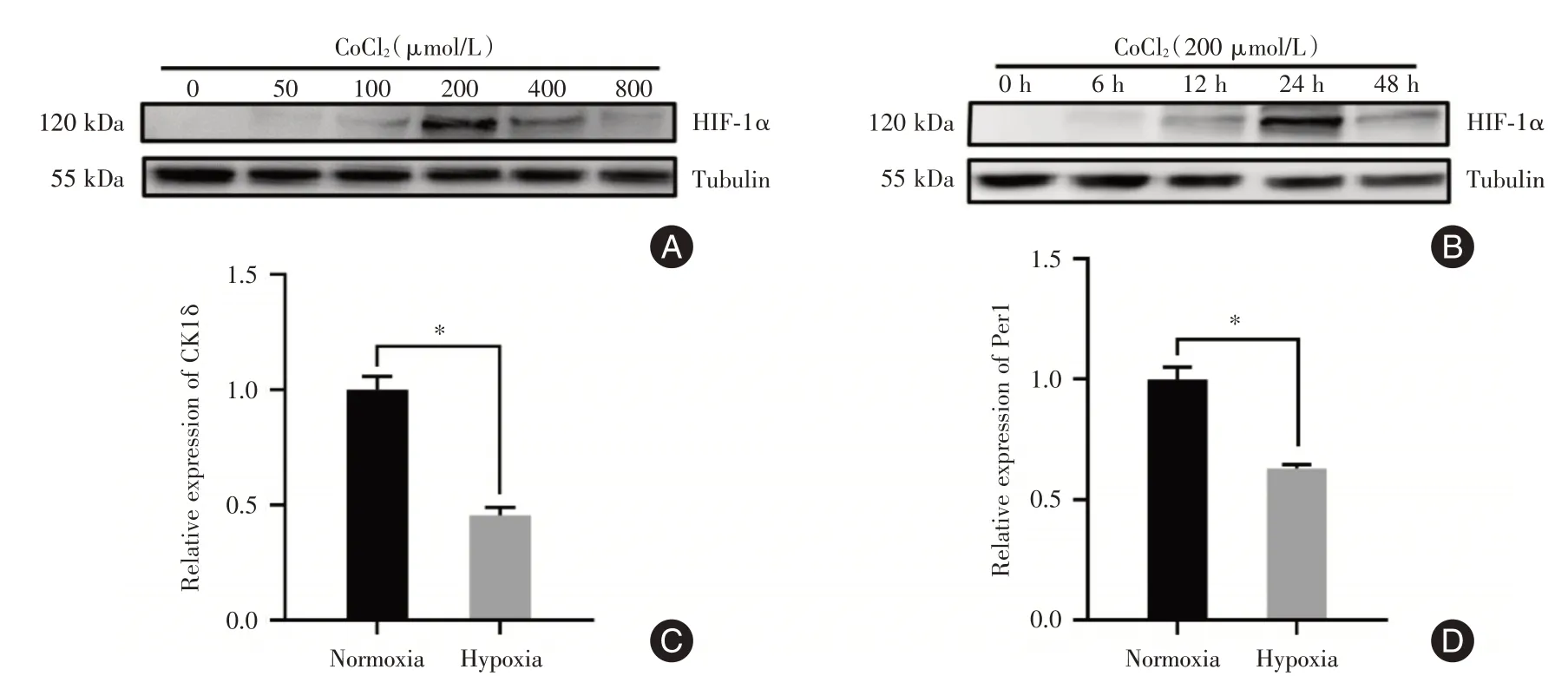
图1 Western blot 检测HIF⁃1α蛋白和qPCR 检测CK1δ、Per1 基因的mRNA 表达量Fig.1 Western blot detects HIF⁃1α protein,qPCR detects the mRNA expression levels of CK1δ and Per1 genes
2.2 抑制、敲低和过表达CK1δ后细胞总PER1 蛋白表达CK1δ特异性抑制剂PF⁃670462处理BV2细胞后,CK1δ蛋白的表达水平明显降低,且1 μmol/L PF⁃670462 处理24 h 对CK1δ蛋白的抑制效果最佳(图2A)。siRNA 序列干扰以及过表达载体转染后,与对照组相比,siRNA1 干扰效果最好,CK1δ⁃pEGFP 的表达量明显增加(图2B、C)。1 μmol/L PF⁃670462、siRNA1、pEGFP⁃CK1δ在常氧和缺氧条件处理BV2 细胞后,Western blot 结果显示常氧和缺氧组中CK1δ蛋白的减少或增加不会引起细胞中总PER1 蛋白表达量的改变,但相比于常氧组,缺氧处理后PER1 蛋白表达量有所降低(图2D),进一步验证了上述结果。
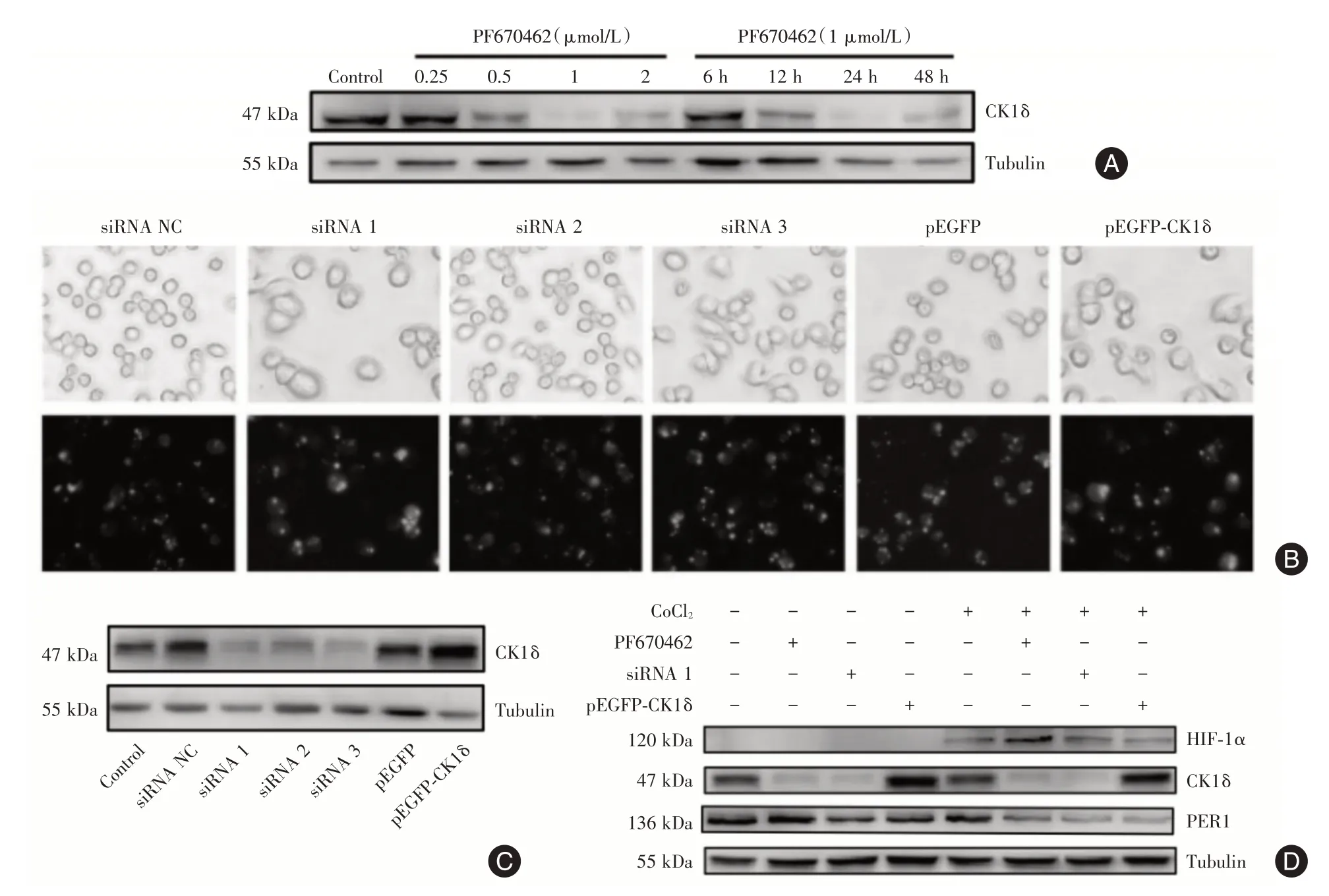
图2 抑制、敲低和过表达CK1δ后细胞总PER1 蛋白表达Fig.2 Inhibition,knockdown andoverexpression of CK1 δ induced the expression of total Per1 protein
2.3 抑制、敲低和过表达CK1δ后细胞核中PER1蛋白表达量本研究检测缺氧条件下CK1δ蛋白表达量改变对PER1 蛋白亚细胞定位的作用,结果发现,常氧和缺氧条件下,抑制和干扰CK1δ导致细胞核中PER1 蛋白表达量上升,过表达CK1δ会降低细胞核中PER1 蛋白的含量。与常氧条件相比,缺氧条件下抑制和干扰CK1δ时,细胞核中PER1蛋白的表达量明显升高(图3)。

图3 抑制、敲低和过表达CK1δ后细胞核中PER1 蛋白表达量Fig.3 The expression level of Per1 protein in the nucleus after inhibition,knockdown and overexpression of CK1δ
2.4 qPCR 检测Tom22、Tim23、Mfn1、Drp1、Ucp1、Pink1 的mRNA 表达量在抑制、敲低和过表达CK1δ后检测多个线粒体蛋白的变化,qPCR结果显示,CK1δ表达量的改变对线粒体外膜蛋白Tom22、线粒体内膜蛋白Tim23、解偶联蛋白Ucp1的mRNA 表达量几乎没有影响,差异无统计学意义(P>0.05,图4 A、B、D),但抑制和敲低CK1δ会引起线粒体融合蛋白Mfn1 的表达量增加以及线粒体裂变蛋白Drp1 的表达量降低,且过表达CK1δ造成Mfn1 表达量降低以及转运激酶Pink1、Drp1表达量增加,差异有统计学意义(P<0.05,图4C、E、F)。
2.5 线粒体形态图4 的结果提示,CK1δ和PER1表达量的改变会影响Mfn1 和Drp1 基因的mRNA表达水平。由于DRP1 和MFN2 是控制线粒体形态的关键基因,本实验利用Mito Tracker 和Hoechst 处理细胞,共聚焦显微镜观察线粒体的形态。结果显示,相比于对照组,CK1δ抑制剂组和敲低组线粒体的线状占比增加,而CK1δ过表达组的点状占比明显增加。见图5。
3 讨论
CoCl2是目前广泛用于细胞化学缺氧模拟的药物之一,能够稳定持续地诱导细胞处于缺氧状态[14]。本研究采用CoCl2成功构建了BV2 细胞缺氧模型,缺氧处理后Ck1δ和Per1 的mRNA 表达水平明显下降,这与之前的研究结果一致,缺氧环境下HIF⁃1α的激活会改变昼夜节律基因的表达水平[15-16]。已有证据表明,通过物理作用,生物钟通路和缺氧诱导通路之间存在双向串扰[16],但具体的作用机制尚不清楚,是目前研究的活跃领域。

图4 qPCR 检测Tom22、Tim23、Mfn1、Drp1、Ucp1、Pink1 的mRNA 表达量Fig.4 qPCR detects the mRNA expression of Tom22,Tim23,Mfn1,Drp1,Ucp1,Pink1
已知CK1 对PER 蛋白的磷酸化作用与亚细胞定位和蛋白降解有关,但是缺氧条件下两者相互作用的确切机制尚未明确。本实验抑制或过表达CK1δ后,细胞总PER1 蛋白的表达量不变,但缺氧后两者蛋白表达量略有下降,进一步验证缺氧破坏了生物钟基因的正常表达水平。虽然CK1δ的改变不会影响PER1 总表达量,但却能影响PER1蛋白的核输入。抑制CK1δ会促进PER1蛋白入核,尤其是缺氧条件下,当CK1δ被抑制时细胞核中PER1 蛋白的积累量明显增加。据报道,当CK1 与PER1 两种蛋白在细胞中共表达时会导致PER1 磷酸化,核定位信号被掩盖,进而在胞质中积累[17]。因此,抑制或干扰CK1δ的表达可能导致被磷酸化的PER1 蛋白减少,留下未被磷酸化的PER1 蛋白进入细胞核,而过表达的CK1δ可能通过干扰核输入途径来改变PER1 的输入动力学,造成PER1 蛋白在细胞质中积累。此外,本实验还观察到缺氧环境下PER1 蛋白的核积累量相比于常氧环境明显增加,猜想这可能是由于缺氧诱导因子HIF⁃1α下调了CK1δ的表达,减少了PER1 的磷酸化,或是HIF⁃1α蛋白的激活可能对PER1 蛋白的核定位信号有增强作用,导致其入核量增加。
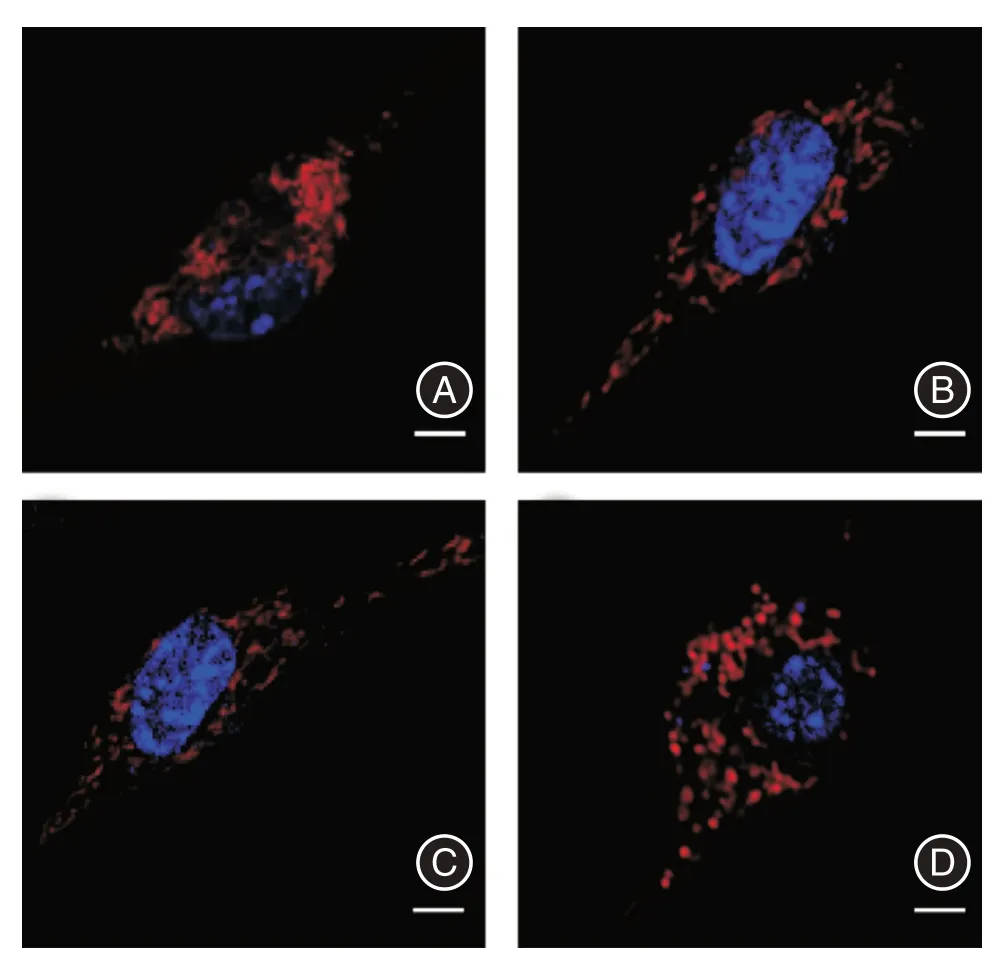
图5 共聚焦显微镜观察线粒体形态Fig.5 The morphology of mitochondria was observed by confocal microscope
近几年研究发现,在氧化应激条件下,Per1 基因的表达与线粒体功能之间存在密切联系[18]。线粒体是一个高度动态的细胞器,会不断发生融合和裂变[19-20],与BV2 细胞的活化存在密切联系[21]。昼夜节律调节器可以通过调节相关基因的表达水平控制线粒体的代谢过程[22]。本实验结果显示,CK1δ表达量的改变会影响Mfn1 和Drp1 基因的表达,引起线粒体形态的变化。线粒体形态先前已被证明几乎可以调节线粒体功能的各个方面:线粒体融合形成广泛的管状网络会导致氧化呼吸和其他功能的整体上调,而线粒体分裂成小片段则相反[23]。此外,SUN 等[12]研究发现Per1 基因缺失会导致线粒体形态发生显著的异常变化。本研究结果显示,CK1δ抑制或敲低组Mfn1 表达增加,线粒体的线状占比偏多,而过表达组Drp1 表达上升,线粒体的碎片化点状占比较大。这可能是由于抑制或干扰CK1δ促进PER1 蛋白入核,增加了Mfn1 基因的转录和翻译且抑制了Drp1 的表达,从而引起线粒体的融合或裂变,导致其形态改变。然而,这只是分析本研究结果得出的推断,具体机制将在后续实验中进一步阐明。
本研究发现昼夜节律基因控制线粒体形态与氧化代谢之间存在分子联系。昼夜节律基因的调节[24]和线粒体充足的能量供应[25]对于神经元兴奋性和存活至关重要,与神经退行性疾病和脑缺血等脑血管疾病的发病机制密切相关。目前对于这些脑血管疾病的治疗选择有限,基于对缺血性损伤潜在的致病分子机制的了解,开发出有效的干预方法来减轻脑损伤至关重要,而缺氧条件下CK1δ和Per1 对线粒体的调节作用可能为缺血性脑卒中新的治疗途径开启一个新的方向。
