miR⁃511⁃3p调节小儿咳嗽变异性哮喘患者巨噬细胞极化和过敏性炎症的机制
2021-06-02牟义飞汤正珍唐永恒李启飞
牟义飞 汤正珍 唐永恒 李启飞
遵义市第一人民医院(遵义医科大学第三附属医院)儿科(贵州遵义563000)
咳嗽变异性哮喘(cough variant asthma,CVA)是儿科中较为常见的一种区别于其他哮喘的特殊类哮喘疾病[1-2]。巨噬细胞存在功能多样性和表型可变性等特性,成熟巨噬细胞可出现巨噬细胞极化现象[3-5],M1 极化主要是由IFNγ/GM⁃CSF/LPS 及其产物引发的巨噬细胞内炎症因子如IL⁃1、TNF⁃α等高表达,具有分泌炎症因子的作用[6]。目前CVA发病的具体机制尚不清楚,多数研究者认为CVA和典型哮喘机制相同,均是以慢性气道高反应和炎症为主要本质[7-8]。miR⁃511⁃3p 在转录上的共同调控与Mrc1 在调控巨噬细胞活化相关,并能增强肠道炎症的功效[9-10]。
1 资料与方法
1.1 研究对象本研究选取2010年2月至2020年5月在本院就诊后被确诊为CVA且在儿科住院的患儿60例,咳嗽时间在1 ~7个月。入组标准:患儿无哮喘病史和家族史;咳嗽原因已排除胰腺囊性纤维化、鼻后滴流综合组等系统性疾病;采血前半个月患儿无呼吸道感染;肺功能正常;X线胸片正常。患儿性别比例:男/女=45/55;年龄为(5.35 ± 2.10)个月;病程为(14.65±5.16)d。本研究已经获得伦理委员会批准,受试患儿的监护人已签署同意书。
1.2 材料
1.2.1 实验细胞人单核细胞系THP⁃1,购自中科院上海细胞所,采用RPMI 1640 培养基于37 ℃、5%CO2中培养。
1.2.2 实验动物57BL/6小鼠SPF级雄性,6 ~8周龄,购自由河北大学医学院实验动物中心提供。动物许可证号:SYXK(冀)2017⁃002。小鼠饲养环境:21~25 ℃,所有小鼠均可自由饮食,并给予12 h交替光照。
1.3 方法
1.3.1 巨噬细胞极化的诱导将培养成功的THP⁃1细胞用含PMA(200 ng/mL)的1640 培养基(碧云天公司)诱导形成巨噬细胞,加入含LPS(500 ng/mL,碧云天公司)和IL⁃4(20 ng/mL,碧云天公司)的1640 培养基再次刺激24 h,形成了M1 和M2 型巨噬细胞。
1.3.2 细胞转染收集M1 巨噬细胞,按照3 × 105个/mL 接种于6 孔板中,放置24 h 后,按照TM2000转染试剂盒(碧云天公司)说明书转染miR⁃511⁃3p,设置阴性对照试验,4 h 后,用含有10%FBS 的DMEM 培养基培养48 h。
1.3.3 RT⁃PCR 法检测相关基因表达采集小鼠股静脉外周血,加入抗凝剂后500 g 离心5 min,取沉淀,采用TRIol 法抽提细胞内mRNA,按照RT⁃PCR 检测试剂盒(碧云天公司)说明书经过逆转录,获得样本CDNA,进行M1 巨噬细胞相关标志物的RT⁃PCR 基因检测,用ΔΔct 法对其进行定量分析,以GAPDH 作为内参。
1.3.4 Western blot法检测蛋白表达采集小鼠股静脉外周血,加入抗凝剂后500 g 离心5 min,取沉淀,取不同转染后的巨噬细胞,将其培养48 h 后,采用蛋白组织裂解液获得蛋白样本,Western blot法检测M1 巨噬细胞标志物蛋白表达。
1.3.5 咳嗽变异性哮喘小鼠模型构建除正常组外,分别采用氢氧化铝和卵蛋白致敏并用的卵蛋白激活法构建CVA 小鼠模型。建模后3 d 观察小鼠毛色、精神、饮食、体温均正常,分别在1 周和第2 周给予氢氧化铝凝胶20 Ug 和卵白蛋白100 Ug腹腔注射,从第3 周开始给予各组小鼠5%OVA 溶液12 mL 空气压缩雾化后吸入对其进行抗原攻击,连续13 d,每天1 次,30 min/次。从第29 天,给予其余组分别雾化后吸入给药治疗1 周。模型鉴定标准:通过监视器观察各组大鼠状态,小鼠在经过激发后出现呼吸困难、咳嗽、喷嚏、烦躁等现象时判定模型成功[11]。
1.3.6 ELSA 法检测小鼠灌洗液中相关因子的表达收集各组小鼠灌洗液,按照ELISA 试剂盒(碧云天公司)在450 nm 处检测各组吸光度值,计算灌洗液中巨噬细胞极化相关标志因子TNF⁃α、IL⁃1β、CCL22 和CCL17 表达。
1.3.7 ELISA 法检测M1 和M2 细胞内TNF⁃α和TGF⁃β的分泌量收集各组细胞培养液,按照ELISA 试剂盒(碧云天公司),在450 nm 处检测各组吸光度值,计算M1 和M2 细胞培养液内TNF⁃α和TGF⁃β表达分泌量。
1.3.8 CVA 组患者体内的miR⁃511⁃3p 表达通过5 000 g 离心5 min,获得受试者血浆样本,采用RT⁃PCR 法和Western blot 法,检测血浆样本中miR⁃511⁃3p 的表达。
1.4 统计学方法采用SPSS 20.0 统计分析软件;计量资料用()表示,组间比较采用单因素方差分析;计数资料用例(%)表示,组间比较用χ2分析;P<0.05 表示差异有统计学意义。
2 结果
2.1 M1和M2巨噬细胞鉴定与对照组Mφ相比,M1巨噬细胞中TNF⁃α和IL⁃1β的表达较高;在M2 巨噬细胞中,CCL17 和CCL22 表达较高,M1 中TNF⁃α表达高于Mφ和M2,M2 中TGF⁃β表达高于Mφ和M1,差异具有统计学意义(P<0.05)。见表1。
表1 不同方式处理后巨噬细胞内TNF⁃α、IL⁃1β、CCL22 和CCL17 的表达Tab.1 Expression of TNF⁃α,IL⁃1 β,CCL22 and CCL17 in macrophages after different treatments±s
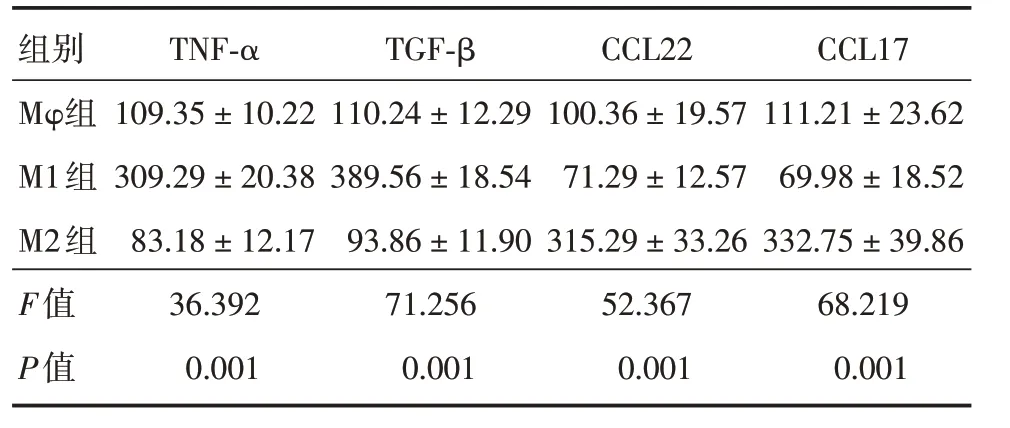
表1 不同方式处理后巨噬细胞内TNF⁃α、IL⁃1β、CCL22 和CCL17 的表达Tab.1 Expression of TNF⁃α,IL⁃1 β,CCL22 and CCL17 in macrophages after different treatments±s
组别TNF⁃αTGF⁃βCCL22CCL17 Mφ组109.35±10.22110.24±12.29100.36±19.57111.21±23.62 M1组309.29±20.38389.56±18.5471.29±12.5769.98±18.52 M2组83.18±12.1793.86±11.90315.29±33.26332.75±39.86 F值36.39271.25652.36768.219 P值0.0010.0010.0010.001
2.2 miR⁃511⁃3p 转染后M1 巨噬细胞相关标志物基因mRNA 的表达向M1 型细胞中转染了miR⁃511⁃3p,通过RT⁃PCR 法发现TNF⁃α 表达减少,CCL17 表达增多(P<0.05)。见表2。
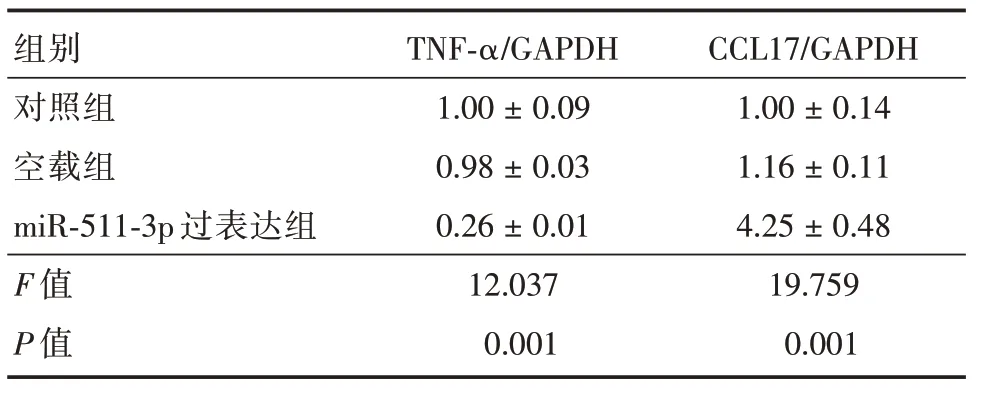
表2 M1 巨噬细胞相关标志物基因的表达Tab.2 Expression of M1 macrophage related marker gene x±s
2.3 miR⁃511⁃3p 转染后M1 巨噬细胞相关标志物基因蛋白的表达TNF⁃α蛋白表达减少,CCL17 蛋白表达增多(P<0.05)。见图1。
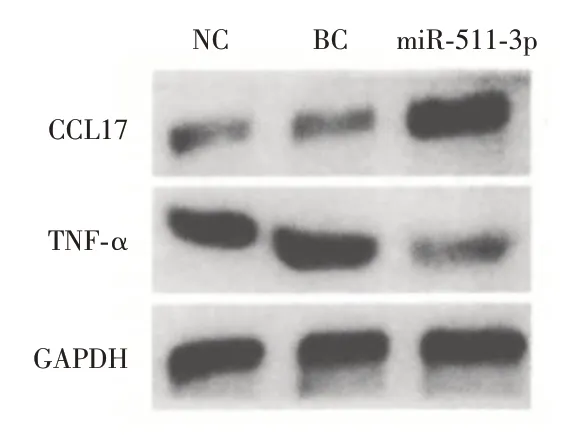
图1 M1 巨噬细胞相关标志物基因蛋白的表达(Western Blot)Fig.1 Expression of M1 macrophage related marker gene protein(Western blot)
2.4 ELSA 法检测小鼠灌洗液中相关基因的表达M1 和M2 细胞分泌的TNF⁃α和TGF⁃β,CVA 组TNF⁃α减少,TGF⁃β增多(P<0.05)。见表3。

表3 M1 巨噬细胞相关标志物基因的表达Tab.3 The expression of M1 macrophage related marker gene x±s
2.5 CVA 组患者体内miR⁃511⁃3p 的mRNA 转录水平CVA 组与对照组相比,血浆内miR⁃511⁃3p的mRNA 转录水平下调,差异有统计学意义(P<0.05)。见表4。

表4 CVA 组患者体内miR⁃511⁃3p 表达Tab.4 The expression of mir⁃511⁃3p in CVA group x±s
3 讨论
本研究发现miR⁃511⁃3p 可通过降低CVA 患者IRF3 磷酸化水平,抑制巨噬细胞M1 相关标志物的分泌[12-14]。巨噬细胞随着微环境的变化可进行重新分化,其极化具有可塑性,能对复杂环境变化做出较有效、快速的应答[15]。采用LPS 体外刺激作用下的巨噬细胞在经过IL⁃4 继续刺激后,能够得到M2 型巨噬细胞,相对的刺激顺序调换后得到了M1 型巨噬细胞[16]。其中M1 型巨噬细胞主要包含M1 和M2 特点,M2 型巨噬细胞主要为M2 特点[17]。在M1 极化的信号通路研究中,发现IFN⁃γ能够直接促进机体内NOS2、MHCⅡ和ILL⁃2 表达上调[18]。巨噬细胞极化不仅参与炎症消退、发展和细胞凋亡过程,NF⁃κB 通路的激活剂IKKβ还能直接抑制机体内STST1 活性,促使细胞向M2 极化。M2 激活途径主要受到STAT6 介导。结直肠炎小鼠机体内IRAK1、ERK、JNK 基因磷酸化通路被阻断后可促使机体M1 型巨噬细胞转化为M2 型极化,其炎症效果减轻的同时,小鼠结直肠炎也得到了改善[19]。
在人巨噬细胞中含有多种miRNA 在M1 型和M2 型巨噬细胞存在着明显的表达差异,如miR⁃155、miR⁃132、miR⁃27a 等[20-21]。miR29b 和miR125a⁃5p 均靶向抑制TNFAIP3,TNFAIP3 属于NF⁃κB 信号通路抑制剂,miR29b 和miR125a⁃5p 又可通过抑制TNFAIP3 表达促进M1 型巨噬细胞标志物的表达升高,证实miRNA 可通过改变巨噬细胞极化通路中相关蛋白的表达,参与机体巨噬细胞极化的调控作用[22]。miR511 可通过不同的靶点作用促进M1/M2 型巨噬细胞极化。miR⁃511⁃3p 在体内具有抗炎效果,能用于治疗哮喘,且在CVA 患者中MR 可与miR⁃511⁃3p 协同表达,抑制细胞M1 极化,进而调节机体炎症。
综上所述,miR⁃511⁃3p 可通过体外抑制IRF3磷酸化水平,抑制巨噬细胞M1 极化,促使其向M2方向极化,同时抑制机体内过敏性炎症反应。
