注射用两性霉素B脂质体临床药理学研究
2021-05-31王曼曼张雪媛祁欢欢尹佩华肇丽梅李春雷
王曼曼, 张雪媛,, 祁欢欢, 尹佩华, 肇丽梅, 李春雷
作者单位:1. 石药集团中奇制药技术(石家庄)有限公司,石家庄 050035;2. 中国医科大学附属盛京医院药学部。
1953年发现的两性霉素B为多烯类抗真菌抗生素,是临床上治疗侵袭性真菌感染的“金标准”药物[1-2]。两性霉素B具有广泛的抗真菌谱,对念珠菌属、曲霉属都具有杀菌作用,抗真菌活性强,而且几乎没有耐药性[3]。两性霉素B去氧胆酸盐(amphotericin B deoxycholate, AmB-DOC)是首个用于临床的两性霉素B普通制剂,临床应用已超过50年,也是应用最久的抗真菌药,但是其会产生不可逆的肾损伤、输液反应等严重的不良反应[2]。为了改善AmB-DOC的安全性,多个两性霉素B脂类制剂相继上市,其中注射用两性霉素B脂质体(liposomal amphotericin B, L-AmB, AmBisome®)的安全性较好[4-6]。目前,在我国上市的两性霉素B制 剂 有2种:AmB-DOC、L-AmB(商 品名:锋克松)。国外目前上市的剂型有AmB-DOC、L-AmB(AmBisome®)和两性霉素B脂质复合物(amphotericin B lipid complex, ABLC, Abelcet®)3种。
不同于在我国上市的L-AmB(商品名:锋克松),L-AmB(AmBisome®)至今已在欧美等地区超40个国家上市,已有30年的临床使用经验,但是尚未在我国上市。L-AmB临床推荐剂量为3 mg • kg-1• d-1,最 高 给 药 日 剂 量 可 达6 mg/kg。L-AmB有多个适应证,包括发热性中性粒细胞减少症;HIV阳性隐球菌脑膜炎;内脏利什曼原虫病。此外还用于治疗曲霉、念珠菌、隐球菌感染,且对AmB-DOC不敏感患者以及因肾损伤或药物毒性而不能使用AmB-DOC的患者[7]。
L-AmB为单层脂质体,粒径<100 nm[8-9],进入血液循环后,绝大部分以脂质体形式存在。两性霉素B的作用机制复杂,主要有4种:离子通道理论、简单结合机制、氧化损伤机制、免疫调节反应。L-AmB改变了AmB-DOC的药动学特征。相比于AmB-DOC,L-AmB体内暴露量即Cmax和AUC更高。L-AmB更倾向分布于脾脏和肝脏,而AmB-DOC则主要分布于肾脏中。L-AmB这种分布特征的改变,降低了肾毒性,使其安全性更好。在临床应用中,L-AmB表现出良好的有效性和安全性,相比于其他两性霉素B制剂,在保持相似的临床疗效下,L-AmB肾毒性、输液反应等不良反应的发生率明显降低[8-9]。本文拟从作用机制、药动学特征、临床有效性及安全性方面对L-AmB(AmBisome®)作一综述。
1 作用机制
L-AmB静脉给药进入血液循环后,可迅速到达感染部位或其附近,并在真菌细胞表面聚集。这种准确的识别能力主要依赖于脂质体,而与两性霉素B无关。脂质体表面荷电性以及真菌细胞壁的组成成分β-葡聚糖可能是脂质体能够准确识别并迅速聚集在感染部位的重要因素[10]。L-AmB在感染部位聚集后,与真菌细胞壁结合,释放出游离型两性霉素B,游离型两性霉素B与真菌细胞膜上麦角固醇之间很强的吸引力促使其进入到细胞内发挥作用,在这个过程中温度和脂质体膜的流动性起着非常重要的作用[10-11]。有研究发现脂质体本身可以直接穿过细胞壁进入细胞内,在细胞内释放出游离型两性霉素B而发挥作用[10,12]。
游离型两性霉素B在细胞内的作用机制十分复杂,至今仍未完全阐明。最先发现也是人们普遍认为的机制是两性霉素B可以与真菌细胞膜上的麦角固醇结合形成孔状的超分子结构,产生跨膜的离子通道,造成细胞膜通透性的改变导致细胞死亡[10,13-16]。有研究发现这些孔状结构的形成仅仅与两性霉素B相关,而与麦角固醇是否存在无关[14]。第2个作用机制是简单结合机制。两性霉素B与麦角固醇简单地相互结合就足以发挥杀菌作用,离子通道的形成并不是杀菌所必需的[10,12,17]。两性霉素B在细胞膜外形成巨大的螯合物,可以将细胞膜上的麦角固醇“萃取”出来,导致磷脂双分子膜的破坏[18],或是两性霉素B“吸引”麦角固醇到细胞膜表面,二者相互结合造成膜的不稳定[17-18]。第3种可能是细胞氧化损伤机制。两性霉素B激活线粒体呼吸链酶复合物Ⅰ(mitochondrial respiratory complex Ⅰ),刺 激 细胞外活性氧(ROS)升高,随之引起一系列氧化应激反应,导致一些大分子(蛋白质、磷脂以及DNA)的改变,造成细胞损伤或凋亡[19-22]。此外,两性霉素B对宿主有免疫调节能力,能增强宿主的免疫反应[16]。两性霉素B主要通过Toll样受体(TLR)信号通路发挥免疫调节作用[23]。不同的两性霉素B制剂会与不同类型的TLR结合,引起不同的免疫反应。L-AmB主要与细胞膜上TLR4结合释放抗炎因子,而AmB-DOC则更倾向与TLR2结合释放促炎症因子[16]。同时两性霉素B还可以与CD14受体结合从而激活TLR信号通路来发挥免疫调节作用[24]。研究发现脂质体(无药物)本身也有免疫调节效应[12]。
2 药动学
2.1 血液循环中两性霉素B的存在形式
L-AmB静脉给药进入血液循环后,两性霉素B以3种形态存在:保持脂质体的形态(脂质体型,Lipo-AmB)、与血浆蛋白结合的形态(蛋白结合型,Bound-AmB)以及游离形态(游离型,Free-AmB),它们的总和称为总两性霉素B。
2.2 临床前药动学
L-AmB在不同的物种(小鼠、大鼠、家兔、犬)体内药动学特征有一定的相似性。在这些动物模型中,总两性霉素B均呈非线性药动学特征。随着给药剂量的增大,总两性霉素B的Cmax、AUC0-∞以非比例方式增加,而表观分布容积和血浆清除率则呈下降趋势,这主要与网状内皮系统(RES)的饱和性有关[25-27]。L-AmB在血液循环中,绝大多数以Lipo-AmB存在,这种Lipo-AmB更倾向于向RES转移[26,28]。当L-AmB给药剂量小时,Lipo-AmB很容易被巨噬细胞吞噬,但是随着给药剂量增高,巨噬细胞达到饱和,血浆清除率降低,更多的Lipo-AmB“滞留”在血液中,导致Cmax、AUC0-∞以非比例方式增加。L-AmB在这些动物模型中的组织分布非常相似,主要分布在脾脏和肝脏,其次分布在肾脏和肺,脑中分布最少[11-12,26]。相比于AmB-DOC,L-AmB能更好地渗透进入脑组织中[12]。总两性霉素B在这些组织中的浓度均高于最低抑菌浓度(MIC),且呈剂量依赖性。总两性霉素B组织清除率远低于血浆中的清除率,在脑组织中约1 d清除,在肺脏需要数天,而在肾脏、脾脏以及肝脏则需要数周[26]。
2.3 临床药动学特征
2.3.1 健康人体内的药动学特征 健康人接受L-AmB(2 mg/kg,静脉滴注2 h,n=5)后,血浆中总两性霉素B的Cmax、AUC远高于接受AmBDOC(0.6 mg/kg,静脉滴注2 h,n=5)后的Cmax、AUC,但是Free-AmB的Cmax、AUC却显著低于AmB-DOC的Cmax、AUC[29-30],见 表1。与 在动物模型中一样,L-AmB进入体循环后主要以Lipo-AmB存在,滴注开始后4 h,Lipo-AmB约占97%,滴注开始后168 h仍占55%[29]。两性霉素B血浆蛋白结合率高且呈浓度依赖型(>95%),主要与血清白蛋白和α1-酸性糖蛋白结合。Free-AmB、Lipo-AmB的终末半衰期分别长达(467±372)h、(147±38)h[29]。
作为L-AmB的两个组成部分,总两性霉素B和脂质体(14C-胆固醇脂质体标记物:14C标记脂质体的组成成分胆固醇)二者的分布特征明显不同。总两性霉素B以三相消除方式消除,而14C-胆固醇以二相方式消除。总两性霉素B与14C-胆固醇血浆浓度在静脉滴注开始后36 h内下降为原来的约1/10,在终末消除相基本保持恒定。总两性霉素B和14C-胆固醇初始分布容积均接近于血浆容积,达到平衡后二者的分布容积分别约为其各自初始分布容积的15倍和2倍。14C-胆固醇清除率显著低于总两性霉素B[31]。
两性霉素B在人体内并未被广泛代谢,而是以原型形式从尿液和粪便中排出[30]。给予L-AmB后,1周时间内总两性霉素B在尿液和粪便中的累积回收率分别为4.5%和4%,给药后1周体内总两性霉素B含量约占给药剂量的15.5%,尿液、粪便中排泄总量加上体内残留量约占给药剂量的25%,仍有约75%两性霉素B存在于体内,对于14C-胆固醇而言,1周时间内其在尿液和粪便中的累积回收率约为给药剂量的10.4%,给药后1周体内14C-胆固醇含量约占给药剂量的39.5%,仍有大概一半的14C-胆固醇存在于体内[30-31]。
2.3.2 患者体内的药动学特征 与在健康人体内相同,L-AmB在患者体内主要以Lipo-AmB形式存在[32],相比于AmB-DOC同样会产生较高的Cmax、AUC,同样主要分布在脾脏和肝脏[33-34]。无论是成人还是儿童患者,总两性霉素B均呈非线性药动学特征。多次给药研究中,当给药日剂量<7.5 mg/kg时,总两性霉素B的Cmax、AUC0-24和AUC0-∞随剂量增加而不成比例的增加,但是当给药日剂量≥7.5 mg/kg时,两性霉素B的分布过程可能发生了变化,导致总两性霉素B的Cmax、AUC0-24和AUC0-∞随着剂量增加而下降[35-36]。在患者体内L-AmB的最大耐受日剂量至少15 mg/kg[37]。

表1 单次给予健康人2 mg/kg注射用两性霉素B脂质体(AmBisome®)或0.6 mg/kg两性霉素B去氧胆酸盐后,总两性霉素B、游离型两性霉素B的主要药动学参数
3 临床有效性和安全性
3.1 中性粒细胞缺乏伴发热疑似真菌感染的经验性治疗
早期的一项随机、开放、平行试验对比了L-AmB和AmB-DOC在中性粒细胞缺乏伴发热疑似真菌感染的经验治疗中的有效性和安全性。试验入组338例发热性中性粒细胞减少症患者(204例儿童患者和134例成人患者),分为3个治疗组:L-AmB1(1 mg • kg-1• d-1)、L-AmB2(3 mg •kg-1• d-1)、AmB-DOC(1 mg • kg-1• d-1)。这3个组的治疗成功率分别为58%、64%、49%(L-AmB2比AmB-DOC,P=0.03)。L-AmB组相比于AmBDOC组,不良反应发生率降低为原来的1/2~1/6(P≤0.01),严重不良反应发生率仅为AmB-DOC组的1/12(P<0.01),肾毒性的发生率显著低于AmB-DOC组(P<0.01),且试验过程中L-AmB组发展为肾毒性的时间显著长于AmB-DOC组(P<0.01)[38],见表2。研究发现输液反应中发冷、寒战更易出现在L-AmB组,而呕吐、恶心、发热以及头疼则在AmB-DOC组出现的频次更高[39]。另一项试验同样对比了L-AmB(3 mg • kg-1• d-1,n=343)与AmB-DOC(0.6 mg • kg-1• d-1,n=344)在治疗中性粒细胞缺乏伴发热疑似真菌感染中的有效性和安全性。结果显示虽然两个治疗组总的治疗成功率相似,但是L-AmB组发冷/寒战的发生率显著低于AmB-DOC组(18.4%比54.4%,P<0.001),肾毒性发生率同样显著低于AmBDOC组(18.7%比33.7%,P<0.001)[40],见表2。
此外,一项随机、双盲、平行试验对L-AmB(L-AmB1:3 mg • kg-1• d-1,n=85;L-AmB2:5 mg • kg-1• d-1,n=81)和ABLC(5 mg • kg-1• d-1,n=78)的有效性和安全性进行了对比研究。在这项研究中,L-AmB和ABLC的治疗有效率未见显著性差异,但是ABLC组发冷/寒战、肾毒性的发生率分别高达79.5%、42.3%,均显著高于L-AmB组(发冷/寒战: L-AmB1比ABLC为18.8%比79.5%,P<0.001, L-AmB2比ABLC为23.5%比79.5%,P<0.001; 肾毒性: L-AmB1比ABLC为14.1%比42.3%,P<0.001, L-AmB2比ABLC为14.8%比42.3%,P<0.001)[41],见表2。
3.2 侵袭性真菌感染
多个临床前研究提示L-AmB对侵袭性曲霉感染有治疗作用,高剂量的L-AmB可以改善治疗效果[11]。一项随机、双盲临床试验比较了L-AmB高剂量(10 mg • kg-1• d-1,n=94)与标准剂量(3 mg •kg-1• d-1,n=107)在治疗侵袭性霉菌感染(主要是肺部曲霉病)上的有效性和安全性。结果提示2个治疗组在有效性上没有明显区别(10 mg • kg-1• d-1比3 mg • kg-1• d-1:46%比50%,P=0.65),但是高剂量组肾毒性和低钾血症的发生率却显著升高(肾毒性: 31%比14%,P<0.01;低钾血症:30%比16%,P=0.015)[34,42],见表2。目前美国临床说明书推荐剂量(3~5 mg • kg-1• d-1)用于治疗侵袭性曲霉感染[7]。对于毛霉感染,国际专家推荐5~10 mg • kg-1• d-1的剂量[43]。
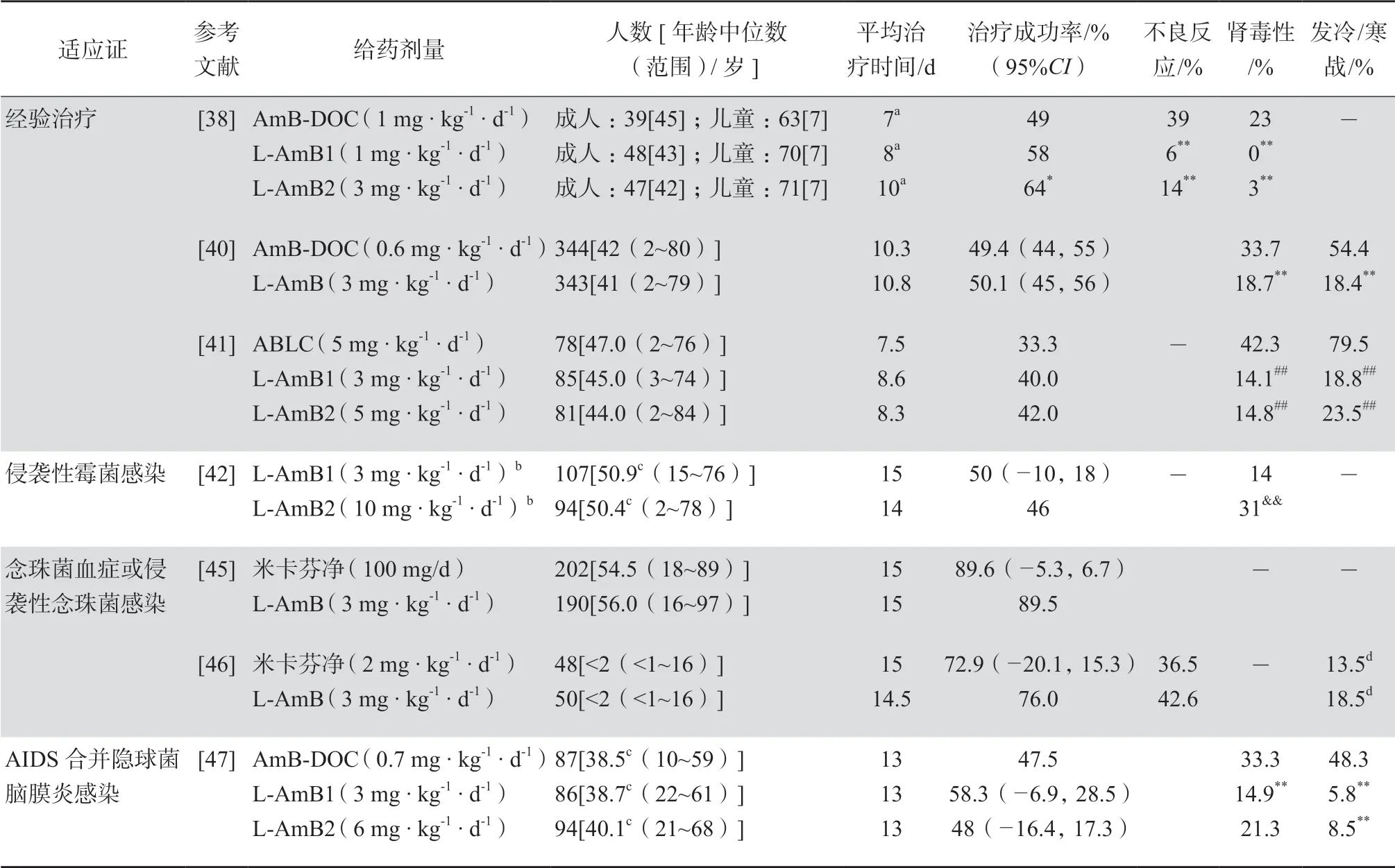
表2 注射用两性霉素B脂质体(AmBisome®)与两性霉素B去氧胆酸盐的临床有效性和安全性对比
尽管念珠菌菌种及其敏感性已被研究透彻,但是临床上对侵袭性念珠菌感染一直没有统一的治疗方案。常用的几种抗真菌药物都没能表现出特别明显的优势[44]。在治疗念珠菌血症或侵袭性念珠菌感染时,L-AmB和米卡芬净的临床有效性差异无统计学意义。成人患者中,L-AmB和米卡芬净的治疗成功率分别为89.5%和89.6% (95%CI: -5.3~6.7)[34,45]。儿童患者中,二者的治疗成功率分别为76.0%和72.9% (95%CI: -20.1~15.3)[34,46],见表2。
隐球菌脑膜炎多发于HIV感染/AIDS患者中。一项临床研究比较了L-AmB1(3 mg • kg-1•d-1,n=86)、L-AmB2 (6 mg • kg-1• d-1,n=94)以及AmB-DOC(0.7 mg • kg-1• d-1,n=87)用 于 治疗AIDS合并隐球菌脑膜炎的有效性与安全性。L-AmB组的有效性不劣于AmB-DOC组,且相比于AmB-DOC组,L-AmB组安全性更高[47],见表2。早期临床应用中,AmB-DOC和5-氟胞嘧啶合用被认为是隐球菌脑膜炎的标准疗法,但是由于AmB-DOC严重的肾毒性,L-AmB逐渐替代AmB-DOC用于隐球菌脑膜炎的治疗[11]。一项临床前的研究结果桥接到人体上,提示L-AmB(6 mg • kg-1• d-1)单独使用或L-AmB(3 mg • kg-1• d-1)与5-氟胞嘧啶合并使用可以达到接近最大的抗菌率[48]。
3.3 利什曼原虫病
目前利什曼原虫病仍然是一个全球的公共卫生健康问题,每年接近50万人感染,其中超过5 000人死亡。利什曼原虫病有多种表现形式,其中内脏利什曼原虫病(visceral leishmaniasis, VL)是最严重的表现。在欧洲和美国,L-AmB是用于治疗VL的一线药物,持续治疗3~5 d疗效高达100%。与AmB-DOC相比,L-AmB疗效高,安全性更好。当HIV-VL合并感染时,VL复发率高治疗难度大,L-AmB仍然是治疗的首选药物[49]。
4 结语与展望
L-AmB(AmBisome®)在临床上的治疗优势明显:①L-AmB分布特征的改变,降低了肾毒性,提高了安全性,对于AmB-DOC治疗失败或不能耐受的患者有明显的疗效;②提高了临床应用剂量,两性霉素B为浓度依赖型抗真菌药,剂量提高有利于抗真菌疗效的发挥,临床一般推荐剂量为3 mg • kg-1• d-1,最高给药可达6 mg • kg-1• d-1,而AmB-DOC每日最高给药剂量不超过1 mg/kg;③L-AmB将输液时间从6 h缩短至2 h,有利于提高患者依从性;④由于脂质体的特性,L-AmB为半衰期长药物,在组织中的浓度可以长时间高于抑菌浓度,增加了新的给药方案;⑤鉴于其良好的安全性,L-AmB的应用提高了合并用药的可能性与安全性。
随着近年来深部真菌感染发病率的不断升高,国内上市的两种两性霉素B制剂远远不能满足临床的需求。无论是广大患者还是医护人员都迫切希望两性霉素B脂类制剂,特别是L-AmB(AmBisome®)或其仿制药能在国内上市。相信随着脂质体研发技术的不断成熟,越来越多的脂质体剂型的药物能很快在国内上市,解决临床上无药可用的困境,给患者带来福音。
