获得性免疫缺陷综合征合并多重感染继发噬血细胞综合征1例
2021-05-31葛书亚孟美丽
葛书亚, 孟美丽, 傅 磊
作者单位: 蚌埠医学院第二附属医院血液内科,安徽蚌埠 233020。
人类免疫缺陷病毒(HIV)感染主要侵犯人体的免疫系统,表现为CD4+T淋巴细胞数量不断减少,最终导致人体细胞免疫功能缺陷,引起各种机会性感染、肿瘤和其他少见疾病的发生[1]。本院收治1例获得性免疫缺陷综合征(AIDS)患者,合并马尔尼菲篮状菌(Talaromyces marneffei)、EB病毒(EBV)、巨细胞病毒(CMV)及葡萄球菌多重感染,且继发噬血细胞综合征(hemophagocytic syndrome,HPS),此类病例罕见,现报道如下。
1 临床资料
患者,男,64岁。因“头昏、乏力5个月余,加重伴发热10 d”于2018年9月15日入院。患者于2018年4月起无明显诱因开始出现头昏、乏力不适,未予重视。入院前10 d患者出现发热,最高体温39.0℃,伴畏寒、寒战,有咳嗽、咯痰,有腹痛、腹泻,体重下降约20 kg。就诊我科。既往体健,患者否认肝炎、结核病史,否认手术及外伤史,无输血史。无不良嗜好,无化学毒物及放射线治疗史,无特殊药物服用史,否认冶游史。查体:神清,消瘦体型,贫血面容,全身多处皮肤可见散在出血点,背部皮肤可见散在脐窝状凹陷,颈部、锁骨上、腋窝、腹股沟区可触及肿大淋巴结,质韧,无压痛,移动度可,口唇苍白,两肺呼吸音粗,未闻及干湿啰音,心脏听诊无特殊,腹肌紧张,有轻压痛,无反跳痛,肝脾触诊不满意,双下肢轻度水肿,病理反射未引出。血常规示WBC 2.58×109/L↓,中性粒细胞计数 2.44×109/L,HGB 80 g/L↓,PLT 11×109/L↓↓。血液生化:ALT 160 U/L↑,白蛋白 25.23g/L↓,三酰甘油1.86 mmol/L↑,钠126 mmol/L↓,C反应蛋白 61.88 mg/L↑。叶酸 6.12 μg /L↑,促红细胞生成素、维生素B12正常,血清铁蛋白>1 650.0 μg/L↑。凝血功能:凝血酶原时间 28.0 s↑,活化部分凝血活酶时间 47.5 s↑,纤维蛋白原 0.76 g/L↓,血浆D-二聚体 7 780 μg/L↑。降钙素原 8.07 μg /L↑。G试验632.0 ng/L↑。免疫过筛:HIV抗体筛查试验阳性;后市疾控中心HIV抗体确证试验阳性。后其配偶HIV检测阳性。血培养见表皮葡萄球菌生长;骨髓培养见马尔尼菲篮状菌生长。CT示两肺感染性病变,两侧胸腔及心包积液,脾肿大,腹腔积液。腹部彩超报告肝肿大、脾肿大、腹水,腹腔及腹膜后淋巴结肿大。浅表淋巴结彩超见右侧锁骨上窝、左侧腋窝及双侧腹股沟淋巴结增大。骨髓涂片:增生活跃偏低,中晚幼粒细胞增多,胞质中可见较多中毒颗粒,中性分叶核细胞胞质中可见较多中毒颗粒、空泡和杜氏小体,巨核细胞5~7个,红系比例降低,血小板减少,有噬血现象(图1);吞噬细胞内外(大多数于吞噬细胞内)见大量圆形、类圆形或带横隔的腊肠样病原体,呈蓝紫色,考虑为马尔尼菲篮状菌(图2)。骨髓活检报告造血组织增生明显活跃,粒系增生,比例增高,红系比例降低,巨核细胞未见明显减少,组织细胞散在或灶性分布,可见噬血现象。免疫分型、阵发性睡眠性血红蛋白尿症克隆细胞、自身免疫性血细胞减少相关抗原检测未见异常。免疫功能检 测:CD3+CD4+2.95%(参 考 值29%~57%),CD3+CD8+58.83%(参 考 值11%~38%),CD4+/CD8+0.05%(参 考 值0.9%~3.6%)。EBV-DNA 1.27×105拷 贝/mL(参 考 值<1 000拷 贝/mL),CMV-DNA 7.07×103拷贝/mL↑(参考值<500拷贝/mL),可溶性IL-2受体6 961U/mL↑(参考值<223~710 U/mL)。诊断:①HPS;②播散型马尔尼菲篮状菌病;③HIV感染艾滋病期;④肺部感染;⑤低蛋白血症;⑥低钠血症;⑦肝功能不全;⑧EBV感染;⑨CMV感染。治疗:依托泊苷(50 mg每周2次,共4次)联合地塞米松(10 mg/d,14 d);伏立康唑(第1天0.3 g 1次/12 h,第2~14天0.2 g 1次/12 h);更昔洛韦抗病毒;头孢替安和克林霉素抗菌,效果欠佳,换用头孢曲松联合万古霉素;口服甲氧苄啶-磺胺甲唑片预防肺孢子菌肺炎;还原性谷胱甘肽保肝、丙种球蛋白增强免疫力等对症治疗。2周后,患者无发热,淋巴结及肝脾较前明显缩小,复查血常规:WBC 4.09×109/L,HGB 96 g/L↓,PLT 30×109/L↓,C反应蛋白 21.5 mg/L↑。降钙素原0.27 μg/L。复查骨髓涂片未见噬血现象及马尔尼菲篮状菌,骨髓培养未见病原体生长。患者全血细胞均较前明显恢复,感染指标明显下降,治疗有效,病情得到控制,后出院回当地继续治疗:第3~8周依托泊苷50 mg每周1次;地塞米松第3~4周5 mg 每日1次,第5~6周2.5 mg每 日1次,第7~8周1.25 mg每日1次;伊曲康唑抗真菌及抗HIV等治疗。后期随访患者无发热,血细胞恢复正常,彩超提示肝脾及淋巴结已无肿大。
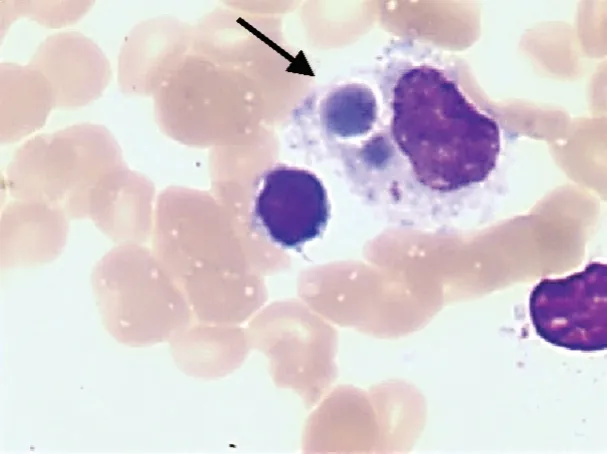
图1 噬血现象(瑞氏染色,×1000)Figure 1 Hemophagocytosis (Wright's staining, ×1000)
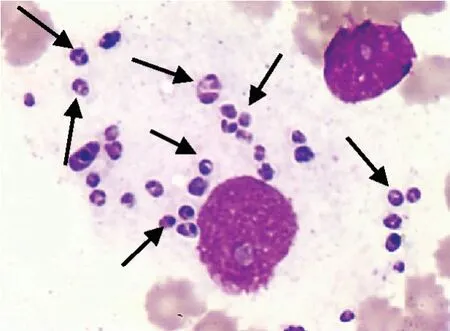
图2 马尔尼菲篮状菌(瑞氏染色,×1000)Figure 2 Talaromyces marneffei (Wright's staining, ×1000)
2 讨论
目前成人HIV感染诊断标准为[1]:①HIV抗体筛查试验阳性和HIV补充试验阳性(抗体补充试验阳性或核酸定性检测阳性或核酸定量>5 000拷贝/mL);②HIV分离试验阳性。本例患者初期HIV抗体筛查试验阳性,后期完善HIV补充试验也提示阳性,HIV感染诊断明确。HIV感染可分为急性期、无症状期及艾滋病期,其中艾滋病期的主要临床表现为HIV相关症状、体征及各种机会性感染和肿瘤。目前成人艾滋病期诊断标准为[1]:HIV感染合并下述各项中的任何一项,即①38℃以上不明原因持续不规则发热>1个月;②腹泻>l个月(大便次数>3次/d);③6个月内体重下降>10%;④反复发作的口腔真菌感染;⑤反复发作的单纯疱疹病毒感染或带状疱疹病毒感染;⑥肺孢子菌肺炎(PCP);⑦反复发生的细菌性肺炎;⑧活动性结核或非结核分枝杆菌病;⑨深部真菌感染;⑩中枢神经系统占位性病变;⑪中青年人出现痴呆;⑫活动性CMV感染;⑬弓形虫脑病;⑭马尔尼菲篮状菌病;⑮反复发生的败血症;⑯皮肤黏膜或内脏的卡波西肉瘤、淋巴瘤。本例患者体重下降超过10%,伴有马尔尼菲篮状菌病,诊断为HIV感染艾滋病期。HIV感染艾滋病期患者常见为单一病原体引起的机会性感染[2-4]。本例患者在马尔尼菲篮状菌病基础上,尚有败血症及EBV、CMV感染,为真菌、细菌、病毒多重感染。除了提示多重感染需警惕AIDS可能,AIDS患者亦可能合并多重感染,临床表现上可无明显差异,需依靠各种病原学检测明确诊断。
马尔尼菲篮状菌病是由马尔尼菲篮状菌感染引起的一种深部真菌疾病,是AIDS患者常见的机会性感染疾病[5],以播散型马尔尼菲篮状菌病多见,病死率极高。本例患者HIV确证试验阳性,CD4+T细胞明显减少,有高热、体重减轻、贫血、脐凹样皮疹、肝脾及淋巴结肿大、消化系统症状、肺部炎症等表现,骨髓涂片中见大量马尔尼菲篮状菌,骨髓培养检出马尔尼菲篮状菌,最终确诊播散型马尔尼菲篮状菌病。马尔尼菲篮状菌病目前治疗上主要根据《艾滋病合并侵袭性真菌病诊治专家共识》[6]:前2周诱导期使用两性霉素B 0.5 ~0.7 mg • kg-1• d-1或两性霉素B脂质体3~5 mg •kg-1• d-1静 脉 滴 注,继 而 口 服 伊 曲 康 唑400 mg/d,10周。本病也可使用伏立康唑治疗:①诱导期每次静脉滴注伏立康唑6 mg/kg,1次/12 h,1 d后改为静脉滴注4 mg/kg,1次/12 h,疗程至少3 d;巩固期口服伊曲康唑200 mg,2次/d,疗程不超过12周。②口服伏立康唑400 mg,1次/12 h,1 d后改为200 mg 口服,1次/12 h,疗程为12周。本例患者为AIDS合并马尔尼菲篮状菌病,有肝功能不全、三系血细胞明显下降,一般状况差,而两性霉素B不良反应较大,故选用安全性更高的伏立康唑抗马尔尼菲篮状菌治疗,后期予伊曲康唑口服序贯治疗。治疗后患者马尔尼菲篮状菌感染得到控制,治疗有效。在日常工作中,马尔尼菲篮状菌病与其他机会性感染或其他疾病有相似的临床表现,且真菌培养时间较长,早期诊断困难,特别是与其他病原体共同感染时易漏诊误诊,若未及时诊疗,进展迅速,死亡率极高,应引起临床医师充分的警惕。
HPS是由多种复杂病因引起的免疫调节异常,从而使机体处于高炎症状态的一组临床综合征,有起病急骤、进展迅速、死亡率极高的特点。HPS常见临床表现为:高热、淋巴结肿大、肝肿大和/或脾肿大、血细胞减少、肝功能损伤、中枢神经系统症状等。HPS病因多为继发性,感染是最常见的诱因,感染源包括病毒、细菌、真菌以及原虫等,其中病毒感染最常见,包括EBV、CMV、HIV及肝炎病毒等。近年来有研究发现,我国EBV-HPS发病率高于西方国家[7],且在种类繁多的继发病因中,继发于EBV感染的HPS预后最差[8-9]。CMV多为机会性感染,亦可致HPS[10]。马尔尼菲篮状菌病也可引起HPS,无论是否有HIV感染,临床均罕见[11-13]。也有学者报道了葡萄球菌败血症相关的HPS[14]。由于AIDS患者容易合并机会性感染、肿瘤以及抗病毒治疗后可能出现免疫重建炎性反应综合征,这些因素都可以继发HPS,甚至急性HIV感染也可以继发HPS,并且HPS在同一患者中也有可能复发[4,15-16]。AIDS合并感染继发HPS病例多为单一病原体感染,罕见多重病原体感染[4]。所以HIV-HPS发病机制及临床表现复杂多样,且缺乏特异性,有时难以鉴别。继发性HPS的诊断标准[17]满足8条中的5条:①发热超过1周,热峰>38.5℃;②脾肿大;③血细胞减少(累及两系或三系);④高三酰甘油血症(≥3 mmol/L)和/或低纤维蛋白原血症(≤1.5 g/L);⑤骨髓或脾、淋巴结、肝脏发现噬血现象;⑥NK细胞活性降低或缺乏;⑦血清铁蛋白升高(≥500 μg/L);⑧可溶性IL-2受体升高(≥2 400 U/mL)。本例患者高热超过1周,有脾肿大、三系血细胞减少、三酰甘油升高、纤维蛋白原降低,骨髓中有噬血现象,血清铁蛋白明显升高,可溶性IL-2受体明显升高,8项指标中符合7项,HPS诊断明确。HPS的诱导治疗目前参考HLH-1994方案[17]:依托泊苷第1~2周150 mg/m2、1周2次,第3~8周150 mg/m2、1周1次;地塞米松第1~2周10 mg • m-2• d-1,第3~4 周5 mg • m-2• d-1,第5~6周2.5 mg • m-2• d-1,第7周1.25 mg • m-2• d-1,第8周减量至停药。依托泊苷的使用可进行年龄相关性调整:15岁以下患者75~150 mg/m2,15~39岁 患 者75~100 mg/m2,40岁及以上患者50~75 mg/m2。在年长患者中减少依托泊苷用量使患者在治疗过程中有更好的耐受性并且对疗效影响不大。本例患者确诊HPS后予依托泊苷联合地塞米松化疗,因患者高龄,有AIDS合并多重感染,一般情况差,病情危重,治疗时适当减少依托泊苷用量,治疗过程中,患者耐受性好,且后期疗效佳。因患者有多种病原体感染,对其进行足疗程抗细菌、真菌及病毒治疗,并口服甲氧苄啶-磺胺甲唑片预防肺孢子菌肺炎,治疗后感染控制。AIDS继发HPS,可根据个体化原则,依据患者不同状态调整依托泊苷的剂量及用药时间,如效果不佳,可换用其他联合化疗方案、新药或进行异基因造血干细胞移植等治疗。
本例患者是AIDS继发真菌、病毒及细菌多重病原体感染,首发表现为HPS及马尔尼菲篮状菌病,十分罕见,确诊后及时给予抗感染、并化疗控制HPS后取得较好疗效。HPS的临床表现及实验室检查均缺乏特异性,故HPS常因不能早期确诊而使治疗延迟,导致预后不佳。而马尔尼菲篮状菌病与HPS都可有高热、肝脾及淋巴结肿大、血细胞减少等共同表现,当两病并存时极易误诊。若临床诊治中遇不明原因持续发热、血细胞减少、皮疹、肝脾及淋巴结肿大患者,需完善血培养、骨髓培养、病毒检测、骨髓涂片等相关检查明确病情,确诊后应积极干预和治疗,从而降低病死率,改善预后。
